膀胱收缩指数与前列腺增生症患者排尿期症状的关系研究
韦开禄 林玮键 肖宁
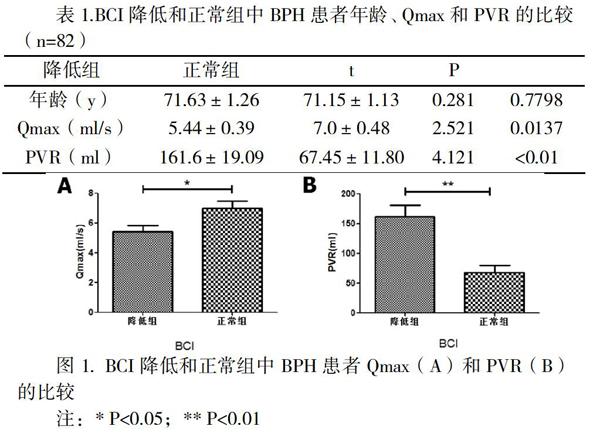
【摘要】目的 探讨膀胱逼尿肌收缩力指标-膀胱收缩指数(bladder contractility index, BCI)与前列腺增生症(Benign prostatic hyperplasia,BPH)患者排尿期症状指标最大尿流率(Qmax)和膀胱残余尿量(post-voiding residual ,PVR)的关系。方法 对82例BPH患者术前行尿动力学检查,比较降低组(BCI<100,39例)和正常组(BCI≥100,43例)患者的一般情况、Qmax和PVR。结果 两组患者年龄相似,降低组Qmax为5.44±0.39ml/s,明显低于正常组(7.0±0.48 ml/s)(P=0.0137);降低组PVR为161.6±19.09ml,明显多于正常组(67.45±11.80ml)(P<0.01)。结论 Qmax<5.4ml/s或PVR>161ml提示膀胱逼尿肌失代偿且纤维化可能,建议及时外科干预,但是合理性仍需进一步研究。
【关建词】:逼尿肌;膀胱收缩系数;最大尿流率;膀胱残余尿量;尿动力学
【中图分类号】R2 【文献标识码】A 【文章编号】2107-2306(2020)04-014-02
The research of relationship between bladder contractility index and symptoms of voiding phase in patients with benign prostatic hyperplasia
Wei KaLu1, Lin WeiJian2, Xiao Ning1,2*
1.Department of urology, The Second Affiliated Hospital of GuiLin Medical Univesity, GuiLin, 541199, China
2.Continence research Clinic,ShaoYang Central Hospital, ShaoYang, 422000, China
[abstract] Objective To explore the relationship between bladder contractility index (BCI) and, respectively, Qmax and post-voiding residual (PVR) of patients with benign prostatic hyperplasia (BPH).Methods The general and pre-operational urodynamic data of 82 patients with BPH was collected, of whose was divided into two groups, BCI decreasing group (BCI<100,n=39)and normal group(BCI≥100,n=43),and age, Qmax and post-voiding residual (PVR) was compared between both groups. Results The age of patients with BPH in two groups was nearly consistency, and Qmax and PVR in BPH patients of BCI decreasing group was, significantly and respectively, lower (5.44±0.39 vs 7.0±0.48ml/s, P=0.0137) and higher (161.6±19.09 vs 67.45±11.80ml ml/s, P<0.01) than normal group. Conclusions The decompensation phase and fibrosis of detrusor may be implied if Qmax is less than 5.4ml/s or PVR over 161ml, at when the surgical procedure should be undergo to preclude detrusor underactivity, but there would be some researches in the surgical rationality in the further.
Keywords: detrusor; bladder contractility index; Qmax; post-voiding residual; urodyanmic
前列腺增生癥(Benign prostatic hyperplasia,BPH)是中老年男性的常见疾病,症状包括尿频、尿急、夜尿增多、排尿费力、尿不尽、尿失禁甚至尿潴留等下尿路症状(lower urinary tract symptoms, LUTS),严重危害患者身心健康[1]。膀胱出口梗阻(bladder outlet obstruction, BOO)是导致BPH患者下尿路症状的原因之一,但是膀胱逼尿肌收缩力降低(underactivity of detrusor contractility, UD)也是一个不可忽视的原因[2]。治疗BPH的方法包括观察等待、药物治疗和手术治疗等,保守治疗无效患者最佳选择为手术治疗,经尿道前列腺切除术(Transurethral resection of prostate,TURP)仍是手术治疗的金标准。但是BPH患者行TURP可以解除BOO,仍有部分患者术后疗效不佳,UD可能是其中重要原因[3]。因此,术前明确BPH患者膀胱逼尿肌收缩力,分析其与患者排尿情况的关系,能够更深入理解患者LUTS的病因,对于预测TURP术后治疗也有重要临床意义。2019年7月至2020年6月,我科收治82例BPH患者,现对患者TURP术前尿动力资料进行分析,探索膀胱收缩指数(bladder contractility index, BCI)与最大尿流率(Qmax)和膀胱残余尿量(post-voiding residual ,PVR)关系。
1.资料与方法
1.1 一般资料 本组BPH患者82例,
年龄56-83岁,急性尿潴留入院31例,膀胱结石35例,其余均以长期保守治疗无效的LUTS就诊入院。本组患者排除神经源性膀胱,无前列腺或盆腔及尿道手术史,无尿道外伤史。TURP和尿动力学检查分别由同一名副主任医师和主治医师完成。其中按照术前尿动力学检查中膀胱收缩指数(bladder contractility index, BCI)分为两组,降低组(BCI<100)39例,常组(BCI≥100)43例,收集两组患者Qmax和PVR(表1)。
1.2 尿动力学检查方法
尿动力学检查采用德国ANDROMEDA尿动力学分析仪,超声采用迈瑞DC-N3型多普勒检查仪。患者及家属均知晓尿动力学检查风险及获益并签署知情同意书。严格遵循国际尿控协会(ICS)颁布的尿动力学技术规范(GUP)进行测定、质量控制和文档记录。患者截石位,常规消毒检查区域,分别经尿道和肛门插入石蜡油润滑的F6和F8测压管至膀胱和直肠,记录膀胱内压和腹内压,两者之差为逼尿肌压。体外调零后,以30ml/min的速率灌注生理盐水,患者感急迫排尿欲时,嘱患者排尿,记录Qmax、Qmax时逼尿肌压力(Pdet.Qmax),BCI=5Qmax+Pdet.Qmax,经腹超声测量PVR。
1.3 统计学分析
所有数据均用表示,采用 SPSS19.0 统计软件进行分析,对所有资料行正态性检验提示服从正态分布,两组资料采用t检验比较,P
2.结果
BCI降低组BPH患者年龄为71.63±1.26岁,相较正常组(71.15±1.13岁)稍高,但是差异无统计学意义(P=0.7798);BCI降低组中Qmax为5.44±0.39ml/s,明显低于正常组(7.0±0.48 ml/s),两组间差异具有统计学意义(P=0.0137);PVR在BCI降低组为161.6±19.09ml,明显多于正常组(67.45±11.80ml),两组具有显著差异(P<0.01)(表1,图1)。以上结果提示,膀胱逼尿肌收缩能力正常的BPH患者相较降低者,Qmax增加和PVR减少,说明逼尿肌收缩能力与BPH患者排尿状况相关。
3.讨论
良前列腺增生症(BPH)以尿动力学上的膀胱出口梗阻(BOO)和临床上主要表现的下尿路症状(LUTS)为特征的一种疾病。BPH通常在40岁之后开始,>50岁的男性中约有50%受到影响,80岁以后,约90%的男性受到影响。BPH患者除外夜尿增多、尿频、尿急、排尿困难、尿不尽、尿失禁、血尿、膀胱结石、尿潴留甚至上尿路损害导致肾功能不全等,还明显增加老年男性患者夜间跌倒几率,给患者带来严重的身心损害和经济负担[1, 4]。治疗方案包括生活方式改变,药物治疗和手术治疗。长期BOO引起膀胱逼尿肌失代偿,最终导致逼尿肌收缩力减弱(UD),造成10%~40%的BPH患者手术治疗后效果不佳,术后仍有排尿困难、残余尿多(≥200ml)甚至尿潴留、尿失禁等,由此常引起患者及家属对手术效果的不满意,甚至引发医疗纠纷[4]。
尿动力学是一门研究尿液从肾输送到膀胱及其在膀胱内储存和排空的生理和病理过程的医学科学[5]。尿动力学检查(urodynamic tests, UDS)包括侵入性尿动力学检查和(invasion urodynamic tests, IUDS)非侵入性尿动力学检查(non-invasion urodynamic tests, NIUDS)[6]。目前评估膀胱逼尿肌收缩力的“金标准”即采用IUDS,经尿道和肛門分别插入测压管进行膀胱和直肠测压,间接测量膀胱逼尿肌收缩力。它的测定核心为各压力测定并计算各压力值、逼尿肌收缩强度(瓦特因子WFmax)、逼尿肌收缩系数(BCI)等[7]。其中WFmax和BCI是目前评估逼尿肌收缩力常用的两个指标,但是由于WFmax涉及较为复杂的电脑程序计算,而且对于尿动力学检查过程中质量控制要求高,一些赝像会导致WFmax发生偏差,甚至无法计算结果。虽然WFmax较BCI在逼尿肌收缩能力分析方面稍具优势,由于BCI=5Qmax+ Pdet.Qmax,因此BCI可以通过复习检查结果时人工校正,计算较WFmax更为简单和方便,临床应用也更为广泛[8]。
BPH患者排尿期症状常表现为排尿费力、尿不尽、间断排尿及尿潴留等,国际前列腺症状学评分(international prostate symptoms score, IPSS)可以对患者储尿期、排尿期的主观症状进行评分,但是鉴于患者人文背景、文化水平及经济状况不一,也造成IPSS难以真实反映患者症状,相较于更为客观的Qmax和PVR,临床应用欠广泛[4]。因此,本研究没有选择IPSS作为研究对象。BPH患者早期可以通过膀胱逼尿肌增厚,实现逼尿肌收缩力增强,克服BOO,此时患者多表现为储尿期症状,如夜尿增多、尿频、尿急等,Qmax降低和PVR增多可能并不明显。若BOO不能得到有效缓解,逼尿肌增厚的代偿期会逐渐发展为失代偿期,病理特征为逼尿肌纤胶原蛋白增加、肌肉组织减少,逐渐纤维化,导致膀胱小梁增生、膀胱憩室等,患者会表现排尿费力、尿不尽、甚至尿潴留等症状[9]。此时,由于逼尿肌收缩力减弱,Qmax和PVR的变化较代偿期更为明显,本研究也证实了这种病理生理过程。
BPH患者大部分因急性尿潴留和膀胱结石而行手术治疗,而前者作为病理过程的不良事件,反映了逼尿肌收缩力减弱,也是失代偿期的重要标志[10]。因此,应该在发生急性尿潴留前,给予患者及时的正确治疗,解除BOO, 减少不良事件的发生。然而,目前国内外相关指南并没将Qmax和PVR的具体数值作为手术指征[4],本研究提示Qmax<5.4ml/s或PVR>161ml,逼尿肌收缩力降低且逐渐失代偿期可能性较大,为了防止逼尿肌的进一步纤维化,应当及时给予外科干预。但是,此时外科干预时机的合理性仍有争议,仍需进一步研究。
本研究仍存在以下缺陷:①纳入病例较少;②缺乏术后的随访资料,未能对两组患者手术后的中长期疗效进行相互分析,明确外科干预时机的合理性;③未能结合患者的BOO程度分析Qmax和PVR的变化。因此,增大样本量,进行中长期术后疗效分析,以及分析排尿期症状中DU和BOO之间的关系,是笔者今后的研究方向。同时,目前检测逼尿肌收缩力完全依赖IUDS,检查费用较高,需要留置膀胱和直肠测压管,存在感染和疼痛的风险,因此研究NIUDS在检测逼尿肌收缩力的应用也十分必要。
本研究通过分析逼尿肌收缩力降低和正常的BPH患者Qmax和PVR,发现前者Qmax低于后者,但是前者PVR明显多于后者,而且Qmax<5.4ml/s或PVR>161ml提示膀胱逼尿肌可能逐渐失代偿并纤维化,应当及时外科干预,但仍需通过扩大样本并进行中长期术后疗效随访予以进一步研究。
参考文献
[1]GORMLEY E A, LIGHTNER D J, FARADAY M, et al. Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline amendment [J]. The Journal of urology, 2015, 193(5): 1572-1580.
[2]MATSUKAWA Y, YOSHIDA M, YAMAGUCHI O, et al. Clinical characteristics and useful signs to differentiate detrusor underactivity from bladder outlet obstruction in men with non-neurogenic lower urinary tract symptoms [J]. International journal of urology : official journal of the Japanese Urological Association, 2020, 27(1): 47-52.
[3]GAMMIE A, KAPER M, STEUP A, et al. Signs and symptoms that distinguish detrusor underactivity from mixed detrusor underactivity and bladder outlet obstruction in male patients [J]. Neurourology and urodynamics, 2018, 37(4): 1501-1505.
[4]GRATZKE C, BACHMANN A, DESCAZEAUD A, et al. EAU Guidelines on the Assessment of Non-neurogenic Male Lower Urinary Tract Symptoms including Benign Prostatic Obstruction [J]. European urology, 2015, 67(6): 1099-1109.
[5]BROWN E T, KRLIN R M, WINTERS J C. Urodynamics: examining the current role of UDS testing. What is the role of urodynamic testing in light of recent AUA urodynamics and overactive bladder guidelines and the VALUE study? [J]. Current urology reports, 2013, 14(5): 403-408.
[6]MANGAT R, HO H S S, KUO T L C. Non-invasive evaluation of lower urinary tract symptoms (LUTS) in men [J]. Asian journal of urology, 2018, 5(1): 42-47.
[7]PATEL B N, KOBASHI K C. Practical use of the new American Urological Association adult urodynamics guidelines [J]. Current urology reports, 2013, 14(3): 240-246.
[8]OSMAN N I, CHAPPLE C R, ABRAMS P, et al. Detrusor underactivity and the underactive bladder: a new clinical entity? A review of current terminology, definitions, epidemiology, aetiology, and diagnosis [J]. European urology, 2014, 65(2): 389-398.
[9]OSMAN N I, ESPERTO F, CHAPPLE C R. Detrusor Underactivity and the Underactive Bladder: A Systematic Review of Preclinical and Clinical Studies [J]. European urology, 2018, 74(5): 633-643.
[10]AGGARWAL H, ZIMMERN P E. Underactive Bladder [J]. Current urology reports, 2016, 17(3): 17.
作者簡介:韦开禄,男,主治医师
*通讯作者:肖宁,男,副教授,邮箱:xy20001816@163.com
基金项目:湖南省科技创新计划项目(编号:2017SK51404);广西卫健委科研课题项目(编号:Z20200894)

