莴笋根部促生菌筛选与促生特性测定
撖冬荣,侯 栋,姚 拓,兰晓君,朱瑞婷
(1.甘肃农业大学草业学院草业生态系统教育部重点实验室,甘肃 兰州 730070;2.甘肃省农业科学院蔬菜研究所,甘肃 兰州 730070)
为了获得优质高产的农产品,我国农业生产中存在不合理施肥现象,不仅是对资源的严重浪费,且会导致土壤养分失衡,破坏土壤团粒结构[2],影响土壤酸碱度,继而导致农产品品质下降,生态环境被破坏。因此,从绿色农业以及生态环境保护等多方面综合考虑,科学家们建议以微生物肥料代替部分化肥,以改良土壤,增加土壤微生物多样性、透气性和保水保肥能力等,同时这也是提高农产品产量和品质、保护生态环境的主要途径[3]。
根际促生菌(plant growth promoting rhizobacteria,PGPR)是指能够在植物根际(根际土壤、根系表面、根内组织)定殖、促进植物生长、矿质营养的吸收和利用、抑制有害生物危害的有益菌类[4]。通过从不同植物分离筛选出的PGPR,利用其固氮、溶磷、分泌植物生长激素等优良特性及提高植物抗病抗逆性研制微生物菌肥,与化肥合理配比可以减少化肥施用量[5]。目前已有研究证明PGPR对于植物生长和作物产量具有积极的促进作用,有研究报道PGPR能够促进马铃薯、辣椒、番茄、茄子、黄瓜、甘蓝和萝卜的生长并能提高产量[6-7];王明友等[8]、刘军辉等[9]研究发现微生物肥料对黄瓜的生长发育有促进作用,其显著提高黄瓜净光合速率、坐果率、产量,并降低硝酸盐含量,因此,筛选出优良菌株为研制微生物菌肥提供菌种资源。
莴笋(Lactucasativa)又称莴苣,其茎、叶均可食用。莴笋含有多种维生素、蛋白质及人体所需的多种微量元素,具有显著的抗氧化、抗肿瘤和抗癌等保健功能,营养价值丰富,是人们喜食的蔬菜[10-11]。其在甘肃地区种植广泛,随着人们对绿色无公害蔬菜的要求以及莴笋市场需求的扩大,提高莴笋产量和品质,种植无公害蔬菜已成为关注热点。但其根际促生菌资源筛选及微生物接种剂(菌肥)尚少见报道。
本研究从来自不同地点的莴笋根部分离PGPR菌株,通过定性、定量测试,筛选获得具有溶磷、固氮、分泌IAA并具有生物防治作用的有益菌株,并利用分子生物学结合部分形态学特征对其进行分类鉴定,以期为莴笋微生物接种剂(菌肥)研制提供优良菌株,并为研发微生物菌肥提供菌种,同时丰富我国PGPR菌种资源库。
1 材料与方法
1.1 材料
样品为2018年10月分别采自甘肃省天水市武山洛门镇文家寺2株、武山洛门镇冶拂村1株、武山洛门镇林家庄1株长势均较好的莴笋,完整采集根系,放入采样箱(保温4℃),迅速带回实验室进行菌株分离,初步获得PGPR菌株。
供试病原菌:黄瓜枯萎病(Fusariumoxysporum)、番茄早疫病(Alternariasolani)均由甘肃农业大学草业学院提供。
1.2 培养基
培养基:无机磷培养基(Pikovaskaia’s,简称 PKO)[12];有机磷培养基(蒙金娜培养基,简称 MJN)[13];LB固体培养基(Luria-Bertani,简称LB);LB液体培养基:LB固体培养基不添加琼脂[14];金氏(King)培养基[15];马铃薯葡萄糖琼脂(potato dex-trose agar,PDA)培养基[16];固氮培养基(nitrogen free medium, NFM)培养基[17];多碳源低氮(CCM)培养基[18]。
1.3 根际促生菌分离筛选及测定方法
1.3.1 溶磷菌分离筛选 将莴笋根系分为2个部分,即根系表面(surface of roots,RP)和根内组织(interior of roots,HP)。利用稀释梯度法将上述2部分分别依次制备成浓度为10-1、10-2、10-3的稀释液。利用平板涂布法,设置3个重复,置于28℃培养箱培养5~7 d,选取PKO和MJN培养基中生长较快、菌落形态较大,菌落周围出现溶磷圈(透明圈)的不同单菌落,用接种环挑取具有溶磷圈的单菌落,进行平板四区划线法重复操作,直至菌株纯化,即为溶磷菌株。
1.3.2 溶磷菌溶磷特性测定 (1)定性测定:将25株PGPR菌株分别接种于有机磷培养基(MJN)和无机磷培养基(PKO)上,每个菌株设置3个重复,以十字交叉划线的方法将溶磷菌在每个培养基上接种4个对称区域,接种后置于培养箱培养(28℃,7 d),每天记录溶磷圈大小(D代表溶磷圈直径,d代表菌落直径)进行初步筛选[19-20]。(2)定量测定:选取培养后D/d>1.5的溶磷菌株,将筛选出的菌株接种于装有50 mL已灭菌(121℃,30 min)LB液体培养基中于28℃,180 r·min-1条件下培养7~10 d。取培养液8 mL于4℃ 9 000 r·min-1条件下,离心15 min,取上清液5 mL于100 ml三角瓶中,同时加入0.5 mol·L-1NaHCO3溶液45 mL和2 g无磷活性炭摇匀,置于摇床(180 r·min-1,30 min)摇动,30 min后用无磷滤纸过滤,准确吸取滤液10 mL于50 mL容量瓶中,采用钼蓝比色法对菌株溶磷量进行测定[21]。
1.3.3 分泌IAA特性测定 (1)定性测定:将23株PGPR菌株接种于盛有已灭菌(121℃,30 min)的50 mL King液体培养基(冷却至室温)的150 mL细口三角瓶中,每菌株3次重复,以不接菌培养基为对照,在28℃、180 r·min-1条件下振荡培养10~12 d。吸取各菌液50 μL于白瓷板上,加50 μL Spot比色液,其中对照加50 μL浓度为0.01‰的3-吲哚乙酸,每处理3次重复,将白瓷板放置于室温黑暗条件下,20 min内观察并记录颜色变化。如变粉红色即能分泌IAA,颜色深浅与分泌IAA能力呈正相关,没有颜色变化即为不能分泌 IAA[22]。(2)定量测定:取上述筛选出菌株的培养液于4℃、10 000 r·min-1条件下,离心10 min,取上清液5 mL加等体积S2比色液,在黑暗下静置30 min后迅速用分光光度计在波长530 nm下测定各待测液的吸光值,在标准曲线上查出待测液的IAA浓度(μg·mL-1)[23-24]。
1.3.4 固氮菌分离筛选 利用平板涂布法[25]将制备好的各浓度(10-1、10-2、10-3)稀释液分别接种到NFM培养基和CCM培养基中,设置3个重复,置于28℃培养箱中培养5~7 d后,进行平板四区划线法重复操作,直至菌株纯化,即为固氮菌株。利用试管斜面保存法将筛选纯化的固氮菌株置于4℃冰箱保存,备用[26]。
1.3.5 固氮菌固氮能力测定 采用乙炔还原法对初步筛选的固氮菌株进行定量测定[27-28]。用接种环分别将20株PGPR菌株接种于盛有5 mL半固体NFM培养基的10 mL血清瓶中,每株菌3次重复,以不接菌培养基为对照,培养结束之后用50 μL平口微量进样器从血清瓶中分别抽取混合气体50 μL快速注入到气相色谱仪气体进样柱内[29],记录并观察C2H4出峰时间及峰面积百分比,计算出菌株固氮酶活性。
1.3.6 菌株生防能力测定 利用平板对峙法筛选溶磷能力较好的10株优良PGPR菌株对黄瓜枯萎病(Fusariumoxysporum)、番茄早疫病菌(Alternariasolani)的拮抗作用。将10株PGPR菌株接种到LB液体培养基中,于28℃、150 r·min-1条件下培养7 d。采用十字交叉法在PDA培养基中心位置分别接种病原菌,在十字两端距中心位置22 mm处接种供试菌株,每个处理3次重复,并设置对照组(平板中央只接种病原菌),置于培养箱在28℃下培养5~10 d,当对照长满整个平板时,采用十字交叉法测量菌落直径,计算抑菌率,以确定10株PGPR菌株对2种病原菌的生防能力[30-31]。
抑菌率(%)=[(D-d)/D]×100
式中,D为对照菌落直径,d为处理菌落直径。
1.3.7 优良PGPR菌株鉴定 将上述分离筛选得到溶磷能力较高菌株PGBA2、MGBC2,分泌IAA能力较高菌株MGBD1、NGNB3,固氮酶活性较高菌株GND5、GNA6、GNB6,生防能力较强菌株MGBC3、MGNB4共9种优良PGPR菌株接种于LB固体培养基中,在28℃培养48 h,挑取单菌落于离心管中,按照细菌基因组DNA提取试剂盒说明书提取细菌总DNA并进行PCR扩增,将PCR产物进行1%凝胶琼脂糖电泳检测,观察扩增片段的纯度并测定DNA浓度[32]。将测序结果在EZBioCloud的16S-basedID中进行同源序列比较分析,采用Mega 7.0软件以邻接法构建所测菌株的系统发育树,自展值为1 000次。
1.4 数据分析
利用Microsoft Excel 2010整理数据,采用SPSS 24.0进行数据分析。
2 结果与分析
2.1 优良根部促生菌筛选结果
通过PKO、MJN、NFM、CCM选择性培养基从不同地点莴笋根部分离、筛选出溶磷菌株25株(溶解有机磷菌株19株,溶解无机磷菌株6株),分泌植物生长激素(IAA)菌株14株,固氮菌株20株,抑制病原菌菌株10株(见表1)。

表1 优良根部促生菌筛选结果
2.2 溶磷菌株筛选及其溶磷能力
通过PKO无机磷培养基和MJN有机磷培养基分离筛选出具溶磷能力的PGPR菌株25株,其中溶解无机磷菌株6株,溶解有机磷菌株19株(表2、表3)。6株溶解无机磷菌株溶磷量在55.28~291.99 μg·mL-1之间,各菌株培养液pH值在4.42~5.87之间,其中以PGBA2菌株的溶磷量最大,为291.99 μg·mL-1。另外,19株溶解有机磷菌株溶磷量在6.49~76.11 μg·mL-1之间,各菌株培养液pH值在6.83~8.27之间,其中以MGBD2菌株的溶磷量最大,为76.11 μg·mL-1。
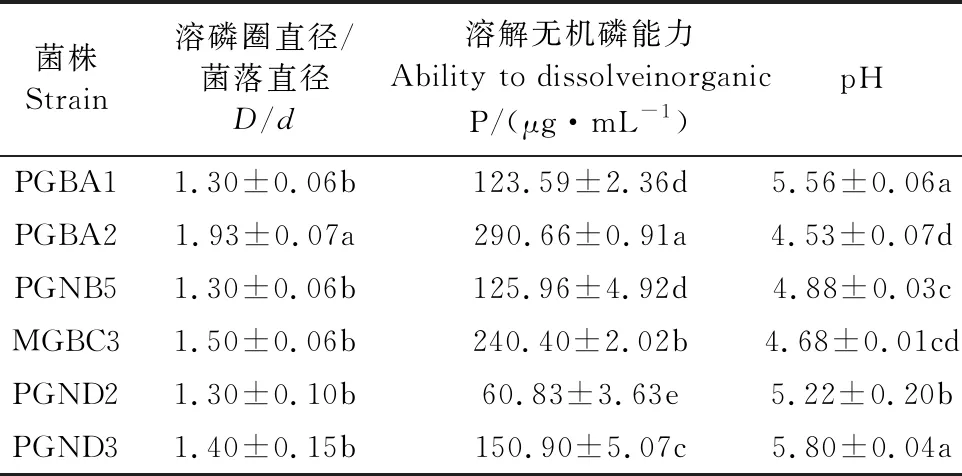
表3 优良PGPR菌株溶解无机磷能力 Table 3 The ability of excellent PGPR strain in dissolving inorganic P
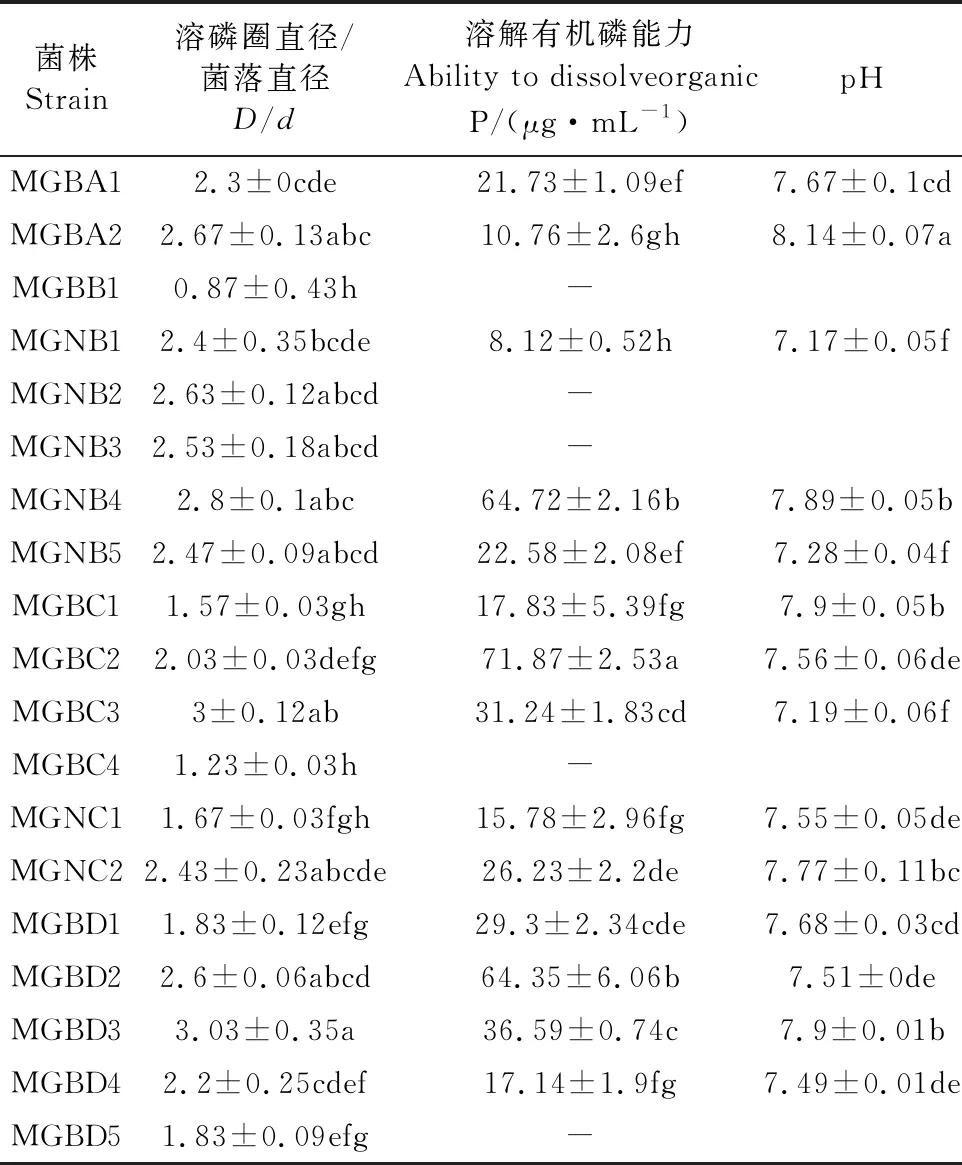
表2 优良PGPR菌株溶解有机磷能力
2.3 优良PGPR分泌生长激素(IAA)的能力
通过测定上述筛选出的14株优良菌株其分泌植物生长激素(IAA)的能力发现,7株菌株具有分泌IAA的能力,分泌量在0.78~5.29 μg·mL-1之间,其中以MGBD1菌株分泌生长激素的能力最大,为5.29 μg·mL-1,菌株MGNB2分泌植物生长激素的能力最小,为2.12 μg·mL-1(表4)。
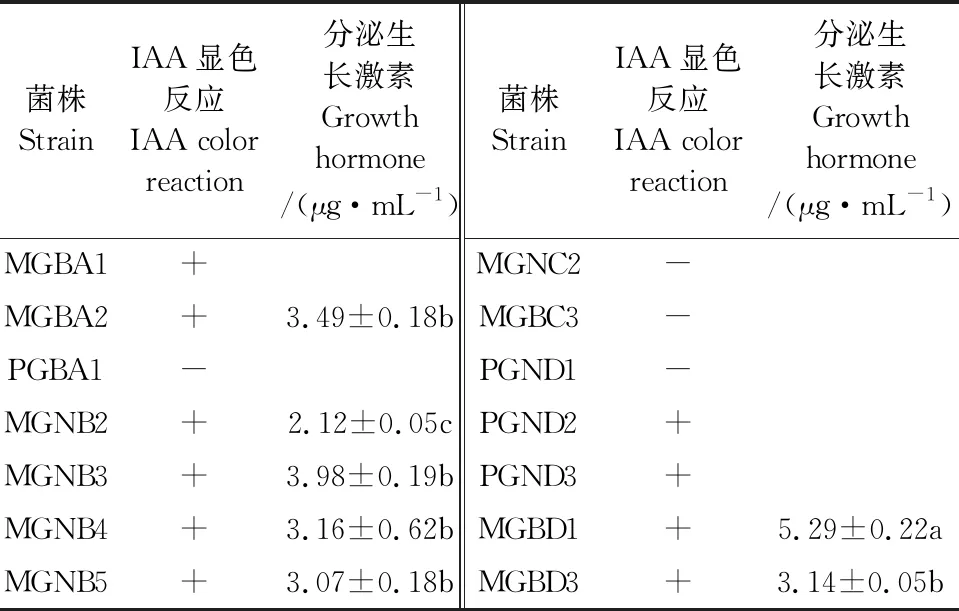
表4 PGPR 菌株分泌IAA能力
2.4 优良PGPR固氮能力
利用选择性培养基NFM和CCM,从莴笋根内组织和根表组织分离出20株固氮菌株,观察菌落形态特征,菌落颜色以白色和乳白色为主,菌落形状大部分为规则圆形且边缘光滑,根据菌落形态特征及生长速度,初步判断菌株固氮能力。进一步对其固氮酶活性进行测定,其固氮能力如表5所示。20株菌株固氮酶活性范围为8.37~371.54 nmol·h-1·ml-1, GNB6固氮酶活性最高,其中固氮酶活性大于100 nmol·h-1·ml-1的菌株共3株,且均分离自莴笋根内组织。

表5 优良PGPR菌株固氮酶活性
2.5 优良PGPR抑制病原菌的能力
通过研究10株PGPR对黄瓜枯萎病(Fusariumoxysporium)、番茄早疫病(Alternariasolani)的抑菌能力,发现10株PGPR对病原菌的抑制效果差异显著,其中仅有PGBA2、MGBC3、MGNB4菌株对黄瓜枯萎病的抑菌率达到50%以上,且对番茄早疫病无抑菌作用(表6)。
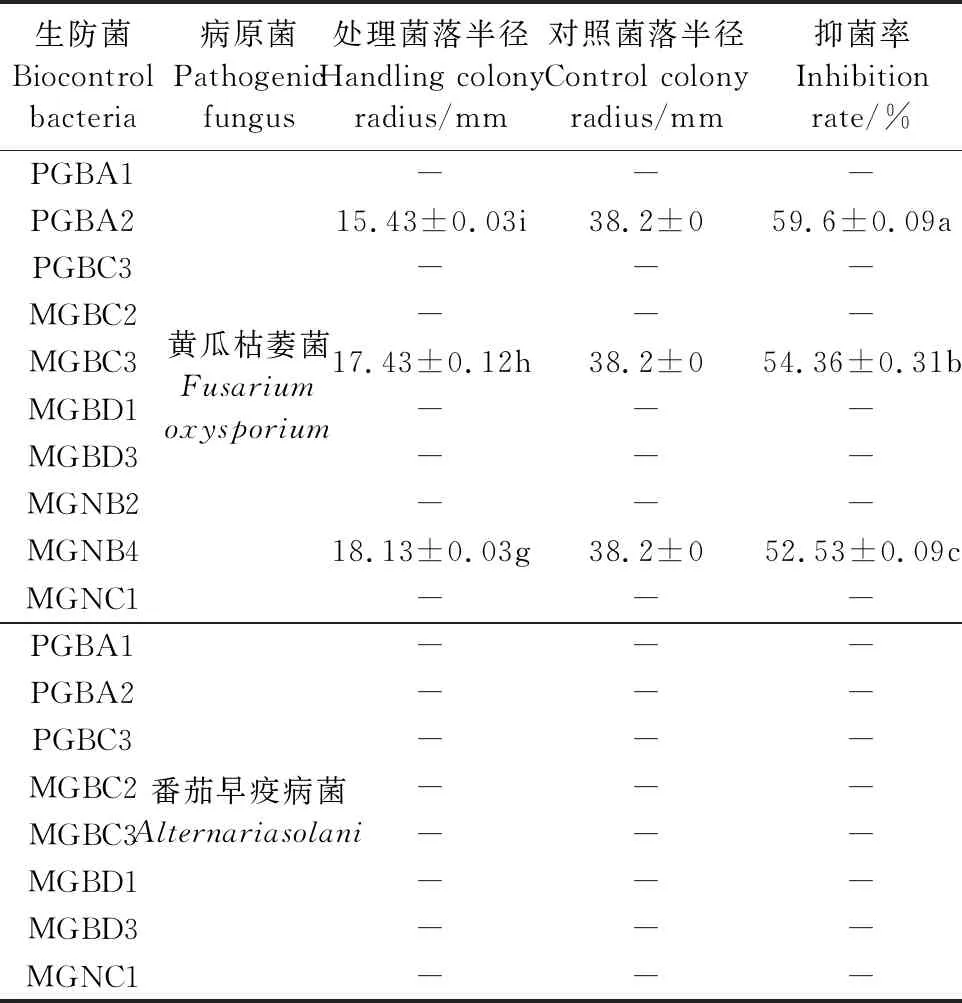
表6 PGPR对病原菌的拮抗效果
2.6 优良PGPR菌株的鉴定
综合评价各菌株促生特性,筛选出9株优良PGPR,对其进行16S rDNA鉴定,通过分子同源序列比对,确定9株菌中MGBC2、MGBC3、PGBA2为醋酸钙不动杆菌(Acinetobactercalcoaceticus),菌株MGNB3、MGNB4为华夏氏肠杆菌(Enterobacterhuaxiensis),菌株MGBD1为假单胞菌(Pseudomonasbrassicacearum),菌株GND5为枯草芽孢杆菌(Bacillussubtilis),菌株GNA6为气泡微细菌(Microbacteriumaerolatum),菌株GNB6为放射型根瘤菌(Rhizobiumradiobacter),并构建菌株系统发育树(图1)。
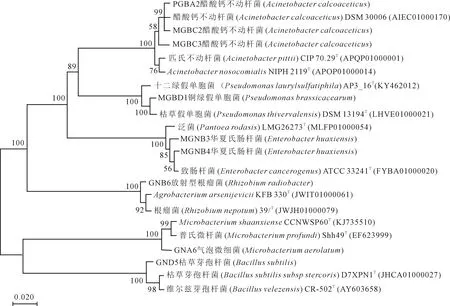
图1 代表菌株16SrDNA基因序列同源性构建的系统发育树Fig.1 Phylogenetic tree constructed by homology of 16SrDNA gene sequence
3 讨 论
本研究通过初筛和复筛发现,溶解有机磷能力普遍比溶解无机磷能力弱,且溶磷圈大小与溶磷能力不完全呈正相关关系,这一结果与赵小蓉等[33],马骢毓等[34]的研究结果相一致。出现这一结果的原因可能是由于溶磷过程十分复杂所导致,微生物溶磷机制包括质子作用、有机酸作用、或二者共同作用,有些细菌培养过程中不分泌酸性物质,而有些细菌在代谢过程中分泌草酸、酒石酸、丙二酸、乳酸和乙酸等有机酸,部分会与金属离子结合,这部分溶磷能力未被测定出来[35],因此测定结果有所偏低;此研究也发现大多数有机磷培养液pH值偏碱性,而无机磷培养液pH值均偏酸性。其次,分离筛选出的溶解有机磷菌株溶磷量较小,可能是菌株将难溶性磷一部分转化为中间物质,未转化成植物可
直接吸收利用的磷元素,这种中间产物会被其他微生物分解为植物可直接吸收利用的磷元素,对植物吸收磷元素起到了间接作用,本实验方法未将这部分溶磷量检测出来,故测定的菌株溶磷能力有所降低。
生物固氮为植物生长提供氮素,在生态系统中是极为重要的氮来源之一。甘肃位于我国西北部,属于干旱半干旱地区,土壤贫瘠,固氮微生物对于提高氮素做出了很大贡献。本研究分离筛选出固氮菌株固氮酶活性较高的3株为气泡微细菌(Microbacteriumaerolatum)、放射型根瘤菌(Rhizobiumradiobacter)和枯草芽孢杆菌(Bacillussubtilis),固氮能力(C2H4)达到371.54 nmol·h-1·ml-1,最低为(C2H4)8.37 nmol·h-1·ml-1,差异极显著。目前报道的具有固氮能力的类芽孢杆菌有18个种[36],这些研究发现不同种之间的固氮酶活性不同,种的不同菌株之间固氮酶活性也不同[37],而且这些联合固氮菌及自身固氮菌不受宿主范围的限制,因此以该类固氮菌制备的生物肥料在农业生产中具有广泛的应用前景。杨鸿儒等[38]在西鄂尔多斯高原荒漠干旱半干旱地区不同植物上发现具有高酶活的固氮菌株且该地区是高酶活固氮作用发生的重要场所;刘彩霞等[39]在碱性土壤中分离出10株具有固氮功能的细菌均属于芽孢杆菌属。本研究筛选出的20株固氮菌其固氮能力较高的有3株且差异显著,可能原因是固氮菌株受植物种类与土壤性质影响[40]。
获得9株促生特性优良菌株,其中醋酸钙不动杆菌(Acinetobactercalcoaceticus)3株,是较为常见的促生菌种类,主要存在水体和土壤中,其不仅具有溶磷能力,还具有生防能力。齐永志等[41]筛选获得1株不动杆菌B3521,缓解了草莓连作障碍;蔺经等[42-43]从樟树中分离的鲍曼不动杆菌,抑制了梨黑斑病、轮纹病和炭疽病等真菌性病害,起到了较好的防治作用。华夏氏肠杆菌(Enterobacterhuaxiensis)安全性尚不明确,其与Pantoea菌株和生癌肠杆菌(Enterobactercancerogenus)极为相似,且这两株菌对人体有害,易引起肺炎,抗药性强[44],因此,MGNB4与MGNB3菌株暂且不适宜成为制作微生物接种剂的菌种资源。枯草芽孢杆菌(Bacillussubtilis)是国际上认可的优良根际促生菌,其繁殖能力强、易存活且具有多种促生功能,成为优良菌种的可能性极大,后期将对其进行验证。本研究筛选出的菌株MGBC3同时具有抗病和溶磷能力,菌株MGBD1具有分泌植物生长激素、溶磷能力,且分泌植物生长激素能力较好,诸如此类以1种功能为主,兼具多种功能的PGPR是研究者重点寻找的宝贵资源。张梦琦等[45]研究发现1株多功能根际促生菌DD3,其兼具溶磷、产铁载体、产HCN等能力,对大蒜株高、抗病能力等均有所提高。因此,筛选多功能菌株在农业生产中具有重要意义,多功能PGPR是珍贵的生物资源。
4 结 论
本研究筛选出溶解有机磷菌株19株,溶解无机磷菌株6株,固氮菌株20株,不同PGPR菌株的溶磷能力和固氮能力存在较大差异。菌株溶解无机磷的能力普遍高于溶解有机磷的能力,溶解无机磷能力最高为290.66 μg·mL-1,溶解有机磷能力最高为71.87 μg·mL-1;菌株固氮酶活性(C2H4)最高为371.54 nmol·h-1·mL-1;分泌植物生长激素IAA菌株14株,菌株MGBD1分泌IAA能力最强,为5.29 μg·mL-1;抑制病原菌菌株3株,且抑菌率均在50%以上。9株优良PGPR菌株鉴定为:3株醋酸钙不动杆菌(Acinetobactercalcoaceticus),2株华夏氏肠杆菌(Enterobacterhuaxiensis),1株假单胞菌(Pseudomonasbrassicacearum),1株枯草芽孢杆菌(Bacillussubtilis),1株气泡微细菌(Microbacteriumaerolatum),1株放射型根瘤菌(Rhizobiumradiobacter),其可为后续研制微生物制剂提供菌种资源。

