多模态MRI联合超声显微手术治疗脑胶质瘤临床疗效及预后分析
刘公洪,宋志富,黄小林,张 丹
脑胶质瘤(brain glioma, BG)是一种最常见的中枢神经系统肿瘤,在原发性颅内肿瘤中占50%~60%[1]。目前,治疗BG的原则是采用手术为主、放化疗为辅的综合治疗[2]。BG手术切除程度影响患者预后情况,切除效果越理想,患者生存时间越长[3]。浸润性生长的BG与正常脑组织之间没有明确的边界。所以,术前、术中准确评估BG切除范围,并设计合适的手术方案是BG手术最为重要的一个环节。近几年,超声探头和仪器不断发展,超声引导技术被广泛应用于神经外科手术中,不过其存在如下缺点:①超声图像质量较差,需要依赖超声医师判读结果;②术中图像常用的是二维图像;③不能穿透颅骨进行术前定位,不能辅助手术计划,只有开颅后方可使用[4]。近几年,核磁共振成像(magnetic resonance imaging, MRI)技术发展迅速。作为一种重要检查方式,多模态MRI被应用于BG术前辅助诊断、术中定位指导和术后评估预后。多模态MRI磁场均匀性良好、梯度系统性能高、解剖图像分辨率高,可获得多种参数成像,如神经血管成像、软组织成像[5]。本研究选择2014年1月—2017年8月本院收治的68例BG患者作为研究对象,探讨多模态MRI联合超声显微手术治疗BG临床疗效,并分析其预后情况。现报告如下。
1 资料与方法
1.1病例选择标准 纳入标准:符合BG的诊断标准[6],经医技检查确诊;在本院接受BG显微手术患者;年龄≥18岁;经本院伦理委员会批准实施。排除标准:多灶性癫痫者;致痫灶与BG无直接关系者;合并严重肝、肾功能不全者;合并其他恶性肿瘤患者;存在精神疾病及认知障碍者;妊娠期妇女。
1.2临床资料 将2014年1月—2017年8月本院收治的68例BG患者作为研究对象,选取行超声显微手术的32例作为对照组,选取行多模态MRI联合超声显微手术的36例作为观察组。2组性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 2组BG患者一般资料比较
1.3治疗方法
1.3.1对照组行超声显微手术:在德国博医来公司生产的Brain-Lab导航系统引导下,设计手术入路,确定手术切除范围。全麻下开颅后,剪开患者脑硬膜,无菌生理盐水冲洗术区并止血后,首先用凸阵探头平行贴附于硬脑膜表面,连续给予无菌生理盐水滴注。查看肿瘤位置、形态、回声特点、血流分布、了解瘤周状况、测量肿瘤长度与宽度及与脑皮层的距离,规划距离术区最短路径,根据该信息提示引导选择相应脑沟、脑回皮质切口和手术通道,并进行血流成像检查,以初步估计肿瘤及瘤周的血液供应情况。超声探查确定病变的位置、距皮层距离及与周围结构的关系,选择最佳入路。在超声指引下,尽可能达到镜下完全切除。术中反复采用超声探查,评估切除范围及残余程度,最大程度保护功能区皮层,在显微镜下操作最大程度切除术区肿瘤,记录残余肿瘤程度与位置。切除后将探头对术区残腔和瘤周表面逐步探查,比较术前超声图像,判断有无残留,并留存相应图像。
1.3.2观察组在对照组基础上使用多模态MRI技术:术前根据弥散张量成像(diffusion tensor imaging, DTI)、弥散加权成像(diffusion-weighted imaging, DWI)、血氧水平依赖性功能磁共振(blood oxygen level dependent functional magnetic resonance imaging, BOLD-fMRI)、氢质子磁共振波谱(hydrogen proton magnetic resonance spectroscopy, HMRS)等检查资料由核磁室医生和手术医生共同评估BG高、低级别、肿瘤边界及判断脑皮质纤维束形态改变及与毗邻肿瘤关系,判断可切除程度,并确定头皮切开部位来选择手术切口和手术入路,术中对于功能区则参照DTI结果指导手术后医师判断肿瘤与纤维束、重要功能区的结构空间关系,超声引导下避开功能区,选择距离肿瘤最近,且无重要大血管走行的脑沟、脑回入路,逐步接近切除病灶。采用与对照组相同的肿瘤切除操作最大程度的切除患者术区肿瘤。
1.3.3术后处理:术后常规转重症监护病房治疗,动态监测患者意识状态、瞳孔变化、血压数值、尿量、颅内压变化、术区引流量变化情况,注意预防术后脑出血、急性脑水肿、脑积水等并发症。术后24 h内行头部CT检查明确术后颅内状况及有无颅内出血、脑梗死等情况,手术后3 d内行头颅MRI检查评估患者肿瘤切除程度。
1.4观察指标
1.4.1手术切除范围:术后1周,2组均行头颅MRI复查,评估手术切除范围。评价标准参考文献[7]。全切:肿瘤切除体积为≥95%;次全切:肿瘤切除体积为85%~94%;部分切除:肿瘤切除体积为<85%。全切除率=全切例数/总例数×100%。
1.4.2卡氏功能状态(KPS)评分:术前和出院时,2组参照KPS评分[8]评价健康状况,计分0~100分,分值越高提示健康状况越好。
1.4.3病死和复发情况:术后随访2年,患者每6个月到门诊复诊或电话随访,记录患者病死和复发情况、癫痫控制情况。
1.4.4癫痫控制情况:术后2年,参照Engel's疗效分级标准[9]评估2组癫痫控制情况。分级标准:I级为发作完全消失或仅有先兆;Ⅱ级为发作次数极少(≤3次/年);Ⅲ级为发作>3次/年,但发作次数减少≥75%;Ⅳ级为发作次数减少<75%。

2 结果
2.1手术切除范围 观察组手术全切除率高于对照组,差异有统计学意义(P<0.05)。见表2。

表2 2组BG患者手术切除范围比较(例)
2.2KPS评分 观察组术前KPS评分为(60.75±9.64)分,出院时为(78.26±10.48)分,对照组术前为(60.52±9.36)分,出院时为(70.58±10.71)分。2组出院时KPS评分均高于术前,且观察组高于对照组(P<0.05)。
2.3并发症情况 术后1周内,观察组并发症发生率低于对照组,差异有统计学意义(P<0.05)。见表3。
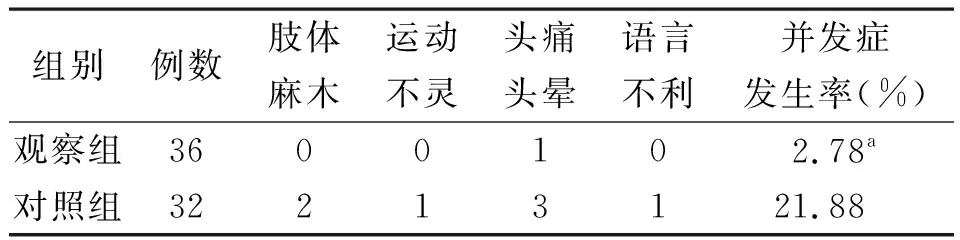
表3 2组BG患者并发症情况比较(例)
2.4病死率和复发率及癫痫控制情况 术后2年,观察组病死率和复发率明显低于对照组,癫痫控制情况优于对照组(P<0.05,P<0.01)。见表4。
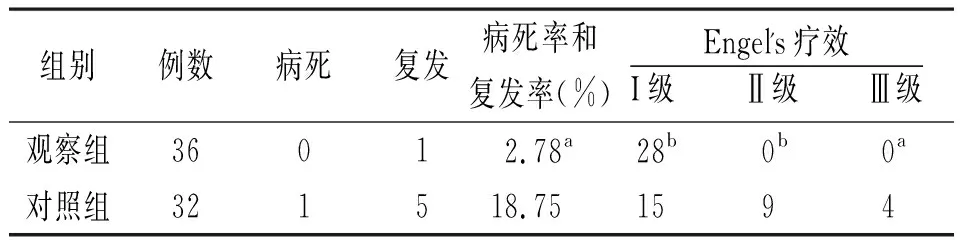
表4 2组BG患者病死率和复发率及癫痫控制情况比较(例)
3 讨论
BG是一种常见的脑部肿瘤,手术是BG的首要治疗手段,BG边界不清、与致痫灶、脑功能结构关系密切容易导致术中彻底切除困难,手术切除效果对BG预后情况产生重要影响[10-13]。多模态MRI融合fMRI、常规MRI和DWI技术将脑功能影像与脑结构影像相结合,实现BG、癫痫灶和重要功能区可视化,直观地显示BG位置、视辐射走向和枕叶视皮层及三者之间的空间关系,据此设计出可避开脑功能区的手术方案,最大程度地切除BG和致痫灶,降低并发症发生率[14-15]。本研究结果显示,观察组手术全切除率高于对照组,提示多模态MRI联合超声显微手术治疗BG可以提高手术全切除率。分析原因为观察组增加了多模态MRI而起到指导定位的作用。KPS评分可以衡量患者生存质量[16]。本研究结果显示,观察组出院时KPS评分明显高于对照组,提示显微手术中运用联合辅助技术可以提高患者生存质量。其原因在于当BG位于脑干等功能区时,手术操作容易影响相关功能区。多模态MRI辅助技术可以有效保留正常脑功能区,所以观察组出院时KPS评分较高。
多模态MRI技术可以最大程度地切除致痫灶,进而有效控制癫痫情况。岳向勇等[17]指出,多模态MRI联合超声显微手术可最大程度的切除BG和致痫灶,本研究结果与其一致。本研究结果显示,术后1周内,观察组并发症发生率明显低于对照组,显微手术中运用联合辅助技术可以明显降低并发症发生率。其原因在于多模态MRI技术通过在术前准确定位BG、致痫灶和邻近的重要功能结构,并明确其边界,设计合理的手术入路方案,避开重要功能区,从而可以明显降低并发症发生率[18-19]。
鲍得俊等[20]指出,多模态MRI联合超声显微手术可以最大范围地保护正常脑组织,并最大程度地切除BG,提高术后生存质量,本研究结果与其一致。本研究结果显示,术后2年,观察组病死和复发率明显低于对照组,提示显微手术中运用联合辅助技术可以降低病死和复发率。原因可能是多模态MRI技术通过直观地反映枕叶视皮层、视辐射走向、病变位置及三者的空间关系,可以最大程度地切除BG,有效控制疾病发展和复发[21]。本研究结果显示,术后2年,观察组Engel's疗效分级Ⅰ级例数明显多于对照组,Ⅱ、Ⅲ级例数明显少于对照组,提示显微手术中运用联合辅助技术可以有效控制癫痫的发生。这可能是因为癫痫是BG临床上最常见的症状,难以通过药物来治愈[22]。
综上所述,多模态MRI联合超声显微手术治疗BG可以提高手术全切除率和生存质量,降低病死率和复发率,有效控制癫痫的发生,降低并发症发生率。

