银杏叶提取物对大鼠局灶性脑缺血再灌注组织中缺氧诱导因子-1α表达的影响
王淑英 王为光 高占群 李尧 李文 侯丽然 刘月霞 赵文杰
(佳木斯大学 1基础医学院,黑龙江 佳木斯 154007;2附属第一医院;3海南医学院第一附属医院)
由缺血导致的脑血管疾病有发病率高、死亡率高、复发率高的特点,且再灌注过程中伴有脑组织进一步损伤。目前,临床尚不能完全阐述缺血再灌注损伤的发病机制,对其还缺乏有效的治疗手段。本实验旨在通过观察脑缺血再灌注损伤后大鼠的神经病学行为、神经元病理学变化、缺氧诱导因子(HIF)-1α表达及银杏叶提取物(EGB)对其影响,探讨EGB发挥脑组织保护作用的机制。
1 材料与方法
1.1实验动物及分组 Wistar大鼠,性别不限,体重280~380 g,被随机分为假手术组(n=15):分离大脑中动脉,不进行栓塞;模型组(n=15):栓塞大脑中动脉2 h,再进行24 h灌注;EGB治疗组(n=15):栓塞大脑中动脉2 h,栓塞后2 min内通过尾静脉注射EGB(20 mg/kg),再进行24 h灌注,期间共给药3次。大鼠术前自由饮水,禁食12 h。
1.2模型制备 参考Nagasawa等〔1〕、汪家龙等〔2〕、罗勇等〔3〕报道的方法,颈内动脉线栓法制备脑缺血模型。将大鼠用3.5%水合氯醛(350 mg/kg)腹腔注射麻醉。固定,正中切开颈部皮肤,将右侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA)钝性游离。由CCA分叉处向头端依次游离,ECA的分支用电热烧灼器烧断,使其主干游离。再分离ICA至颅底。将CCA和ICA用蛙心夹夹住,在ECA(近CCA分叉处)上剪一小口,将栓子沿切口插入,经CCA分叉处并将事先放置在ECA根部的手术缝合线扎紧,防出血和栓子滑出,放开ICA上的蛙心夹,将栓子缓慢地向ICA入颅方向插入19~21 mm,稍有阻力即止,栓子头端停留在大脑中动脉(MCA)与大脑前动脉的分叉处,固定栓子,栓塞完成。2 h后,将栓子轻拉使其头端回到ECA内,即开始MCA再灌注。假手术组除不插线外,其他皆同模型组。EGB治疗组术后2 min内大鼠尾静脉注射EGB,20 mg/kg,3次/d,假手术组和模型组注射同等量的生理盐水。每组均在再灌注24 h后取材。
1.3神经病学评分 参照Kuluz等〔4〕三级神经病学评分标准。评分如下:0级:大鼠活动正常,无缺陷;1级:大鼠右侧Horner征呈阳性;2级:将大鼠提尾悬空,其左前肢曲屈、内收;3级:自主运动时大鼠向偏瘫侧(左侧)划圈。脑缺血后,大鼠1、2、3级体征都有的被视为造模成功,可进行后续试验。
1.4脑组织病理学观察 参照陈春花等〔5〕报道的方法,腹腔麻醉后大鼠进行左心室插管灌注,室温条件下快速灌注250 ml生理盐水,4℃条件下缓慢灌注150 ml 4%多聚甲醛1 h左右后快速取脑,6~8 h 4%多聚甲醛溶液固定,再入30%的蔗糖中,待组织沉底后制20 μm厚的冰冻切片,每间隔5张切片取1张,然后将切片进行Nissle染色。
1.5HIF-1α免疫荧光组织化学法测定 参考陈春花等〔5〕报道的方法,切片在0.01 mol/L磷酸盐缓冲液(PBS)内摇洗3次后,Triton X-100液30 min(37℃),3%过氧化氢20 min(避光),血清封闭20 min(37℃),分别滴加1∶100抗HIF-1α抗体于切片上,4℃冰箱过夜。第2天复温1 h后PBS摇洗3次,滴加荧光抗体37℃30 min,PBS摇洗3次,37℃恒温水浴箱20 min,PBS摇洗3次,封片。
2 结 果
2.1神经病学评分 假手术组体征无变化;模型组缺血2 h内体征为右侧Horner征阳性,提尾时左前肢内收、屈曲,爬行时向左划圈,再灌注后24 h、仍表现为Horner征阳性,提尾时左前肢屈曲内收,爬行时向左划圈;EGB治疗组神经病学评分较模型组(15例均为Ⅲ级)有明显改善,缺血2 h再灌注24 h后46.67%(7例)大鼠评分由Ⅲ级转为Ⅱ级(5例)或Ⅰ级(2例)。
2.2脑组织病理学观察 假手术组:光学显微镜下观察,大脑皮质神经元形态结构完整、清晰,无水肿现象。神经元胞体较大,可见尼氏体核大、淡染、圆且规整,核仁明显,染色质分布均匀。模型组:神经元胞体肿胀,尼氏体减少或溶解,核固缩或溶解。部分神经元皱缩,变形呈三角形。EGB治疗组:神经元胞体仍有肿胀,但肿胀明显减轻,结构较清晰,核固缩、尼氏体溶解程度均较模型组减轻(图1)。
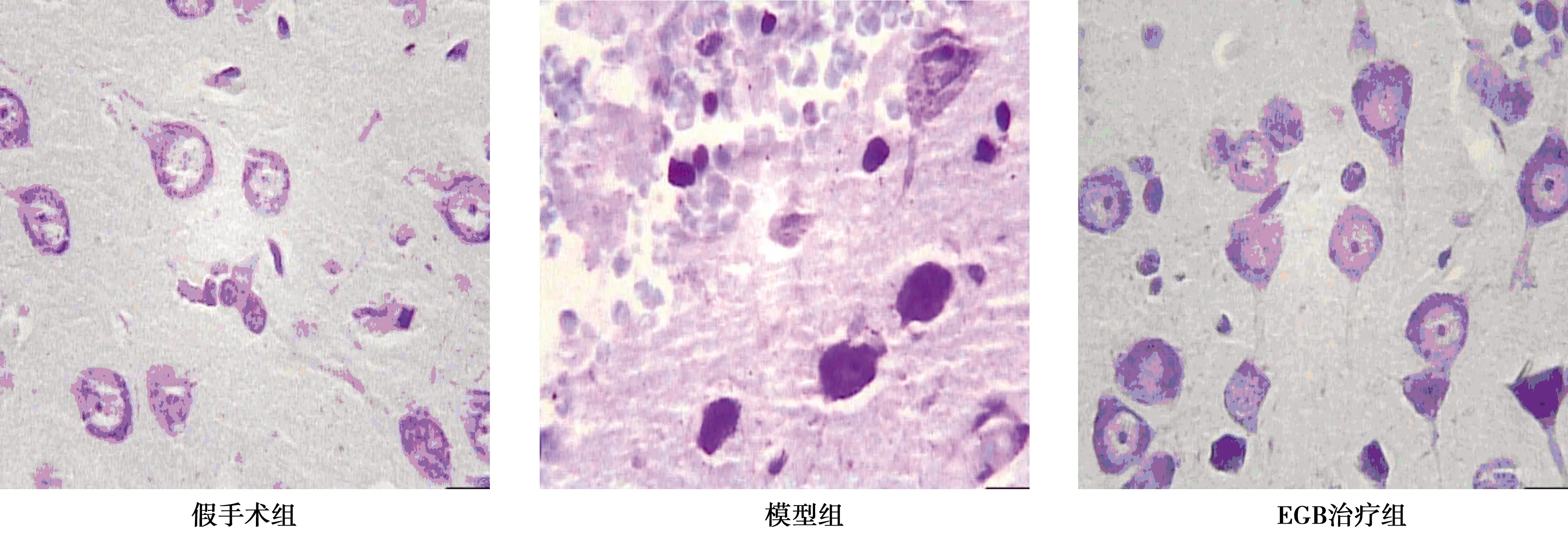
图1 各组脑组织尼氏体(Nissle染色,×400)
2.3HIF-1 α免疫荧光结果 假手术组未见HIF-1α表达,模型组HIF-1α表达明显,EGB治疗组HIF-1α表达较MCAO/R组明显增多(图2)。

图2 各组HIF-1α表达(免疫组织化学,×100)
3 讨 论
银杏被作为药用植物使用的历史由来已久,在宋朝时银杏叶就被用于治疗哮喘和支气管炎。有实验表明,EGB对高血压、冠心病、心绞痛、动脉硬化、老年性记忆减退、老年性痴呆、脑功能减退、衰老等与心脑血管循环有关的疾病有显著的预防和治疗效果〔6,7〕。这些研究主要集中在动物神经行为学方面的改善或药物依赖中的相互作用等方面,对中枢神经系统病理损伤作用的研究较少。HIF-1主要由α和β两个亚基构成,属于具有螺旋一环一螺旋(BHLH)/Per-Arnt-Sim(PAS)结构域的蛋白家族成员。HIF-1的功能实际上依赖于α亚基的蛋白质水平与活性〔8〕。HIF-1α在缺氧缺血性脑损伤中起重要作用〔9〕。HIF-1α在全身缺氧、各种缺血脑组织中被激活。永久结扎成年大鼠大脑中动脉〔10〕,在缺血半影区,缺血7.5 h后能观察到HIF-1α mRNA表达上调,缺血19~24 h达最高值。在HIF-1α mRNA表达上调的缺血半影区,局灶性脑血流量减少,推测脑血流量减少致O2供应减少,进而诱导HIF-1α mRNA表达增强〔11〕。HIF-1α为一种转录因子,可对多种基因的转录进行调节,其转录产物能使细胞耗氧量降低,或使缺氧组织的氧供应增加,从而缓解氧供与求之间的矛盾,维持内环境稳定。机体对缺氧产生了耐受和适应,在缺血缺氧导致脑血管病的发病及病程发展过中,HIF-1α产生将对其形成保护〔8〕。本研究结果提示脑缺血再灌注损伤过程中EGB能诱导HIF-1α表达增加,对脑缺血再灌注损伤具有保护作用。

