2种化学药物对高原鼢鼠行为及生理的影响
蔡志远,王缠,郭怀亮,姚宝辉,谭宇尘,苏军虎*
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中美草地畜牧业可持续发展研究中心,兰州730070;2.甘肃农业大学-新西兰梅西大学草地生物多样性研究中心,兰州730070)
应激是指当机体受到外源有害因子刺激,如温度、噪音、创伤、疼痛以及生存环境的变化和环境污染等因素时,机体所产生的一系列非特异性反应的总和(Selye,1976,1998)。当机体受到内外因素的刺激时,神经内分泌系统会被激活,这种刺激来源(应激源)进一步激活机体以蓝斑-交感-肾上腺髓质系统(sympathetic-adrenal-medulla axis,SAM)和下丘脑-垂体-肾上腺皮质轴(hypothalamic-pituitary-adrenal axis,HPA)为主的神经内分泌反应,由此引发机体全身非特异性应答反应(Herman &Cullinan,1997;Carrasco &Van de Kar,2003)。Mason等(1990)发现,应激反应的程度不仅与外部环境的变化有关,也与个体对应激源的认知有密切联系,同种应激刺激可能诱发焦虑应激,也可能导致抑郁性应激。在Selye的基础上,学者们对应激学说不断地指正完善,使对应激的研究更加深入(Krantz,1983;Lazarus,1985;尤柯,1990)。
从生物学角度来看,机体在正常生长环境下处于自我平衡状态。当机体偏离正常生存环境时,受到外源环境的有害刺激,此种有害因子会与机体的自我平衡状态发生冲突,强烈的刺激或者疼痛会使肾上腺分泌交感素并导致血压升高(姜春雷,王云霞,2015)。野生动物不同于一般家畜,它们对环境的敏感程度远大于人工饲养的动物,当野生动物处在人工饲养条件下时,由于生存环境发生剧烈改变,应激源增多,机体应激发生的几率增大。自然环境的变化,如温度、湿度、生存空间密度,人为干扰,如喂食、噪音等扰动,这些刺激远大于野生动物所处的自然环境(李朝军等,2015;郑玉瑶,2016)。不论是自然环境的变化还是人为干扰均加剧了动物应激反应,使其免疫机能下降,行为出现异常,生长发育严重受阻,内分泌系统紊乱,严重时可能死亡(Dashow &Epple,1985;Suomi,1987)。
随着野生动物实验动物化的发展,越来越多的科研机构开展了人工饲养繁育野生动物的项目,而在饲养管理的过程中,野生动物的应激反应是人工饲养繁育的一大难点(陶元清,张静宵,1996;何诚,2006;贺争鸣,2010)。目前,为预防以及缓解人工饲养条件下野生动物的应激,已有部分人工饲养野生动物抗应激研究的报道(何岚等,2014;张永宾等,2014),其中除了在养殖管理以及动物饲料喂食管理等方面能够在一定程度上减少动物应激,药物治疗在动物抗应激中也起到重要作用(王万华等,2009)。常规的药物治疗中,通常以在动物饲料中添加抗应激添加剂作为一种治疗手段,在一定程度上能够提高动物的抗应激能力。而在特殊情况下,野生动物经过长时间运输至新的饲养环境,强烈的刺激可能导致动物处于自身无法调节的应激状态,此时可以给动物服用或注射镇定和安定药物来降低应激所造成的危害(张永宾等,2015;刘学森,2017)。
高原鼢鼠Eospalaxbaileyi隶属啮齿目Rodentia鼹形鼠科Spalacidae鼢鼠亚科Myospalacinae凸颅鼢鼠属(苏军虎等,2015),广泛分布于甘肃河西走廊以南的祁连山地、甘南藏族自治州、青海省等地区(康宇坤等,2018)。高原鼢鼠对于高原自然环境有很好的适应能力,是青藏高原特有物种之一(樊乃昌,施银柱,1982),其长期在地下挖掘、觅食,对于低氧潮湿环境,形成了很强的适应性(王晓君等,2008)。一方面,高原鼢鼠加剧了天然草地退化和荒漠化进程(钟文勤,樊乃昌,2002),鼠害防治迫在眉睫;另一方面,高原鼢鼠对低氧、潮湿环境的独特的适应性等,成为生理学、医学和生态学等研究的良好模型(安志芳等,2020),而新的防控机理的研发和相关生理、生态学研究均需要室内可控实验的完成,但高原鼢鼠的室内养殖至今仍具极大挑战。高原鼢鼠对高海拔自然环境有很强的适应能力,而在室内饲养条件下难以成活,因环境的剧烈变动对高原鼢鼠来说是致命的。对野生动物来说,生存环境的变化使其长期处于应激状态下,轻者影响或降低动物生产性能,重者导致疾病和死亡(李进军,2018),对动物机体及上述各方面造成不可逆的影响,因此动物的存活问题成为实验中最大的难点。研究发现,生存环境的剧变作为一种外源应激,一般伴有强烈的精神刺激,从多方面对机体造成损伤,在众多疾病的发生与发展中起到重要作用(Gregoryetal.,2011),野生动物生境的变化会进一步加强机体焦虑的症状(张强等,2011)。
为研究应激机体自身是否能够通过药物治疗从而达到改善焦虑应激程度的目的,本研究采用改变高原鼢鼠生存环境的方法,迫使其处于一种过度焦虑的应激状态,同时采用2种不同类型的抗应激药物——醋酸奥曲肽和米非司酮对应激机体进行干预,探索高原鼢鼠的应激是否得到改善。已有研究表明,动物处于应激状态下会表现出近似人类的行为,并且其机体生理功能出现紊乱,因而动物行为学在应激领域具有重要意义(Wilsonetal.,2015)。应激水平的测定包括一系列生理指标与行为学指标,在生理指标上可参考动物摄食、体质量、心率以及应激激素表达量等,行为学测定上以常见的焦虑模型,如高架十字迷宫、旷场实验、明暗箱及水迷宫实验为主(徐佳,2012)。本研究采用采食量、体质量、心率和激素等生理指标,以及旷场行为来评价高原鼢鼠的应激水平,并首次对2种不同药物缓解应激的效果进行了比较。旨在探寻2种抗应激药物对高原鼢鼠应激反应的改善作用,以提高室内饲养条件下高原鼢鼠的成活率,为其后续研究以及资源利用等提供参考。
1 材料与方法
1.1 材料
1.1.1 实验动物2019年8—10月,在非繁殖季节捕捉并筛选出无损伤的高原鼢鼠84只,雌雄各半。实验动物均来自甘肃省定西市岷县等地区(103°41′29″~104°59′23″E,34°07′34″~34°45′45″N)。将活捕的高原鼢鼠用小型哺乳动物运输笼运送至甘肃农业大学动物饲养室进行人工饲养,将高原鼢鼠放置在长50 cm×宽40 cm×高40 cm带盖子的收纳箱中(开有透气孔),为模拟高原鼢鼠地下生存环境,箱内装有1/3的干净土壤和一个直径8 cm的PVC管,并保证动物饲养室内处于完全黑暗状态。室温18~20 ℃,每只高原鼢鼠将被单笼饲养且保证空气通畅。每日08∶00喂食新鲜红薯Ipomoeabatatas,喂食量按照每100 g体质量给予 30 g。为减少长途运输以及捕捉行为对高原鼢鼠造成的过度应激,筛选的高原鼢鼠在室内环境下适应2 d后正式开始实验,之后进行动物行为学及其他生理生化指标的测定,以最大程度减少其他因素对药物实验结果的干扰。
1.1.2 药物醋酸奥曲肽购自上海源叶生物科技有限公司(批号:P13S8Y43599),用水溶解为浓度10 μg·mL-1。米非司酮购自上海麦克林生化科技有限公司(批号:C10039007),用水溶解为浓度10 mg·mL-1。
1.2 方法
1.2.1 实验分组将高原鼢鼠分为对照组(生理盐水灌胃)、醋酸奥曲肽组、米非司酮组,每组28只,雌雄各半,每只高原鼢鼠单独编号。考虑到野生动物对药物的耐受程度以及减少人工给药给动物造成的应激,给药体积为每100 g体质量0.1 mL,采取灌胃的方式间隔给药,给药7 d。
1.2.2 生长性能测定以7 d后仍然成活的高原鼢鼠数据为准,分别以体质量变幅和采食量计算其生长性能。于实验第1天、第7天称量各组成活高原鼢鼠的体质量,以实验前后的体质量差值计算7 d 后体质量变幅。实验7 d内,每天称量食物重量,同时对隔天的剩余食物进行称量回收,计算7 d内食物摄入总量。
1.2.3 心率测定心率是反映自主神经系统功能的一项指标,反映了个体适应压力的能力,在一定程度上可反映出机体当前所面临的应激水平(Tanetal.,2011)。心率检测参考程琪等(2017)和Qu等(2018)的方法,在安静无噪音的房间内进行,使用录音棒(索尼立体声数码录音棒,ICD-SX2000)录制每只高原鼢鼠的心跳声2 min,数据分析时截取稳定无杂音的心跳声15 s,以此计算每分钟心跳次数。
1.2.4 行为学测定旷场行为目的在于测试动物在进入陌生环境的下意识反应,结合其他行为学等指标,能够对动物的情绪状态做出评判(Cholerisetal.,2001)。模拟暗光环境,通过长100 cm×宽100 cm×高40 cm的玻璃旷场实验箱,实验箱底部划分为25个20 cm×20 cm的方格,中央格为箱体中间的9格,余下16格为外周区域。每组至少 8只以上的健康高原鼢鼠,雌雄各半。实验开始时轻轻抓住尾巴将其放置在正中央格后,记录5 min内的行为表现,每只动物只进行1次测定。每只测定结束后,彻底清洁,同时用浓度25%的酒精对实验箱体内外擦拭,以消除其他高原鼢鼠的气味等(林晓春等,2010;吴晓玲,张贵锋,2018)。
参考Walsh和Cummins(1976)、Alstott和Timberlake(2009)中旷场实验行为的研究方法,检测指标有:中央格停留时间[高原鼢鼠进入旷场实验箱内到第一次离开中央格(中央9格区域)的时间]、移动格子数(高原鼢鼠四肢踏入一个格子内视为移动1格)、攀爬频次(高原鼢鼠前爪离地或攀附周壁)、修饰频次(高原鼢鼠用四肢进行挠痒、舔舐身体等梳理行为)、排便及排尿分值(有尿液记为1分,粪便按照颗粒计数进行记分)和中央格穿越次数(从高原鼢鼠第一次离开中央格后再次进入开始计算)。
1.2.5 应激激素测定实验结束后,每组6只(雌性3只,雄性3只)供试动物断颈取血,由于高原鼢鼠在受到威胁的同时具有强烈的攻击性,考虑到实验操作人员的安全,以及采血的同时机体受到强烈的刺激会导致血浆激素的变化,血液采集在乙醚麻醉后进行。血清样本-80 ℃保存。采用酶联免疫吸附测定试剂盒(绿叶生物科技有限公司)定量测定高原鼢鼠血清应激激素水平,包括皮质酮(CORT)和促肾上腺皮质激素(ACTH)。
1.2.6 死亡率统计实验周期为14 d,参与死亡率统计的为各组全部的28只供试动物,用于采集激素指标处死的动物不计入死亡率。7 d后各组死亡率以前7 d每日意外死亡为准,14 d后各组死亡率以整个实验周期14 d内意外死亡的动物为准。
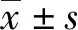
2 结果
2.1 生长性能
给药7 d后,各组高原鼢鼠的体质量均有不同程度下降,但降幅之间的差异无统计学意义(P>0.05)(图1:a);但2种药物组体质量的降幅均小于对照组。同时,2种药物组的采食量均高于对照组,且差异均有统计学意义(P<0.05);2种药物组之间的差异无统计学意义(P>0.05)(图1:b)。
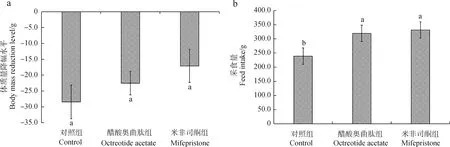
图1 给药7 d后各组高原鼢鼠体质量(a)和采食量(b)的变化Fig.1 Body mass (a) and feed intake (b) changes of Eospalax baileyi in each group after 7 days of treatment
2.2 心率
给药7 d后,2种药物组和对照组的心率之间的差异均无统计学意义(P>0.05)。
2.3 旷场实验行为学测定
给药7 d后,醋酸奥曲肽组高原鼢鼠中央格停留时间大于对照组,差异有统计学意义(P<0.05);米非司酮组中央格停留时间大于对照组,但差异无统计学意义(P>0.05);2种药物组之间的差异无统计学意义(P>0.05)(图2:a)。各组高原鼢鼠中央格穿越次数之间的差异均无统计学意义(P>0.05)(图2:b)。
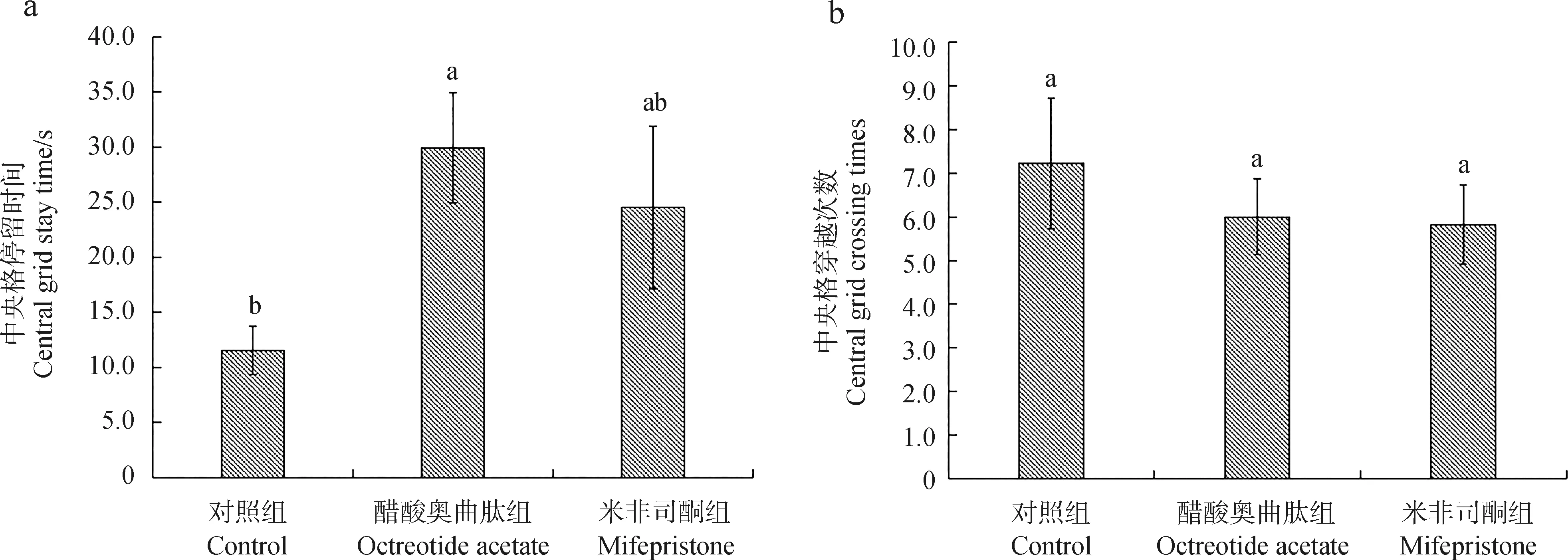
图2 给药7 d后各组高原鼢鼠5 min内旷场实验的中央格停留时间(a)及中央格穿越次数(b)Fig.2 Comparison of central grid stay time (a) and central grid crossing times (b) of Eospalax baileyi in open field test within 5 min after 7 days of treatment
给药7 d后,2种药物组高原鼢鼠移动格子数均显著少于对照组(P<0.05),但2种药物组之间的差异无统计学意义(P>0.05)(图3:a)。2种药物组的攀爬频次也均显著少于对照组(P<0.05),但2种药物组之间的差异无统计学意义(P>0.05)(图3:b)。醋酸奥曲肽组高原鼢鼠的修饰次数多于对照组,差异无统计学意义(P>0.05);米非司酮组的多于对照组,且差异有统计学意义(P<0.05),2种药物组之间的差异无统计学意义(P>0.05)(图3:c)。各组间的排便及排尿分值之间的差异均无统计学意义(P>0.05)(图3:d)。
图3 给药7 d后各组高原鼢鼠5 min内旷场实验的移动格子数(a)、攀爬频次(b)、修饰频次(c)和排便及排尿分值(d)
2.4 应激激素对比
给药7 d后,2种药物组高原鼢鼠的CORT水平均低于对照组,其中,米非司酮组显著低于对照组(P<0.05),但2种药物组之间的差异无统计学意义(P>0.05)(图4:a)。醋酸奥曲肽组的ACTH含量与对照组之间的差异无统计学意义(P>0.05),但米非司酮组的显著低于对照组和醋酸奥曲肽组(P<0.05)(图4:b)。
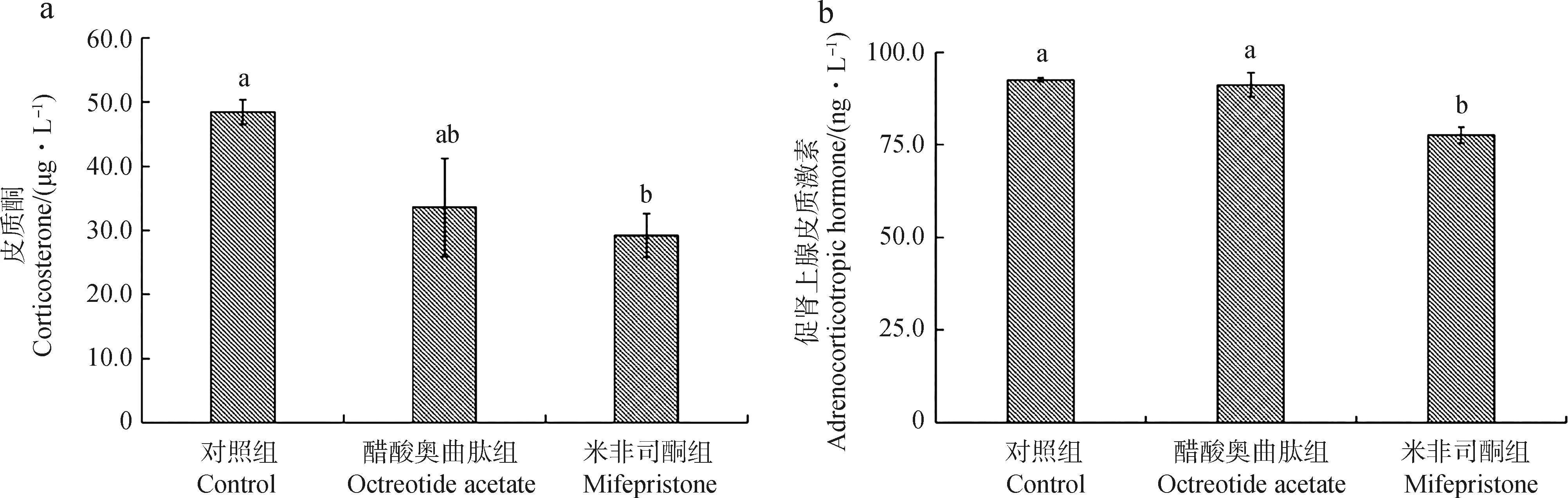
图4 给药7 d后各组高原鼢鼠的皮质酮(a)和促肾上腺皮质激素(b)Fig.4 Comparison of corticosterone (a) and adrenocorticotropic hormone (b) in different groups of Eospalax baileyi after 7 days of treatment
2.5 死亡率
给药7 d后,对照组的死亡率与醋酸奥曲肽组一致,14 d后,对照组的死亡率保持较高水平增长,醋酸奥曲肽组死亡率放缓。而米非司酮组的死亡率一直最低(表1)。
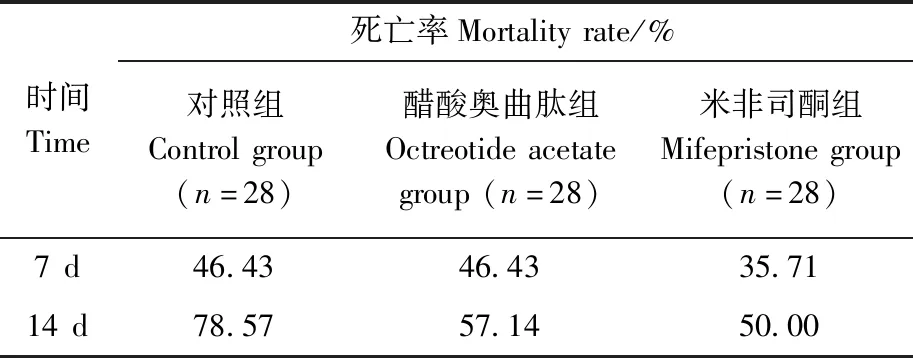
表1 给药7 d后及14 d后各组高原鼢鼠的死亡率Table 1 Mortality rate of Eospalax baileyi after 7 days and 14 days of treatment
3 讨论
应激反应是以下丘脑HPA为主的神经内分泌反应,当动物受到外界环境变化的刺激时,下丘脑的饱食和饥饿中枢会受到影响,摄食行为受到应激反应的抑制或者肠胃功能出现异常,继而会导致摄食量减少、体质量负增长等,因而动物采食量、体质量增减程度对应激的评判具有重要的价值(Scalera &Tarozzi,2001;张月萍,王建军,2001)。张善超(2010)的研究结果表明,生存环境的剧变会使野生动物暴露在应激压力下,这时机体为了适应环境变化,体内的肾上腺皮质激素会过量分泌,加速新陈代谢水平,机体大量分解蛋白质、脂肪等,以产生足够对抗应激的能量。本实验结果与上述研究一致,这说明2种抗应激药物在一定程度上缓解了应激对高原鼢鼠生长性能带来的影响。
本实验心率测试结果显示,给药前后各组心率之间的差异均无统计学意义,表明药物还不能影响高原鼢鼠的心率。旷场行为实验结果显示,给药7 d后,药物组的中央格停留时间延长,水平运动量下降,这与陈光耀等(2016)和史海霞(2019)的研究结果不同。环境改变导致应激是一种慢性的应激刺激,更多的是心理方面造成的创伤。长时间处于应激压力下,绝大程度会导致机体产生抑郁等不良反应,处于应激状态下的动物在旷场实验中会出现中央格停留时间延长、水平运动量下降等(张强等,2009;宋川,熊正英,2013)。本研究中,随着应激时间的延长,对照组的中央格停留时间缩短、水平运动量上升,可能是因为不同于常规的实验动物(大鼠Rattusnorvegicus或小鼠Musmusculus),高原鼢鼠是一种野生鼠,并且长期营地下生活,生存环境变化与人为扰动更易使其产生焦虑样行为,这与高博(2015)的研究结果一致。药物组的攀爬频次显著小于对照组,这与刘文俊等(2017)的研究结果相似。修饰行为是动物处于放松状态的一种行为表现,在动物应激实验中也是作为测定应激水平的一种重要参考(王振龙,刘季科,2002)。本研究发现,药物组的修饰频次显著多于对照组,这与吴红芳等(2018)的研究结果一致。值得注意的是,由于高原鼢鼠的活动特征不同于地上鼠类,常年的地下生活使高原鼢鼠视力退化(戴月琴,2007),如测试以明暗箱为例,由于高原鼢鼠趋暗的特性,会使其趋向于停留在暗箱内,但本研究参考了行为实验中的饥饿刺激法避免了该现象的发生。
动物受到外界有害因子刺激时,应激源刺激信息会通过下丘脑合成促肾上腺皮质激素释放激素(CRH),CRH是HPA激活的关键,也能增强HPA的活动。CRH主要作用于垂体前叶的促肾上腺皮质激素细胞并促进机体分泌ACTH(Monclúsetal.,2009),ACTH能够激活肾上腺皮质细胞合成并释放糖皮质激素(GC),GC对HPA有负反馈调节机制,高水平的GC与糖皮质激素受体(GR)结合,通过一定的途径抑制HPA的过度反应,从而调节机体能量分配和保持内环境稳态,对机体适应有害因子刺激起重要作用(Tsigos &Chrousos,2002),而血液应激激素的变化对应激领域的研究具有重要意义(Maier &Watkins,1998)。本研究中,给药7 d后,2种药物组血清的ACTH含量均低于对照组,而对照组高水平ACTH表达无法自身缓解,免疫力以及对环境的适应能力减弱,采食量显著减少并出现大量死亡,而2种药物能有效缓解上述不良反应,这与Karalis等(1997)的研究结果一致。适量的GC能够有效提高机体的适应能力,但GC分泌过高时,过量的GC会使得HPA的负反馈调节机制失衡,对机体免疫系统造成极大的损害,如生长发育迟缓、生产力下降等(姜龙,2015)。本研究发现,给药7 d后,米非司酮组血清中的CORT含量显著低于对照组,体质量降幅水平明显低于对照组,7 d 和14 d的死亡率最低。这也说明,由于过度应激导致CORT含量的变化会显著影响到高原鼢鼠的生长发育和生理状态,外在行为表现也会发生相应改变,这与兰玲(2005)的研究结果一致。
综上所述,醋酸奥曲肽、米非司酮在本次实验中均有效地缓解了高原鼢鼠的应激行为,提高了其采食量,但结合7 d和14 d的死亡率、应激激素含量,米非司酮能更有效缓解高原鼢鼠的应激状况,对提高其成活率有重要作用。

