sprouty4蛋白对角质形成细胞增殖及分化的影响
黄钰淇, 李里, 钟维, 朱磊, 林静霞, 张娇, 陈永锋1,
(1.广东医科大学,广东 湛江 524023;2.南方医科大学皮肤病医院,广东 广州 510091)
sprouty蛋白是Hacohen等在1998年果蝇基因谱的研究中发现的一种蛋白,随后在哺乳动物中发现类似物,分别命名为sprouty1、sprouty2、sprouty3、sprouty4。sprouty4蛋白(sprouty4 protein, SPRY4)是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路的负性调节蛋白, 该蛋白的存在使这条信号通路被阻断,从而起到抑制细胞过度增殖、迁移,调节细胞分化的作用[1]。皮肤是人体的天然免疫屏障,角质形成细胞(keratinocytes,KC)是其中的重要成分。KC是一种不断增殖、分化和更新的细胞,其增殖和分化过程受到多种因素影响。目前国内外未见有关SPRY4对KC功能影响的报道。本研究探讨SPRY4蛋白对HaCaT细胞的增殖及分化的影响,以为SPRY4调节KC研究提供前期基础。
1 材料与方法
1.1 标本来源
人永生化表皮细胞株HaCaT细胞(BNCC100433)购自北纳创联生物科技有限公司。
1.2 主要试剂和仪器
上、下游引物(上海生工);异丙醇(广州化学试剂厂);氯仿(广州化学试剂厂);DEPC水(上海生工);无水乙醇(广州化学试剂厂);Trizol试剂(Invitrogen公司);SYBRPrimer Ex TaqTMⅡ(TaKara公司);PrimerScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time,TaKara公司);CCK-8试剂盒(同仁化学);FECTTM CP Transfection(锐博生物);RNA oligo(上海生工)。Bio-rad PCR仪(美国Bio-rad公司);NanoDrop 分光光度计(Thermo Fisher Scientific公司)。
1.3 方法
1.3.1 SPRY4基因敲降 实验组采用合成即用型化学合成双链小分子RNA(short interfering RNA,siRNA)对HaCaT细胞中的SPRY4基因进行敲降。将HaCaT细胞用血球计数板计数后按4×105个/孔铺于6孔板,置于培养箱过夜使细胞生长密度达到50%以上;按说明书将Lipofectamine2000制备成转染复合物混合液,按比例混合无血清的DMEM后加入培养基中;置于37 ℃ CO2培养箱培养。对照组HaCaT细胞不加任何处理。
1.3.2 RT-qPCR验证SPRY4蛋白敲降 于敲降后48 h后RT-qPCR法检测细胞中SPRY4 mRNA的表达,RT-qPCR操作按照试剂盒说明书进行。计算两组细胞中SPRY4 mRNA的相对表达量,同时通过公式计算出各组间SPRY4表达的敲降率,敲降率=1-实验组mRNA平均表达量/对照组mRNA平均表达量×100%。选择敲降效果最佳的一组,按照基本相同的实验条件进行正式实验。
1.3.3 RT-qPCR检测两组分化标志物Involucrin、CK1、CK10 mRNA水平 重复上述操作对HaCaT细胞中的SPRY4进行敲降,验证敲降成功后,行RT-qPCR检测siRNA转染HaCaT细胞48 h后Involucrin、CK1、CK10 mRNA水平。PCR反应采用20 μL反应体系,在无RNA酶八联管中分别加入10 μL SYBR Prime Ex TaqTM、1 μL cDNA、7 μL DEPC水、前后引物各1 μL(表1),实验条件为:预变性:95 ℃ 30 s;95 ℃ 5 s,58 ℃ 30 s, 72 ℃ 30 s,共45个循环。比较两组各分化标志物的表达差异。
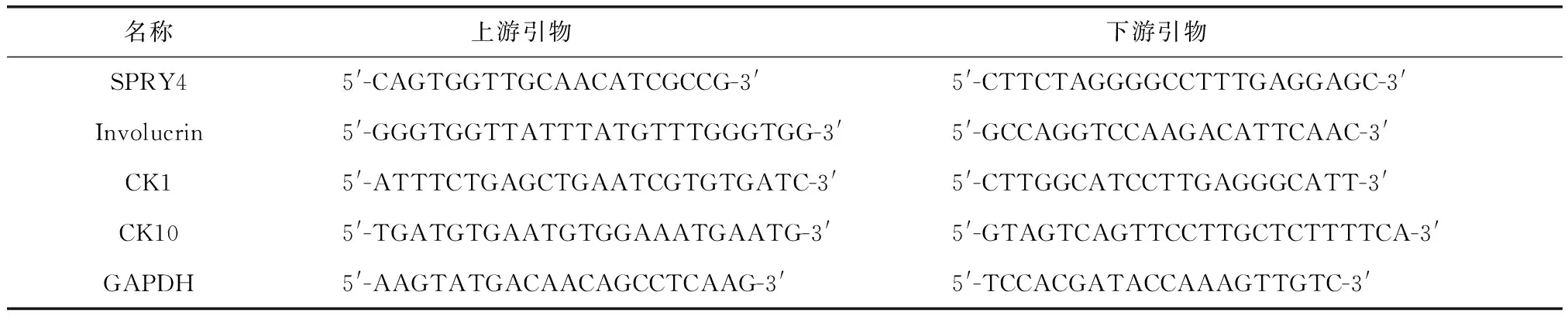
表1 各组引物序列Tab.1 Primer sequence
1.3.4 CCK-8计数法检测HaCaT细胞增殖 细胞消化重悬后计数,以5 000个/孔铺96孔板,每孔约100 μL细胞悬液;将培养板置于37 ℃ CO2培养箱过夜;按照实验设计要求转染siRNA后置于培养箱48 h;分别于0、24、48、72 h每孔加入约10 μL CCK-8试剂,严格避光置于培养箱孵育4 h;使用酶标仪单波长测定OD值(检测波长480 nm)。比较实验组及对照组HaCaT细胞中SPRY4蛋白被干扰后对细胞增殖的影响。
1.3.5 统计学处理 记录各个样本的循环阈值(cycle threshold valve, Ct),三个副孔间取平均值,ΔCt实验组=Ctsi-SPRY4-CtGAPDH,ΔCt对照组=Ct空白对照NC-CtGAPDH,ΔΔCt=ΔCt实验组-ΔCt对照组。最后的数据统计分析用2-ΔΔCt值,表示实验组与对照组两组间的相对倍数关系即表达量。实验组与对照组各指标mRNA水平相对表达量比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 SPRY4蛋白对HaCaT细胞分化的影响
RT-qPCR法证实,与空白对照组相比,实验组的HaCaT细胞SPRY4 mRNA表达降低,敲降率为94.75%,表明实验组SPRY4基因敲降成功。进一步检测分化标志物Involucrin、CK1、CK10 mRNA水平,结果显示,siRNA转染HaCaT细胞48 h后,与对照组相比,实验组HaCaT细胞Involucrin、CK1、CK10 mRNA表达量降低(图1),其中实验组与对照组SPRY4 mRNA水平比较,t=119.3,P<0.000 1; Involucrin mRNA水平比较,t=32.96,P=0.000 9;CK1比较,t=30.32,P=0.001 1;CK10比较,t=119.3,P<0.000 1;提示随着SPRY4的表达降低,HaCaT细胞分化能力减弱。

图1 siRNA转染HaCaT细胞48 h后Involucrin、CK1、CK10 mRNA表达Fig.1 mRNA expression of Involucrin, CK1 and CK10 after transfection of siRNA into HaCaT cells for 48 h.
2.2 SPRY4蛋白对HaCaT细胞增殖的影响
CCK-8法检测结果显示,与空白对照组相比,干扰48 h实验组与对照组OD值差异最大,说明实验组由于SPRY4被敲降导致细胞数目不断增多,且增殖速率超过细胞正常生长速率,提示SPRY4的表达降低能够促进角质形成细胞的增殖(图2)。

图2 CCK-8实验检测实验组和对照组细胞增殖的变化Fig.2 The changes in cell proliferation in the experimental group and the controls.
3 讨论
银屑病是由细胞免疫系统激活,多因素多通路作用引起的以角质形成细胞异常增殖为特点的慢性皮肤病。银屑病和角质形成细胞之间的关系密切,虽然近年来有大量的实验和临床研究,但影响角质形成细胞增殖的因素及其与银屑病发病机制的关系仍不明确。SPRY4蛋白是MAPK信号通路的负性调节蛋白,MAPK是一种丝氨酸苏氨酸蛋白激酶[2],研究表明,银屑病患者皮损处MAPK活性明显升高,MAPK信号转导通路在银屑病的发病中起重要作用[3]。被激活的MAPK磷酸化,通过与血管内皮生长因子作用促进血管形成,在表皮中促进细胞生长、增殖、调节免疫应答而参与银屑病的发病过程。
SPRY蛋白作为肿瘤的负性调节蛋白可以在细胞水平上通过调节MAPK/ERK和其他途径来调控增殖、分化、运动和存活。在功能缺失和表达减少时,细胞增殖异常导致肿瘤的发生[4]。有文献报道SPRY4蛋白在乳腺癌衍生细胞系[5]、胶质母细胞瘤[6]、肝门周围胆管癌[7]等肿瘤中可以干扰细胞的增殖和迁移,并且成为评估预后的因素和潜在的治疗靶标。SPRY4蛋白在角质形成细胞与银屑病发病机制中可能存在重要作用,但仍需进一步证实。
本研究显示,采用siRNA基因敲降技术抑制HaCaT细胞中SPRY4的表达能够促进HaCaT细胞增殖,由此证明SPRY4对KC增殖功能具有一定的影响。Involucrin是交联包膜的蛋白前体,它可作为表皮角质细胞早期分化的标记;CK是表皮KC的主要结构蛋白和分化的早期标志物,随着基底细胞分化,CK的表达可转变为CK1及CK10[8]。因此,采用相同实验参数对HaCaT细胞分化指标Involucrin、CK1与CK10进行验证,发现SPRY4表达降低的情况下,HaCaT细胞分化功能被同向抑制。
综上所述,本实验在细胞层面初步证实了SPRY4蛋白与角质形成细胞之间存在相关性,为后续开展银屑病的通路和治疗靶点研究提供了前期实验基础和研究思路。未来需进一步研究SPRY4蛋白是否通过MAPK通路在角质形成细胞中对银屑病发挥调控作用,并开展动物实验研究SPRY4蛋白在咪喹莫特诱导的小鼠银屑病模型中对KC的增殖、分化的影响,为银屑病的治疗靶点提供新思路。

