南瓜黄色素提取工艺的响应面法优化及其在碳酸饮料中的应用
谢 婧,陈贤铮,卢建国
(广东科贸职业学院,广东 广州 510430)
南瓜是一种蔓性草本植物,在我国种植广泛,是一种营养价值高低脂功能性食品[1],其中南瓜黄色素就是从南瓜提取的一种脂溶性色素,富含类萝卜素、叶黄素和玉米黄素等多种黄色色素成分[2],可作为天然色素的来源。随着人们对天然配料(All-natural)和清洁标签(Clean label)的日益需求,目前市场天然色素逐步得到人们的青睐,天然色素取代合成色素已成为必然。但是由于天然色素色泽不稳定,在其使用过程中容易受各种因素(如光照、温度、氧化、pH、介质极性、金属离子、添加剂等)的影响[3]。同时由于大多数食品体系都以水作为基质,因此水溶性的功能因子可以直接以溶液的形式添加于食品中并在食用过程中被人体吸收[4],因而也具有较好的生物利用率。
南瓜黄色素是脂溶性功能因子,在功能食品中的应用由于其溶解性和稳定性而受到限制,功能因子在食品中的传递是生产功能食品的关键。本研究采用少加工的溶剂浸提法,利用食品级乙醇提取南瓜黄色素,以浸提时间、pH、温度和料液比为单因素进行梯度试验[5],通过响应面试验得到提取率较高的南瓜黄色素提取工艺参数[6-7],再利用多重乳液[8-9]作为的传递系统制备碳酸饮料,为南瓜黄色素在食品中应用提供了一套较为可行的方案。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
南瓜:购于江南水果批发市场(广州市白云区);白砂糖:北京中糖世纪食品有限公司产品;柠檬酸:食品级,广州广柠贸易有限公司产品;无水乙醇(99.5%):食品级,上海森旭化工科技有限公司产品;单宁酸:诺维信(中国)生物技术有限公司产品;聚甘油蓖麻醇酯(PGPR):凯瑞生化科技产品;丙三醇(甘油):食品级,郑州裕和食品添加剂有限公司产品;葵花籽油:购于广州华润万家超市(上海佳格食品有限公司生产)。
1.1.2 仪器与设备
DHG-9123A 型台式鼓风干燥机箱,722S 可见分光光度计,HH-4 型恒温水浴锅,ZFQ85A 旋转蒸发仪,AL204 型电子天平,BX51 光学显微镜。
1.2 方法
1.2.1 南瓜黄色素提取工艺流程
新鲜南瓜→去皮→护色→干燥→粉碎→南瓜粉→浸提→过滤→浓缩→干燥→南瓜黄色素产品[10]
1.2.2 南瓜黄色素提取操作要点
将新鲜南瓜洗净去皮切分成2 cm×2 cm 小方块,热烫2 min 护色,放入鼓风干燥机箱60 ℃烘干24 h,干燥完成后粉碎备用。称取备好的南瓜粉5 g,加入一定量乙醇浸提取[11],提取结束后抽滤,即得南瓜黄色素原液。
1.2.3 南瓜黄色素最大吸收波长的确定
将南瓜黄色素乙醇提取液适当稀释,以无水乙醇作空白,用可见分光光度计在400~500 nm 处进行光谱扫描[12-13],确定其最大吸收波长,并以其为最佳吸收波长。
1.2.4 单因素试验设计
1.2.4.1 最佳浸提剂浓度的筛选
称取6 份预处理的南瓜粉,每份5.00 g,分别用50%、60%、70%、80%、90%、99.5%(无水乙醇)的乙醇提取[14],提取时间100 min,提取温度60 ℃,料液比1∶10(g/mL),pH 为 5,得到滤液稀释到相同体积后,在最佳吸收波长下测其吸光度。
1.2.4.2 料液比对南瓜黄色素提取的影响
称取7 份预处理的南瓜粉,每份5.00 g,用无水乙醇浸提剂以不同料液比(1∶5、1∶6、1∶7、1∶8、1∶9、1∶10、1∶11(g/mL)) 加入样品中[15],提取时间 100 min,提取温度60 ℃,pH 为5,得到滤液后稀释到相同体积(100 mL),在最佳吸收波长下测其吸光度,得其最大吸光度,并以其料液比为最佳料液比。
1.2.4.3 pH 对南瓜黄色素提取的影响
称取8 份预处理的南瓜粉,每份5.00 g,以调节到不同 pH(4、5、6、7、8、9、10、11)的无水乙醇为浸提试剂[16],提取时间 100 min,提取温度 60 ℃,料液比1∶10(g/mL),得到提取液稀释到相同体积后,在最佳吸收波长下测其吸光度。
1.2.4.4 浸提温度对南瓜黄色素提取的影响
称取5 份预处理的南瓜粉,每份5.00 g,用无水乙醇浸提剂,以料液比 1∶10(g/mL),在不同温度下(40、50、60、70、80 ℃)进行提取[17-18],pH 为 5,得到浸提液稀释到相同体积后,在最佳吸收波长下测其吸光度。
1.2.4.5 浸提时间对南瓜黄色素提取的影响
称取7 份预处理的南瓜粉,每份5.00 g,以料液比 1∶10(g/mL)加入无水乙醇,在 60 ℃下恒温浸提不同时间(20、40、60、80、100、120、140 min)[19-21],pH 为5,得到浸提液稀释到相同体积后,在最佳波长下测其吸光度。
1.2.5 响应面优化提取工艺
根据单因素结果,采用Box-Behnken 中心组合试验方案进行三因素三水平试验[22-24],进行响应面分析结合实际确定最佳提取条件。提取温度、pH、料液比 3 个因素为自变量,分别以A、B、C表示,以-1、0、1代表各自变量的低、中、高水平,设计方案见表1。

表1 因素水平编码表Table1 Factors and levels in central composite design
1.2.6 南瓜黄色素多重乳液的制备
将1 mg/mL 单宁酸、甘油为60%、蒸馏水组成内水相,分散至完全溶解,得到内部水相W1。将南瓜黄色素原液按油相的1%(质量分数)、亲油性乳化剂聚蓖麻油酸甘油酯(PGPR)按8%溶于葵花籽油乳化[25],得油相O,按内部水相W1与油相O 的质量比为4∶6,将内部水相完全分散于油相中,调节剪切乳化强度8 000 r/min[26],乳化时间 6 min,每 2 min 间隔,制得W1/O 型乳状液作为第一相;最后将W1/O 型乳状液(第一相)与外部水相质量比为 3∶7,将 W1/O 滴加至含有5%的亲水性乳化剂Tween 80 外水相中[27],乳化强度2 000 r/min,乳化时间1 min,搅拌制得南瓜黄色素W1/O/W 多重乳液[28-29]。
1.2.7 南瓜黄色素碳酸饮料的工艺
白砂糖14%(质量分数),柠檬酸0.15%(质量分数),南瓜提取黄色素(按碳酸饮料添加限量),山梨酸钾0.03%(质量分数),碳酸水1 000 g 定容。
1.2.8 数据处理
采用Minitab 17 软件对数据进行响应面设计和处理,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果与分析
2.1 南瓜黄色素提取最佳吸收波长的确定
由图1 可知,南瓜黄色素在400~500 nm 的波长范围内出现最大吸收峰,440 nm 波长下吸光度最大。因此,选定440 nm 作为测定吸光度的最佳波长。
2.2 单因素试验结果
2.2.1 乙醇浓度的选择
由图2 可知,随着乙醇浓度的增大,提取效果递增,乙醇浓度最高时,溶液极性变小,提取效果也最好。因此,确定浓度99.5%为最佳浓度,即以无水乙醇为浸提剂。
2.2.2 料液比对南瓜黄色素提取效果的影响
由图3 可知,南瓜提取黄色素与乙醇浸提液比例分别为 1∶5、1∶6、1∶7、1∶8、1∶9、1∶10、1∶11(g/mL)的情况下,提取效果各不相同,随着提取溶剂添加量的增大,吸光度逐步上升后趋于平缓,在料液比1∶6(g/mL)时黄色素提取效果最佳,可进一步优化。乙醇浸提液添加量过低时可能南瓜黄色素不能与提取剂分完全溶出,随着提取剂用量的增大,由于南瓜细胞破碎程度减小,提取效果反而略微降低趋于平缓,提取效果反而降低,而且生产成本过高。因此,选择适宜的料液比为 1∶6(g/mL)。
2.2.3 不同pH 的乙醇浸提液对南瓜黄色素提取效果的影响
由图4 可知,调节乙醇浸提液pH 对南瓜黄色素提取的有一定影响,在酸性条件下吸光度较高,碱性条件下吸光度较低但比较稳定,在pH 为5 时提取率较高。
2.2.4 浸提温度对南瓜黄色素提取效果的影响
由图5 可知,在浸提温度40~60 ℃范围内,提取液吸光度随着温度的增加而升高,但在浸提温度60~80 ℃却呈现负相关,在60 ℃下南瓜黄色素的提取效果达到最佳状态,这能避免提取温度过高而引起的资源浪费,在试验过程中可进一步优化。
2.2.5 浸提时间对南瓜黄色素提取效果的影响
由图6 可知,提取时间对南瓜黄色素提取效果的影响呈正相关,但到达100 min 后趋于平稳,考虑到生产中的能耗和效率,因此最佳提取时间选择为100 min即可。
2.3 响应面优化南瓜黄色素的提取工艺
2.3.1 中心组合试验设计与结果
按照Box-Behnken 试验方案进行三因素三水平试验,结果见表2。将所得的试验数据采用Minitab 17软件进行多元回归拟合,得到以吸光度为目标函数的二次多项回归方差:南瓜黄色素提取物吸光度对色素A浸提温度、B浸提液pH、C料液比的二次多项回归方程:吸光度(A)=-10.41+0.303 3A+0.358B+0.348C-0.002 396A2+0.067 4B2-0.093 6C2-0.010 83AB+0.012 73AC-0.043 7BC。

表2 Box-Behnken 试验设计与结果Table 2 Box-Behnken test design and results
由表3 回归模型方差的分析结果可知,模型的F值=10.98,P<0.01,表明模型极显著,并且失拟项不显著(P>0.05),说明该回归方程对数据进行了较好拟合,可以用该模型分析和预测南瓜提取黄色素的结果,模型回归方程系数的显著性分析表明,A2极显著(P<0.01),A、C、C2、AB、AC显著(P<0.05),各因素对提取南瓜黄色素影响的主次顺序为:C>A>B,即料液比的影响最大,提取温度次之,浸提液pH 的影响最小。
2.3.2 各因素之间交互作用曲面图及分析
响应曲面坡变化和等高线能反映因素的交互作用,将建立的回归模型的任一因素固定在零水平,探讨另外两因素的交互影响,得到二次回归方程的响应面图及其等高线图,如图7~9 所示。
等高线图表示同一椭圆形区域内,南瓜黄色素的提取量是相同的,椭圆形区域中心的提取量最大,并逐渐向边缘减少,如果响应面陡峭表示因素条件变化时,响应值极其敏感;反之,因素对响应值不敏感。等高线图为椭圆形表示交互作用明显,反之不明显可以忽略。
由图7 可知,处理提取温度在60~70 ℃范围内,浸提液pH 在4~5 范围内时,两者存在显著的作用,南瓜黄色素提取量随着两个因素的增加而增加;而提取温度在 70~80 ℃范围内,浸提液 pH 在 5~6 范围内时,南瓜黄色素提取量随着两个因素的增加而减少。由图8 可知,提取温度在60~80 ℃范围内,料液比在1∶5~1∶7(g/mL)范围内时,两者存在显著性的增效,南瓜黄色素提取物随着提取温度和料液比的降低而增加。为了确定最佳点的值,对模型进行分析,以得到最高南瓜黄色素的最佳提取工艺参数,经分析得出最佳提取条件为:提取温度63.03 ℃,提取液pH 6.0,料液比 1∶5.0(g/mL)。
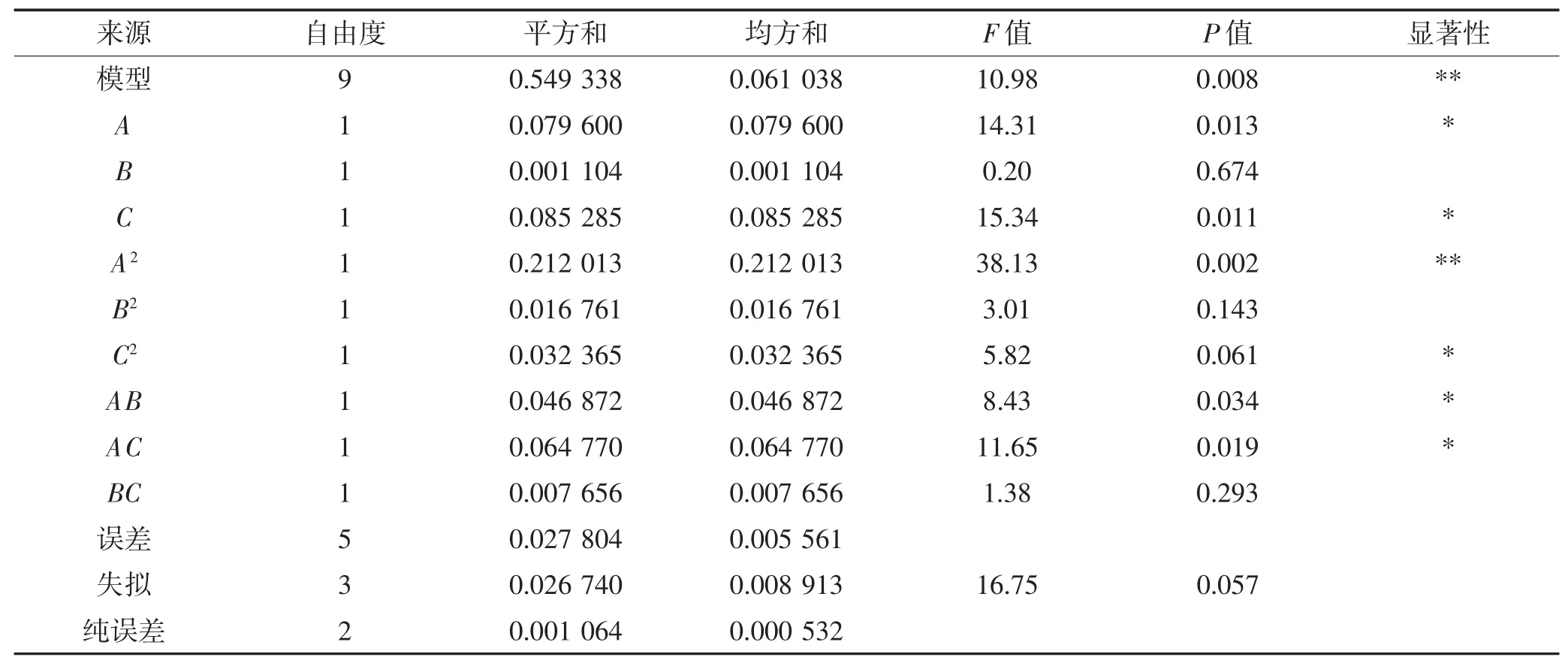
表3 回归模型方差分析Table 3 Variance analysis of regression equation
2.4 验证试验
为检验试验的可靠性,采用上述最优提取参数进行南瓜黄色素的提取,同时考虑到提取试验的可控性和可行性,对最佳工艺参数进行修正:采用提取溶剂浓度99.5%(即无水乙醇),提取温度63 ℃,提取液pH 6,料液比 1∶5(g/mL),提取时间 100 min,按照该工艺提取的南瓜黄色素吸光度值为1.720 1,与吸光度预测值1.769 8 比较可知,响应面法所得的优化工艺参数准确可靠,具有实用价值。
2.5 南瓜提取黄色素在碳酸饮料中的应用
将南瓜提取黄色素按“1.2.6”中的方法制备成南瓜黄色素多重乳液,由图10 可见,南瓜黄色素多重乳液黄色柔和美观,在100 倍光学显微镜下观察乳液质构,油相包裹均匀,乳液形状较为稳定。
将南瓜提取黄色素多重乳液应用于碳酸饮料中,按“1.2.7”工艺制作碳酸饮料样品,置于37 ℃恒温培养箱内储存20 d,每隔5 d 取出用分光光度计测吸光值,结果如表4 所示。

表4 南瓜黄色素碳酸饮料在37 ℃储存的吸光度变化Table 4 The change of absorbance of pumpkin yellow carbonate beverages stored at 37 ℃
由表4 可见,储存1 d 时,南瓜黄色素碳酸饮料的吸光度为1.123,20 d 测饮料吸光度为1.024,在恒温时间内碳酸饮料吸光度并无明显降低,外观也无明显变化,可为天然色素在碳酸饮料中的稳定性的应用提供一定的理论基础。
3 结 论
上述试验结果表明:采用乙醇浸提法提取南瓜黄色素的最佳吸收波长为440 nm;采用Box-Behnken中心组合试验方案进行三因素三水平试验,进行响应面分析结合实际确定最佳提取参数为:提取溶剂浓度99.5%(即无水乙醇),提取温度 63 ℃,提取液 pH 为6,料液比 1∶5(g/mL),提取时间 100 min;将南瓜中提取的黄色素制备南瓜黄色素多重乳液,再将其应用于碳酸饮料中,稳定性好。因此,利用响应面法分析南瓜黄色素的提取工艺,科学合理,而且方法简单高效,为今后进一步研究打下了坚实基础,也为南瓜黄色素在食品中应用及工业化生产提供了理论基础。

