男性基础性激素水平与精子质量参数的相关性探讨
吴剑锋(佛山市南海区妇幼保健院检验科,广东佛山 528200)
随着环境和生活方式及习惯等因素变化的影响,全球不孕不育症患者逐年上升,我国不育症的发病率约占育龄夫妇15%,其中约50%由于男性不育所致[1]。少精子症、无精子症和弱精子症是造成男性不育的主要原因[2]。精子的生成主要受下丘脑-垂体-睾丸内分泌轴的调节,参与其中的性激素出现一种或几种的失衡异常都将影响精子的生成和成熟,导致生精功能障碍。近年来,性激素的检测在男性生殖健康方面的应用越来越广泛,但关于其与精子质量的相关性研究并不多见且结论不一。本文通过对350 例男性基础性激素和精液常规的测定,分析比较性激素水平与精子质量主要参数的相关性,对男性不育发病机制进行探讨,为临床诊断和治疗提供参考依据。
1 材料与方法
1.1 研究对象 随机选取于2018年6月~2019年6月于南海妇幼保健院生殖健康科就诊的男性350 例为研究对象(经检查无染色体异常、无生殖系统器质性病变、无患有影响生育的疾病,肝肾心功能正常),年龄20 ~35 岁,平均年龄29.7±6.1 岁,均禁欲3 ~7日,进行过3 次以上的精液常规检查。根据《WHO 人类精液检查与处理实验室手册(第5版)》[3]的相关标准把研究对象分为四组,精子正常组(n=100):各参数均高于参考值下限;少精子组(n=103):精子密度<15×109/L,其他参数正常;弱精子组(n=121):精子总活力<40%或前向运动精子率<32%,其他参数正常;无精子组(n=26):把精液标本以3 000g/min 离心15min 后镜检未发现精子,梗阻性无精子症在病理类型属于生精功能正常型,不作为本次研究对象。各组一般资料比较差异均无统计学意义(P>0.05),具有可比性。
1.2 仪器与试剂 精液常规分析使用美国HAMILTON THORNE 公司的IVOS Ⅱ全自动精子质量分析仪,性激素的检测使用美国BECKMAN公司的DXI800 全自动磁性微粒子化学发光免疫分析仪,采用原装校准品、质控品和试剂。检测系统均经性能评价符合要求,检测期间室内质控均在控。
1.3 方法
1.3.1 精液常规分析:参与研究的男性均禁欲3~7天,以手淫的方法获取精液后存放于无菌干燥的容器内,10min 内送检并置于37℃水浴箱内待液化检测。严格按照《WHO 人类精液检查与处理实验室手册(第5 版)》[3]要求,使用精子质量分析仪进行精子密度、精子活率、精子总活力、正常形态精子率的检测。通过对精子进行Diff-Quik 快速染色后进行形态学检验。每位研究对象均进行不少于3次的精液分析,每次均禁欲并间隔1 周。
1.3.2 性激素检测:每位研究对象均空腹,于上午8 点~10 点抽取静脉血5ml,离心分离血清后立刻进行睾酮(T)、雌二醇(E2)、催乳素(PRL)、卵泡刺激素(FSH)和黄体生成素(LH)的检测。操作严格按照试剂盒说明书进行。
1.4 统计学分析 用SPSS20.0 统计软件对数据进行分析。所有计量资料以均数±标准差(+s)表示,两样本均数比较采用t检验,用Pearson 对性激素水平与精子质量参数进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各实验组与对照组的性激素水平比较 见表1。与对照组比较,少精子组的FSH,LH 和PRL 水平升高,而T 和E2 水平降低,差异均有统计学意义(均P<0.05);弱精子组的LH 和PRL 水平升高,E2 水平降低,差异均有统计学意义(均P<0.05),FSH和T 水平差异均无统计学意义(P>0.05);无精子组的FSH,LH 和PRL 水平明显升高,E2 和T 水平明显降低,差异均有统计学意义(均P<0.01)。
表1 各实验组与对照组的性激素水平比较(+s)
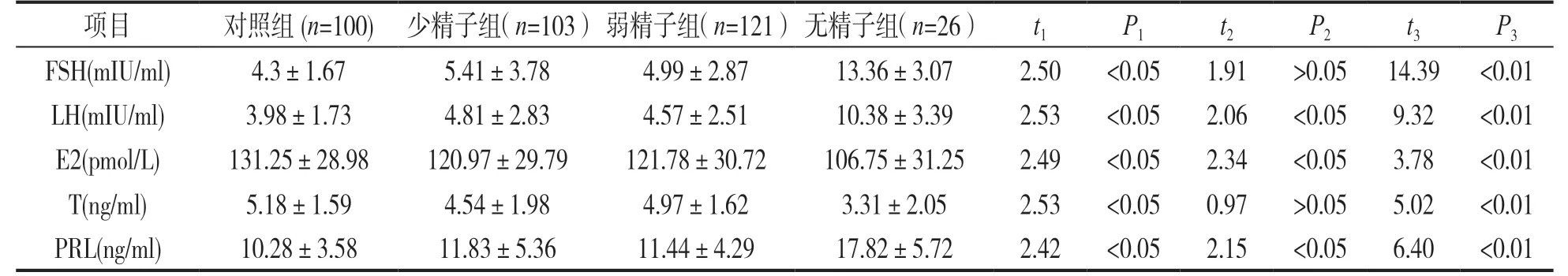
表1 各实验组与对照组的性激素水平比较(+s)
注:t1,P1 为少精子组与对照组比较;t2,P2 为弱精子组与对照组比较;t3,P3 为无精子组与对照组比较。
项目 对照组(n=100) 少精子组(n=103)弱精子组(n=121)无精子组(n=26) t1 P1 t2 P2 t3 P3 FSH(mIU/ml) 4.3±1.67 5.41±3.78 4.99±2.87 13.36±3.07 2.50 <0.05 1.91 >0.05 14.39 <0.01 LH(mIU/ml) 3.98±1.73 4.81±2.83 4.57±2.51 10.38±3.39 2.53 <0.05 2.06 <0.05 9.32 <0.01 E2(pmol/L) 131.25±28.98 120.97±29.79 121.78±30.72 106.75±31.25 2.49 <0.05 2.34 <0.05 3.78 <0.01 T(ng/ml) 5.18±1.59 4.54±1.98 4.97±1.62 3.31±2.05 2.53 <0.05 0.97 >0.05 5.02 <0.01 PRL(ng/ml) 10.28±3.58 11.83±5.36 11.44±4.29 17.82±5.72 2.42 <0.05 2.15 <0.05 6.40 <0.01
2.2 性激素水平与精子质量参数的相关性分析 见表2。Pearson 相关分析结果显示,FSH 与精子密度、精子活率和精子总活力均呈负相关(r=- 0.24,- 0.19,- 0.34,均P<0.05)。LH 与精子密度、精子活率和精子总活力均呈负相关(r=- 0.20,- 0.21,- 0.28,均P<0.05)。E2 与精子密度、精子总活力呈正相关(r=0.19,0.14,均P<0.05)。T与精子密度和正常形态精子率呈正相关(r= 0.15,0.14,均P<0.05)。PRL 与各参数无相关性(均P>0.05)。

表2 性激素水平与精子质量参数的相关性分析
3 讨论
精子的生成是一个复杂的过程,要经历数次增生、分化以及形态的转变,这一过程在睾丸内部进行,其主要依赖下丘脑-垂体-睾丸内分泌轴的调节,任何因素引起的生殖激素改变都会影响男性的生育能力[4]。在正常生理情况下,下丘脑合成促性腺激素释放激素(GnRH)作用在垂体前叶,促进垂体合成释放FSH 和LH,FSH 可促进睾丸中曲细精管的成熟,诱导次级精母细胞发育为精子细胞,而LH 作用于睾丸间质细胞,使其增生从而促进T 的合成。T是促进男性生殖器官发育和维持男性性功能的激素,可通过不同的效应途径影响精子的生成和成熟[5]。男性的E2 主要来源于肾上腺皮质合成和T 在周围组织中经芳香化酶转化而成。有研究表明[6],E2 通过与生精小管中的受体结合,促进生精细胞的成熟,对精子生成发挥重要的作用。PRL 由垂体前叶分泌,能增强LH促进合成T的能力,进而刺激精子的生成,同时PRL 还可以通过雄激素受体影响雄激素的活性,引起性腺功能的改变[7]。因此,基础性激素的检测能对下丘脑、垂体、睾丸功能做出评估并为睾丸功能衰竭的原因提供依据[8]。
实验组和对照组的性激素水平比较中,少精子组的FSH 和LH 高于对照组(P<0.05),T 低于对照组(P<0.05);无精子组的FSH 和LH 显著高于对照组(P<0.01),T 显著低于对照组(P<0.01),可能原因在于当生殖系统的各种变化累及睾丸间质细胞时,T的合成和分泌就会减少,抑制素分泌随之减少,对内分泌轴的抑制作用减弱,垂体分泌FSH,LH就会增加。此外,睾丸支持细胞-曲细精管嵌合体和生精上皮细胞的受损,也会引起垂体分泌FSH的增加。本次研究表明,T 合成和分泌会随着睾丸生精功能的受损严重程度而减少,FSH 和LH 则随之增加。E2 在三个实验组中都有不同程度的减少,差异均有统计学意义,原因为支持细胞和间质细胞的受损减少了E2 的合成,另一方面T 的减少也使E2 的转化减少。适量的PRL 能保证性腺轴的功能并促进T 的分泌,但PRL 过高可抑制间质细胞影响T 的合成,又可引起T 受体减少从而降低T 的活性,影响精子的生成,与本文结果一致。
本次研究发现FSH 和LH 与精子密度、精子活率和精子总活力呈负相关(均P<0.05),说明FSH和LH 的水平与精子质量密切相关,两者的异常升高将会影响生殖细胞的生长发育和凋亡的平衡,直接表现就是精液检查时精子数量的减少、活率和活力的下降,同时监测FSH 和LH 的水平还有助于评估垂体激素和精子质量的关系[9]。E2 与精子密度和精子总活力呈正相关(P<0.05),和白双勇等[10]人的研究结果相似,表明在一定范围内,随着E2 浓度的增加促进精子发育和成熟。适量的E2 还可减少精子细胞的凋亡,诱导精子的发生,并通过其受体信号通路调控男性精子生成[11]。应该指出,E2 水平过高会影响睾丸产生精子的功能,并通过负反馈作用影响垂体-下丘脑分泌促性腺激素,从而影响男性生育能力[12]。本次研究结果显示T 的水平与精子密度和正常形态精子率呈正相关(均P<0.05),表明T 浓度的升高可提高精子的数量和质量,精子的产生和成熟需要高浓度T 来支持。临床上对于不明原因的少精子症和无精子症患者,使用雄激素或雄激素类药物治疗对精子生成有一定的作用[13]。
综上所述,男性基础性激素水平与精子质量参数之间存在一定的相关性,性激素的检测对男性不育患者十分必要。通过性激素的联合检测有助于准确全面地分析睾丸功能状态,为男性不育的病因分析、诊疗和预后提供重要依据。

