白酒酒醅高产酯酵母筛选鉴定及其发酵性能研究
刘建学 刘金科 李 璇 韩四海 李佩艳 徐宝成 郭金英 罗登林
(1. 河南科技大学食品与生物工程学院,河南 洛阳 471023;2. 河南省食品原料工程技术研究中心,河南 洛阳 471023)
浓香型白酒发展历史悠久,占据白酒行业70%以上,通常采用以大曲为主要糖化剂的典型自然固态发酵法生产,形成窖香浓郁、香味协调等风味特点[1]。但在实验室模拟白酒固态发酵工艺存在诸多局限性,诸如发酵参数的检测和控制,大多数是通过液态发酵来研究白酒微生物之间的作用。如Wu等[2-3]分析酿酒酵母、异常毕赤酵母和东方伊萨酵母组合发酵方式,最终可以生产出具有汾酒特征的产品。近年来,白酒的功能微生物如酵母菌、酵母菌和乳酸菌、酵母菌属之间已被广泛研究,其数据可以成功地应用于提高发酵液的稳定性和感官特性[4-6]。
作为白酒风味贡献的主要功能微生物,酵母菌可分为酿酒酵母和非酿酒酵母。其中非酿酒酵母中的产酯酵母可为白酒带来香味的复杂性,丰富白酒的风味物质[7-10]。戴尔有孢圆酵母(Torulasporadelbrueckii,T.delbrueckii)是一种典型的产香酵母,能够产生2-苯乙醇、2-氨基苯乙酮、乙酸戊乙酯等风味物质[11-13],同时也具有很高的环境耐受性[14]。T.delbrueckii具有优良的发酵特性,在果酒中应用广泛,通过不同的接种方式可研究T.delbrueckii对果酒挥发性物质生成的影响[15-17]。
目前,虽然T.delbrueckii已广泛应用于果酒类发酵,但在白酒发酵中的应用研究很少。研究拟通过筛选本土优良产酯特性的T.delbrueckii,研究其在模拟白酒发酵的发酵特性,旨在为本土T.delbrueckii在浓香型白酒生产中的应用提供指导。
1 材料与方法
1.1 材料与试剂
样品:酒醅采于豫南某浓香型白酒生产车间,为窖池中糟醅上、中和下层糟醅等量混合,实验室-20 ℃冷冻保存;
菌株:安琪白酒高活性酿酒酵母(鉴定为酵母属酿酒酵母),安琪酵母有限公司;
YPD培养基、YEPD培养基:按文献[18]配制;
WL培养基:按文献[19]配制;
生理生化培养基:按文献[20]22-23配制;
产酯培养基:按文献[7]配制;
葡萄糖:分析纯,江苏强盛功能化学股份有限公司;
胰化蛋白胨:英国OXOID公司;
琼脂粉:上海蓝季科技发展有限公司;
氯化钠、氢氧化钠:分析纯,西陇化工股份有限公司;
Taq Plus DNA聚合酶:酶活5 U/μL,上海生工股份有限公司。
1.2 仪器与设备
立式蒸汽灭菌锅:LDZX-50KB型,上海申安医疗器械厂;
电热恒温培养箱:SW-CJ-1D DH360BS型,上海坤天实验仪器有限公司;
数码显微镜:BA210型,北京瑞科中仪器有限公司;
可见分光光度计:722N型,上海驰唐实业有限公司;
冰箱:BCD-312WDPV型,山东青岛海尔股份有限公司;
PCR仪:Verity 96well型,美国ABI公司;
电泳仪:DYY-6C型,北京六一仪器厂。
1.3 方法
1.3.1 菌株筛选 将酒醅研磨后称取25 g至225 mL无菌生理盐水,加灭菌玻璃珠于200 r/min、28 ℃振荡30 min。移取振荡培养液1 mL至9 mL生理盐水中进行梯度稀释,将10-3、10-4、10-5稀释液在YEPD培养基和WL培养基上(两种培养基均加入0.008 g/L的氯霉素,防止细菌污染)进行平板涂布培养,每个梯度做3个平行,于28 ℃恒温培养。挑选单菌落,观察单菌落特征,如菌落大小、颜色、色泽等,并在40倍显微镜下观察酵母菌水浸片和染色片,将符合酵母菌落特征的单菌落在YEPD培养基上划线分离3次,斜面保藏,并将分离纯化单菌落经液体培养后于-20 ℃甘油保藏。
酵母产酯能力筛选:将分离纯化酵母菌接种到产酯培养基上,酵母菌接种量为5%,培养条件为30 ℃、200 r/min 振荡培养4 d,利用皂化回流法测定酵母产总酯含量。
1.3.2 菌种生理生化鉴定 对筛选酵母菌进行糖发酵试验、氮源同化试验、碳源同化试验、类淀粉试验、脲酶试验,并参照《酵母菌的特征与鉴定手册》[20]18-20进行鉴定判断。
1.3.3 菌种生长曲线测定 取所筛选酵母菌置于YPD液体培养基中,30 ℃静止培养培养24 h,每隔1 h取发酵液测定其OD600 nm值,以时间为横坐标、OD600 nm值为纵坐标绘制酵母菌生长曲线。
1.3.4 菌株耐受特性分析
(1) 酵母的耐温性试验:将活化后的酵母菌按5%的接种量接种到100 mL YPD液体培养基中,分别置于30,35,40 ℃恒温培养箱中培养,测定其培养24 h时的OD600 nm值,每组试验3个平行。
(2) 酵母的耐pH试验:将活化后的酵母菌按5%接种量接种到灭菌后调节pH为3.5,4.0,4.5,5.0的100 mL YPD液体培养基中,测定其培养24 h时的OD600 nm值,每组试验3个平行。
(3) 酵母的耐乙醇试验:将活化后的酵母菌按5%接种量接种到灭菌后调节乙醇体积分数为6%,8%,10%,12%的100 mL YPD液体培养基中,测定其培养24 h时的OD600 nm值,每组试验3个平行。
1.3.5 菌株分子生物学鉴定 酵母菌株26S rDNA D1/D2区序列分析方法:对筛选出的酵母菌株进行离心提取DNA后,进行PCR扩增,使用正向引物NL-1:5'-GCATATCAATAAGCGGAGGAAAAG-3',反向引物NL-4:5'-GGTCCGTGTTTCAAGACGG-3'[21]进行26S rDNA D1/D2区的目的片段扩增。PCR循环为:94 ℃预变性5 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,循环30次;72 ℃保持5 min。将得到的PCR产物交由上海生工生物工程股份有限公司进行纯化和测序。将测序序列在NCBI数据库中进行同源性检索,通过 MEGA 软件构建系统发育树。
1.3.6 模拟发酵试验
(1) 结合菌株拮抗试验:采用双层琼脂法[22],将10 μL 的戴尔有孢圆酵母、酿酒酵母的培养液分别与10 mL 灭菌后的半固体YPD培养基混合均匀后,立即倒入下层琼脂培养皿中,待凝固后放入牛津杯,每个牛津杯中加入100 μL稀释至一定梯度的菌液,28 ℃培养24 h后观察牛津杯周围是否出现抑菌圈,若未出现抑菌圈说明本底菌与接种菌株无拮抗作用;反之,则说明2种菌之间存在拮抗作用。
(2) 混菌发酵流程:取采自杜康酒业有限公司酿酒原料加蒸馏水糊化,糊化后加糖化酶糖化3 h,再加入α-淀粉酶酶解3 h,过滤分装并调节糖度,最后经高压蒸汽灭菌后备用。纯培养加入T.delbrueckiiW5 106CFU/mL、酿酒酵母300 mg/L。混合发酵先加入T.delbrueckiiW5 105CFU/mL,2 d后加入酿酒酵母150 mg/L。发酵液置于28 ℃恒温培养箱恒温培养,每隔24 h 进行理化指标测定。根据DNS法[23]测定发酵液还原糖含量,苯酚—硫酸法[24]测定发酵液总糖含量,按GB/T 10345—2007《白酒分析方法》测定发酵液乙醇含量、酸度、pH。菌落总数的测定采用稀释涂布法,在WL培养基上培养计数[25]。当发酵完全,即发酵液重量连续3 d减少重量不变时,取发酵液进行挥发性物质测定,挥发性物质经萃取后采用气质联用仪进行测量。
1.4 数据处理
利用 Microsoft Excel 2013和SPSS Statistics 17.0对样本(n=3)所得数据进行基本处理,Origin 2017进行图形绘制。
2 结果与分析
2.1 酵母形态及培养特征
如图1所示,经分离的酵母单菌落为乳白色,菌落质地均匀,正反两面、边缘和中央部位的颜色都很均一,菌落表面湿润、光滑、黏稠,容易挑起;菌体为圆形、椭圆形,且生殖方式为出芽生殖,与酵母菌的基本特征符合[25]。
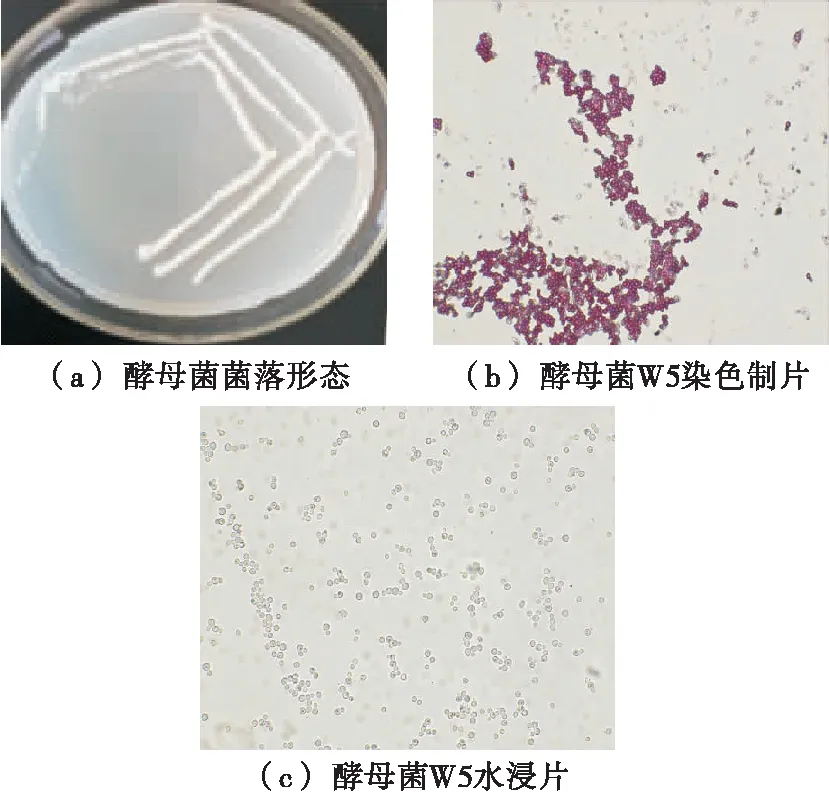
图1 酵母菌的菌落形态图片和镜检图片
2.2 酵母菌的二级筛选
对酒醅中分离的酵母进一步筛选,将初步分离的疑似酵母菌株进行产酯能力复筛,得到如图2所示结果,菌株Y1、M3、W5产总酯含量均超过2.0 g/L,其中W5产总酯含量最高,其为2.479 g/L。研究[16,26]表明,优质的产酯酵母可以在酯酶的作用下产生众多的酯类物质,除去酒类的杂味,改善酒类的品质。王鹏昊等[27]从酿酒小曲中分离优质产酯酵母,经产酯培养基筛选其总酯为2.684 g/L。因此选用Y1、M3、W5 3株菌株进行下一步试验。

图2 不同菌株产总酯含量
2.3 酵母菌的生理生化特性
2.3.1 酵母菌生长曲线 由图3可知,在同样初始接种量的情况下,菌株Y1在培养4 h左右进入对数生长期,菌株M3和W5在培养6 h时进入对数生长期,菌株Y1、W5达到平稳期的OD600 nm值明显高于M3,而且菌株Y1和M3在培养16 h后就已经达到平稳期,而菌株W5是在培养24 h后才逐渐达到平稳期,所以从生长状况来看菌株W5要优于菌株Y1和M3。

图3 3株酵母菌的生长曲线
2.3.2 酵母菌生理生化特性 参照《酵母菌的特征与鉴定手册》[20]18-20对筛选酵母菌进行生理生化特性鉴定,分别进行糖发酵试验、碳源同化试验、氮源同化试验、产类淀粉试验及脲酶试验,结果见表1。糖发酵试验结果表明,菌株Y1能够发酵葡萄糖、乳糖和蔗糖,不能发酵麦芽糖和半乳糖;菌株M3也能发酵葡萄糖和蔗糖,不能发酵麦芽糖、乳糖和半乳糖;菌株W5只能发酵蔗糖。碳源同化试验结果表明,筛选得到的菌株Y1、M3、W5均能够利用淀粉、葡萄糖、麦芽糖和蔗糖,但不能利用乳糖和柠檬酸。氮源同化试验结果表明,筛选出的3种酵母菌对硫酸铵、亚硝酸钠和硝酸钾的利用情况基本一致,菌株Y1、M3、W5都能利用硫酸铵和硝酸钾,不能利用亚硝酸钠。其他试验表明,筛选出的3株菌在生长代谢过程中均不能够产生类淀粉物质,且在脲酶试验中,酵母菌株均表现为阴性。
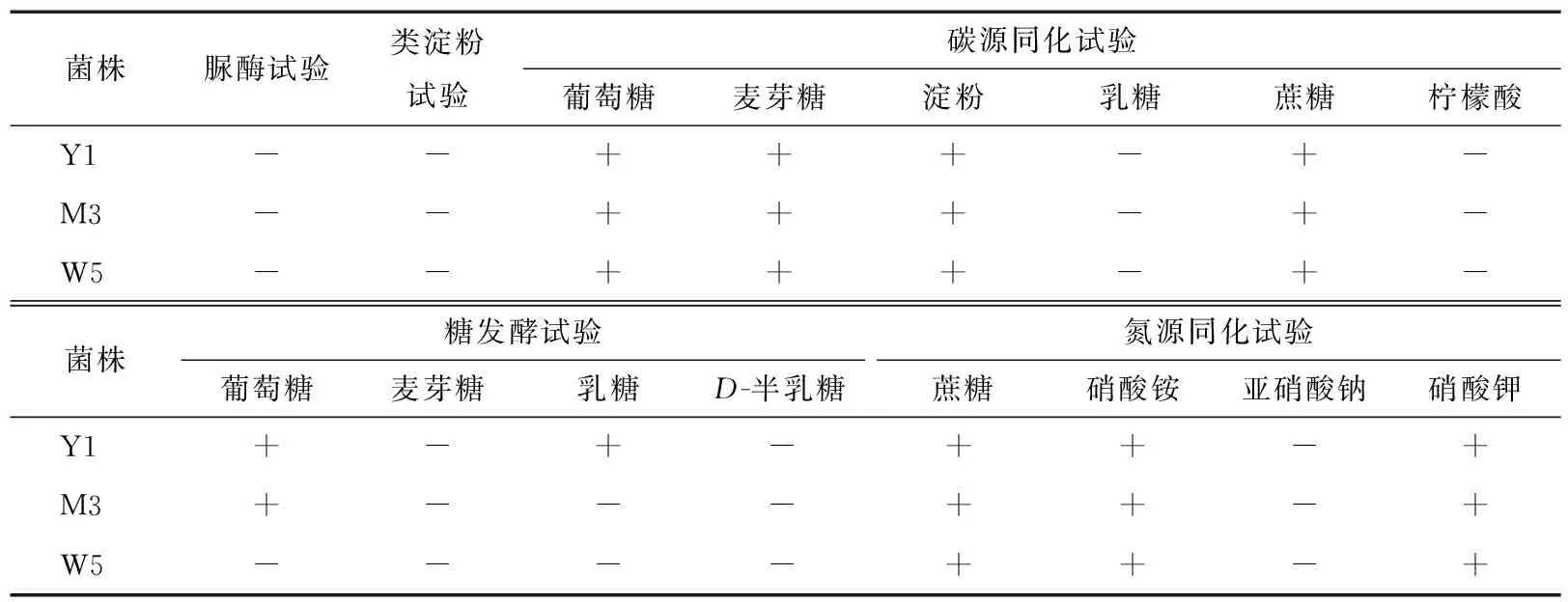
表1 菌株生理生化试验结果†
2.4 酵母菌生长特性研究
2.4.1 温度对酵母菌生长情况影响 如图4所示,温度为30~40 ℃时,3株菌均能生长,且菌株W5生长状况优于菌株Y1和M3,但在温度为40 ℃时三者生长受到抑制(OD600 nm值<0.5),说明菌株W5具有一定的耐温性。在浓香型白酒发酵过程中,发酵温度需控制在30~40 ℃,这样浓香型白酒的酒质才能得到保障[7]。
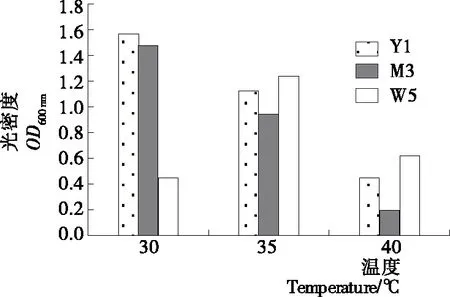
图4 温度对酵母菌生长情况的影响
2.4.2 pH对酵母菌生长情况影响 如图5所示,3株酵母菌株均有很好的pH耐受性,当pH为3.5时3株酵母菌株均能正常生长,酵母菌的生长状况随酸度的增加而减弱,但仍能保持其生物活性。而且菌株W5生长状况优于菌株Y1和M3。浓香型白酒发酵过程中由于产酸微生物的作用[28],其发酵环境呈酸性,一株优良的酵母菌必须具有良好的pH耐受性才能更好地参与到白酒固态发酵过程中。
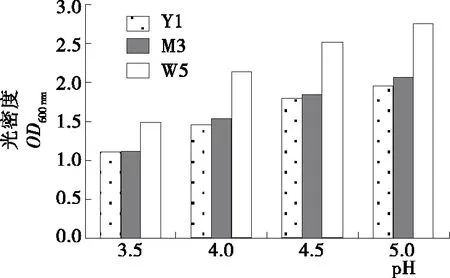
图5 pH对酵母菌生长情况的影响
2.4.3 乙醇浓度对酵母菌生长情况影响 由图6可知,3株酵母在乙醇含量为12%时生长均受到抑制(OD600 nm<0.5),但在乙醇浓度为6%~10%时菌株W5的生长状况优于菌株Y1和W5,说明菌株W5具有一定的乙醇耐受性。李小龙等[29]通过对白酒固态发酵过程中的微生物菌落演替研究发现,乙醇是菌落演替的最关键推动力,但随着发酵过程的继续,乙醇浓度升高,高浓度的乙醇会使酵母细胞产生毒效应,具有一定乙醇耐受性的酵母菌株在发酵过程中具有较高发酵特性。阳秀莲等[30]通过筛选杨梅果酒中乙醇耐受性高的酵母菌株,可以辅助发酵为杨梅酒增香。
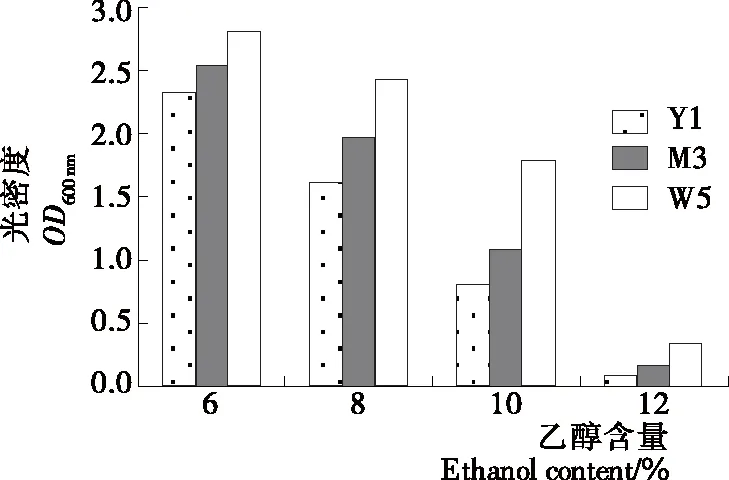
图6 乙醇浓度对酵母菌生长情况的影响
2.5 酵母菌分子鉴定结果
在NCBI里进行Blast序列比对,然后用MEGA-X软件中的邻接统计方法绘制菌株W5 26S rDNA D1/D2基因序列相关菌株的系统发育树。如图7所示,图中系统发育树显示菌株W5与MH794401.1TorulasporadelbrueckiivoucherUCASIM-2178聚在一个分支上,是彼此的近亲。结合菌落形状、镜检结果和生化试验结果分析,鉴定菌株W5属于戴尔凯氏有孢圆酵母(Torulasporadelbrueckii)[20]20-22。
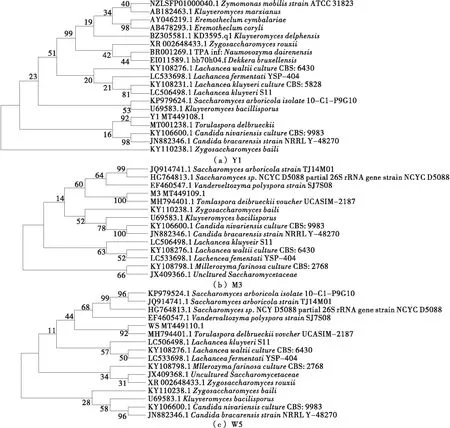
图7 菌株W5 26S rDNA D1/D2基因序列其亲缘关系的邻接系统发育树
2.6 混菌发酵理化特性
为防止混合发酵菌株之间存在抑制作用,影响其在发酵过程中的作用,对筛选酵母与酿酒酵母进行拮抗试验,结果表明酿酒酵母与T.delbrueckii之间无拮抗作用,牛津杯周围无抑菌圈出现,与空白组情况相同。因此,2株酵母可以进行混合发酵。以具有良好耐受性且产酯性能高的酵母菌株W5与酿酒酵母混合模拟白酒发酵,研究其理化指标和挥发性物质。由图8可知,酿酒酵母发酵速率最快,发酵时间为6 d;T.delbrueckiiW5单独发酵时间为8 d;T.delbrueckii与酿酒酵母混合发酵完成时间为9 d,顺序接种中T.delbrueckii由于先加入而成为优势菌株,酿酒酵母加入时由于基质的消耗而增殖空间有限,可以极大发挥混合发酵中T.delbrueckii发酵特性,随着酿酒酵母的加入,二者之间的相互竞争关系使得发酵完成时间延后。

图8 不同方式培养酵母时的还原糖变化
由图9(a)可知,酿酒酵母菌落数呈现“S”型生长特征,菌落数在第4天达到峰值,酵母活细胞数为7.7×107CFU/mL,此后便开始下降。由图9(b)可知,T.delbrueckiiW5纯培养第3天,酵母活细胞数达到峰值,说明T.delbrueckiiW5能迅速适应白酒发酵环境。由图9(c)可知,先加入的T.delbrueckiiW5利用糖类等迅速增殖,到第2天时T.delbrueckiiW5已经成为优势菌株。此时随着酿酒酵母的加入,虽然酿酒酵母生长能力较T.delbrueckiiW5好,但T.delbrueckiiW5由于数量优势受酿酒酵母影响较小。由于二者处于竞争关系,二者的活细胞数都较纯培养时低,酿酒酵母在第5天时活细胞数才达到峰值。

图9 不同发酵方式酵母活细胞数变化
如表2所示,3种发酵方式还原糖含量均小于4 g/L,说明3种发酵均能完成。在相同的培养条件和发酵条件下,T.delbrueckii纯培养方式下总酸度较其他两种培养方式高,其总酸含量为7.62~7.72 g/L,说明T.delbrueckii单独发酵产总酸能力很高,乳酸为主的非挥发性酸类能增加白酒的敦厚感,适当的酸含量可以协调白酒的各种风味成分,提升白酒的口感。而混合发酵试验总酸含量得到显著减少,说明酿酒酵母的加入可以减少T.delbrueckii的产总酸量。另外T.delbrueckiiW5挥发酸产量较另外两种发酵方式低,其挥发酸为0.32~0.48 g/L,白酒当中挥发酸主要有甲酸、乙酸、丁酸等,挥发酸的含量可以直接影响到白酒的风味和质量,如乙酸强烈的酸味会使白酒风味变差。酿酒酵母纯培养乙醇含量为13.18%~13.50%,说明酿酒酵母相较于T.delbrueckii单独发酵具有强发酵能力,二者之间混合发酵可以提高T.delbrueckii单独发酵产乙醇能力。

表2 模拟发酵试验理化指标†
3 结论
(1) 获得一株高产酯酵母。从浓香型白酒酒醅中分离得到优势非酿酒酵母,通过浓香型白酒发酵条件耐受性筛选,经过分子生物学鉴定为戴尔有孢圆酵母。
(2) 发酵过程中菌种间有竞争关系。通过筛选酵母与酿酒酵母模拟白酒发酵试验,发现酿酒酵母发酵速率最快,发酵完成时间为6 d,T.delbrueckiiW5单独发酵时间为8 d,二者混合发酵时间为9 d,延长了发酵完成时间,表明在混菌发酵过程中菌种间有竞争关系。
(3) 产酯能力。酸是生成酯类物质的前体物质,在相同培养和发酵条件下,T.delbrueckii纯菌发酵方式其总酸含量较其他两种培养方式高,其总酸含量范围在7.62~7.72 g/L,表明T.delbrueckii产酯能力高。同时,混菌发酵可以提高产乙醇能力,与目标菌种单一菌种发酵相比,由10.55%提高到了11.62%。
戴尔有孢圆酵母在白酒生产中尚没有应用,所具有的高产酯能力仍需进一步研究,对其发酵性能的深入了解,有助于在白酒酿造中发挥其高产酯、高产乙醇的作用。

