丁苯酞对rt-PA 静脉溶栓治疗的超早期脑梗死患者氧化损伤和炎症因子的影响
洪 震, 王丽轩, 张丽冉, 郭 建, 黄少越, 张俊玲
(河北省沧州市中心医院神经内二科,沧州 061000)
脑梗死是常见的脑卒中类型,具有高致残率、高死亡率的特点,流行病学调查显示,我国脑卒中的患病率较30 年前有显著上升,且农村患病率上升更为显著,60 岁以上人群的发病率相对较高[1]。早期积极干预,恢复缺血脑组织的供血供氧可有效缩小脑组织缺血坏死面积,减轻神经功能缺损症状,改善患者的预后。成功溶栓可迅速恢复脑部梗死灶的血液供应,挽救濒死的神经细胞,恢复神经细胞的生理功能。然而,梗死灶灌注的恢复可伴随着再灌注损伤,影响溶栓效果[2-3]。氧化应激、炎症反应等均参与了再灌注损伤的过程[4]。因此,抑制氧化损伤和炎症损伤有利于减轻再灌注损伤,进一步提高溶栓治疗的效果。本研究就丁苯酞对rt-PA 静脉溶栓治疗的超早期脑梗死患者氧化损伤和炎症反应的影响进行探讨。
1 资料与方法
1.1 一般资料
选取2016 年1 月—2019 年1 月的超早期脑梗死患者136 例为研究对象,随机分为观察组和对照组,各 78 例。观察组中男 43 例,女 35 例,患者年龄 42~75 岁,平均年龄(57.12±7.84)岁,美国国立卫生院神经功能缺损评分(NIHSS)为(17.68±4.41)分;对照组中男 41 例,女 37 例,患者年龄 43~73 岁,平均年龄(57.07±7.43)岁,NIHSS评分为(16.79±4.28)分。两组患者一般资料比较差异均无统计学意义(P 均>0.05),具有可比性。两组患者均知情同意并签署知情同意书,本研究获本院医学伦理委员会批准。
1.2 纳入和排除标准
参照《中国急性缺血性脑卒中诊治指南》[5]明确诊断。所有患者的病程均<4.5 h,经颅脑CT 或MRI 检查后明确超早期脑梗死的临床诊断。排除标准:既往有卒中、颅脑外伤、心肌梗死病史者;合并凝血功能障碍、服用抗凝药物、合并颅内肿瘤等具有溶栓治疗禁忌症者;合并肝肾功能衰竭、全身感染性疾病等影响本研究相关指标检测结果者;合并精神疾病的患者。
1.3 治疗方案
两组患者在明确诊断后,均接受rt-PA 静脉溶栓治疗。根据0.9 mg·kg-1的剂量计算出rt-PA(Boehringer Ingelheim Pharma GmbH&Co,KG 生产,进口药品注册证号S20110052)的使用总剂量,先静脉推注总剂量的10%,剩下的90%持续静脉滴注,60 min 内滴注完毕。此外,根据《中国脑血管病防治指南》两组患者均常规卧床休息,给予阿司匹林抗血小板聚集,他汀类药物调脂、稳定斑块,依达拉奉抗自由基,胞磷胆碱等营养神经等治疗。合并高血压、糖尿病等基础疾病者,对症给予降压、降糖等治疗。对照组按照上述治疗进行,观察组在上述治疗的同时,在静脉溶栓治疗前0.5 h 静脉滴注丁苯酞氯化钠注射液(石药集团恩必普药业有限公司生产,国药准字H20100041),每次 100 mL,每天 2 次,2 次静脉滴注间隔时间应超过6 h,连续治疗14 d 为一个疗程。
1.4 观察指标
两组患者均于溶栓前和溶栓后24 h、7 d、14 d 由同一组神经内科医师完成NIHSS 的评估,对比两组患者的NIHSS 评估结果。NIHSS 评分范围为0~42 分,得分越高说明患者神经功能缺损症状越严重。两组患者均于溶栓前、溶栓24 h、3 d 后行氧化损伤指标[超氧化歧化酶(SOD)、丙二醇(MDA)]及炎性因子[超敏C 反应蛋白(hs-CRP)、肿瘤坏死因子-α(TNF-α)]的检测。SOD、MDA、hs-CRP、TNF-α 的检测均采用酶联免疫吸附法。SOD、MDA 试剂盒购自上海研谨生物科技有限公司;hs-CRP、TNF-α 试剂盒购自武汉博士德生物工程有限公司。两组患者与溶栓前、溶栓后 14 d 行血清内皮素-1(ET-1)、一氧化氮(NO)的检测。ET-1 的检测采用放射免疫法,NO 的检测采用硝酸还原法,检测试剂盒购自美国R&D公司。
1.5 统计学方法
采用SPSS 17.0 进行分析,计量资料采用均数±标准差()表示,采用 t 检验或方差分析,计数资料比较采用χ2检验,P≤0.05 为差异有统计学意义。
2 结果
2.1 两组患者治疗前后NHISS 评估结果比较
两组患者溶栓后的NHISS 均低于溶栓前(P均<0.05);两组患者溶栓后随着治疗的进行,NIHSS 评分逐渐下降(P 均<0.05);观察组溶栓后24 h、7 d 和 14 d 的 NIHSS 评分均低于对照组(P均<0.05),见表 1。
2.2 两组患者治疗前后SOD、MDA 水平比较
两组患者溶栓后随着治疗的进行,SOD 水平逐渐升高,而 MDA 水平逐渐降低(P 均<0.05);两组患者溶栓后24 h、3 d 的SOD 均高于溶栓前,MDA 均低于溶栓前(P 均<0.05);观察组溶栓后24 h、3 d 的 SOD 高于对照组,而 MDA 低于对照组(P 均<0.05),见表 2。
2.3 两组患者治疗前后hs-CRP、TNF-α 水平比较
两组患者溶栓后随着治疗的进行,hs-CRP、TNF-α 水平逐渐降低(P 均<0.05);两组患者溶栓后 24 h、3 d 的 hs-CRP、TNF-α 均低于溶栓前(P 均<0.05);观察组溶栓后 24 h、3 d 的 hs-CRP、TNF-α 水平均低于对照组(P 均<0.05),见表 3。
2.4 两组患者治疗前后ET-1、NO 水平比较
两组溶栓14 d 后的ET-1 低于溶栓前,而NO 高于溶栓前(P 均<0.05);观察组溶栓 14 d 后的ET-1 低于对照组,而NO 高于对照组(P 均<0.05),见表 4。
表1 两组患者NIHSS 评估结果的对比(,分)

表1 两组患者NIHSS 评估结果的对比(,分)
与溶栓前比较 *P<0.05;与溶栓 7 d 后比较△P<0.05;与溶栓 14 d 后比较 #P<0.05
组别 n 溶栓前 溶栓24 h 后 溶栓7 d 后 溶栓14 d 后 F 值 P 值观察组 78 17.68±4.41 10.82±4.18* 7.18±3.04*△ 5.05±2.14*△# 11.803 <0.001对照组 78 16.79±4.28 12.96±5.31* 10.74±5.09*△ 7.73±3.01*△# 6.137 <0.001 t 值 1.279 2.797 5.303 6.409 P 值 0.203 0.006 <0.001 <0.001
表2 两组患者治疗前后SOD、MDA 水平比较()

表2 两组患者治疗前后SOD、MDA 水平比较()
与溶栓前比较 *P<0.05;与溶栓 24 h 后比较△P<0.05
组别nSOD/(U·mL-1)F 值P 值MDA/(μmol·L-1)F 值 P 值溶栓前 溶栓24 h 后 溶栓3 d 后 溶栓前 溶栓24 h 后 溶栓3 d 后观察组 78 61.97±10.89 81.04±13.75* 103.01±15.94*△ 17.035 <0.001 14.09±0.81 9.57±1.31* 7.33±0.79*△ 13.805 <0.001对照组 78 61.44±10.96 70.09±11.75* 92.61±13.42*△ 9.183 <0.001 14.17±1.04 12.62±1.18* 10.28±1.36*△ 5.113 <0.001 t 值 0.303 5.347 4.408 0.536 15.278 16.565 P 值 0.762 <0.001 <0.001 0.593 <0.001 <0.001
表 3 两组患者治疗前后 hs-CRP、TNF-α 水平比较()
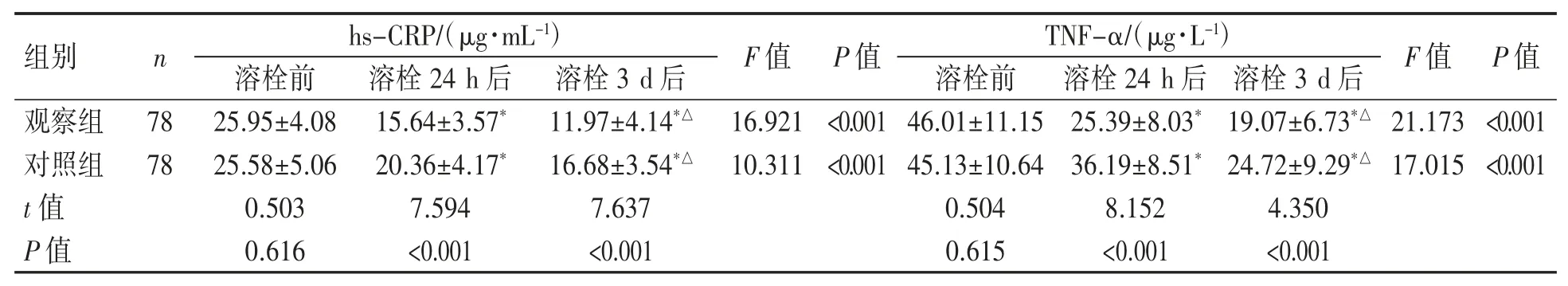
表 3 两组患者治疗前后 hs-CRP、TNF-α 水平比较()
与溶栓前比较 *P<0.05;与溶栓 24 h 后比较△P<0.05
组别nhs-CRP/(μg·mL-1)F 值 P 值TNF-α/(μg·L-1)F 值 P 值溶栓前 溶栓24 h 后 溶栓3 d 后 溶栓前 溶栓24 h 后 溶栓3 d 后观察组 78 25.95±4.08 15.64±3.57* 11.97±4.14*△ 16.921 <0.001 46.01±11.15 25.39±8.03* 19.07±6.73*△ 21.173 <0.001对照组 78 25.58±5.06 20.36±4.17* 16.68±3.54*△ 10.311 <0.001 45.13±10.64 36.19±8.51* 24.72±9.29*△ 17.015 <0.001 t 值 0.503 7.594 7.637 0.504 8.152 4.350 P 值 0.616 <0.001 <0.001 0.615 <0.001 <0.001
表 4 两组患者治疗前后 ET-1、NO 水平比较()

表 4 两组患者治疗前后 ET-1、NO 水平比较()
组别nET-1/(pg·mL-1)t 值P 值NO/(mmol·L-1)t 值P 值溶栓前 溶栓14 d 后 溶栓前 溶栓14 d 后观察组 78 98.36±14.84 55.18±11.79 20.121 <0.001 39.01±6.94 65.38±9.07 20.393 <0.001对照组 78 97.57±12.92 69.91±12.15 13.774 <0.001 40.17±7.83 49.03±7.93 7.022 <0.001 t 值 0.355 7.684 0.979 11.986 P 值 0.723 <0.001 0.329 <0.001
3 讨论
脑梗死是动脉粥样硬化等病变引起脑组织的血液供应障碍,导致局部脑组织因缺血缺氧而出现变性、坏死而产生各种神经功能缺损症状的疾病。早期溶栓治疗可及早恢复梗死灶的血液灌注,挽救缺血濒死神经细胞,以减少患者神经功能的缺损程度,改善患者的预后和生活质量[6]。临床研究[7-8]显示,溶栓时间窗过长,再灌注损伤越严重,对患者预后的影响越明显。因此,对有溶栓指征的急性脑梗死患者及早实施溶栓治疗,并积极干预再灌注损伤对提高溶栓效果、改善患者预后有重要的意义。
本研究结果显示,观察组溶栓后24 h、7 d、14 d 的NIHSS 评分均低于对照组,说明丁苯酞可显著减轻超早期脑梗死患者溶栓后的神经功能缺损症状。同时,观察组溶栓后的MDA、hs-CRP、TNF-α 均显著低于对照组,而 SOD 显著高于对照组,说明丁苯酞可减轻超早期脑梗死患者溶栓后氧化应激损伤和炎症反应损伤,这可能是丁苯酞减轻脑梗死溶栓后神经功能缺损症状的主要机制之一。缺血再灌注损伤的发生过程与NO 的表达关系密切[9]。自由基、过氧化硝酸根均可导致神经细胞DNA 的氧化损伤并抑制DNA修复酶的活性,损伤线粒体膜功能,引起线粒体膜孔异常开放,最终引起线粒体肿胀、破裂,细胞代谢障碍而发生凋亡[10-11]。氧化损伤可损伤血管内皮,导致血管内皮功能障碍,引起局部神经组织微循环障[12-13]。氧自由基还可导致蛋白质、脂质、核酸等过氧化损伤,导致神经细胞功能障碍、变性,乃至凋亡[14-15]。在缺血再灌注的过程中,炎症因子的大量释放和聚集引起的炎症反应损伤也是造成再灌注损伤的重要环节[16-17]。TNF-α、白细胞介素等炎症因子均可造成血管内皮功能损伤,导致血管通透性增加,引起神经组织肿胀,加重局部组织的变性、坏死等病变[18-19]。丁苯酞可保护血管内皮功能,减轻神经细胞损伤,保护神经细胞功能。相关动物实验研究证实,丁苯酞可抑制脑缺血再灌注大鼠白细胞介素-1β(IL-1β)的表达,保护缺血灶的神经结构[20]。宋朝彦等[21]的研究证实,丁苯酞通过抑制casepase-3 的表达,减轻神经细胞凋亡,保护神经细胞功能。鲁瑞涛[22]的研究也证实,丁苯酞对神经细胞的保护作用与其抑制Bax、Caspase-3 蛋白的表达和促进Bcl-2 蛋白的表达有关。
血管内皮功能损伤是脑梗死发病的重要机制,也参与了脑梗死急性期病理改变的过程。血管内皮功能障碍是斑块形成并最终产生血栓、导致血液供应障碍的主要原因之一。本研究结果显示,观察组溶栓后14 d 的ET-1 低于对照组,而NO 高于对照组,这说明丁苯酞可进一步改善rt-PA 静脉溶栓后脑梗死患者的血管内皮功能。NO具有强大的舒张血管作用,NO 表达水平的变化反应了血管内皮功能的损伤情况。NO 还可抑制氧自由基所造成的氧化损伤,对细胞膜结构有稳定作用,缓解细胞膜通透性的改变,延缓组织细胞的肿胀、破裂等病理改变[23]。同时,NO 对白细胞等炎症细胞在血管内皮的黏附、聚集有抑制作用,可延缓血管腔狭窄、动脉粥样硬化的进程[24]。ET-1 具有强效收缩血管的作用,其表达水平的上调可促进血管平滑肌细胞增殖和动脉硬化病变的进展,从而影响血管内皮细胞的正常功能[25]。ET-1、NO 在机体表达的动态平衡共同维持血管功能的正常,两者表达失衡则可导致血管功能障碍,诱发脑血管疾病、心血管疾病等血管相关疾病的发生。潘君枝[26]等的研究也证实,丁苯酞有助于提高血管内NO 的表达水平,改善血管内皮功能。
综上,丁苯酞可减轻rt-PA 静脉溶栓治疗后超早期脑梗死患者的氧化损伤,抑制炎症因子的表达,保护血管内皮功能,减轻患者的神经功能缺损症状,提高临床疗效。

