miR-21对视网膜母细胞瘤细胞增殖的影响及作用机制
桂馥 吴宏禧 游志鹏 章余兰
视网膜母细胞瘤(RB)是婴幼儿中最常见的原发性眼内恶性肿瘤,在婴幼儿易患的全部恶性肿瘤中占3%。因本病发病年龄小,易造成诊断与治疗的延迟、肿瘤细胞的恶化与迁移,进而引发较高的死亡率[1-2]。因此,为了减轻患者的痛苦以及延长寿命,及时的疾病诊断以及有效的治疗是必不可少的。微小RNA(microRNAs,miR)是参与细胞中基因表达转录后调控的短链非编码RNA,影响着多种生物学过程,如细胞发育、增殖及分化等。有研究表明[3],miRNA 既可以扮演致癌基因,又可以起到抑癌基因的作用来调节肿瘤的增殖及凋亡过程。 miR-21在多种类型的肿瘤以及肿瘤细胞系中都呈高表达,并且是最显著的促癌因子之一[4-6]。但是miR-21作为一个特殊的miRNA,是如何在RB发生发展过程中发挥作用的,而且其影响细胞生长或凋亡的具体机制及途径也未知。因此,本研究旨在探讨miR-21在RB组织及Weri-Rb-1细胞(人视网膜神经胶质瘤细胞)中的表达及其对细胞增殖的影响及其作用机制。
1 材料与方法
1.1 材料和分组Weri-Rb-1细胞购买于中国科学院细胞库。miR-21抑制剂和miR-21阴性对照购买于上海吉码药物有限责任公司。收集2015年1月至2018年5月在南昌大学第二附属医院诊断为RB并行眼球摘除术的15例患者组织标本和15例角膜移植供体眼的视网膜组织标本。在标本离体后30 min内将视网膜组织标本切成直径为 0.5 cm 左右的组织块,装入灭菌冻存管中,迅速放入液氮罐中保存。病理切片证实RB组织标本为RB,而角膜移植供体眼的视网膜组织病理学表现为正常[1]。RB患者年龄0.5~8.8岁,平均3.3岁,排除既往有其他器官或组织恶性肿瘤病史、合并其他恶性肿瘤、术前接受其他抗肿瘤治疗情况。此研究经南昌大学第二附属医院伦理委员会批准后进行。采用阳离子脂质体Lipofectamine介导的转染方法,将miR-21抑制剂(miR-21 inhibitor)转染入体外培养的Weri-Rb-1细胞中作为miR-21 inhibitor组,将随机序列寡核苷酸链转染入Weri-Rb-1细胞作为阴性对照组(NC组)。
1.2 方法
1.2.1 检测miR-21在RB组织、正常组织以及Weri-Rb-1细胞中的表达提取15例RB组织标本及正常视网膜组织标本的RNA并进行逆转录,合成cDNA第一链,然后进行扩增,40个循环后用Agi-lent Stratagene荧光定量PCR仪Mx3000P进行PCR实验,检测 miR-21的表达。实验按照 2-△△Ct方法处理数据。同时收集培养的Weri-Rb-1细胞,提取RNA并进行逆转录,使用qRT-PCR法检测miR-21的表达。引物序列:miR-21正向引物:5’-GCCGCTAGCTTATCAGACTGATGT-3’、反向引物:5’-GTGCAGGGTCCGAGGT-3’;GAPDH正向引物:5’-AGCCACATCGCTCAGACA-3’、反向引物:5’-TGGACTCCACGACGTACT-3’。
1.2.2 抑制 miR-21表达对Weri-Rb-1细胞增殖和凋亡的影响将对数生长期的Weri-Rb-1细胞接种在96孔板中,在细胞转染阴性对照以及miR-21 inhibitor后培养24 h、48 h、72 h、96 h,每孔加入20 μL MTT(5 g·L-1)继续孵育4 h,然后每孔加入150 μL DMSO,最后使用酶标仪测定吸光度(A)值。将对数生长期的Weri-Rb-1细胞密度稀释为10×103个·mL-1,接种于6孔板,培养48 h。在细胞转染阴性对照以及miR-21 inhibitor之后,继续培养6 h后将每孔中加入1.25 μL Annexin V-FITC,反应15 min后加入10 μL碘化丙碇(PI),染色完成后1 h内使用流式细胞仪对细胞样品进行检测分析。将转染阴性对照和miR-21 inhibitor的Weri-Rb-1细胞,继续培养6 h后每孔加入1 mL Hoechst 33342溶液,使其终浓度为5 g·L-1。孵育30 min后清洗细胞,直接用荧光显微镜进行观察。
1.2.3 抑制 miR-21表达对凋亡相关蛋白PDCD4、Bax和Bcl-2表达的影响Weri-Rb-1细胞转染阴性对照以及miR-21 inhibitor 48 h后,两组细胞加入裂解液、取上清,BCA 法蛋白定量,蛋白变性后每组每孔取50 μg行凝胶电泳,转至 PVDF 膜,50 g·L-1脱脂奶粉室温封闭2 h,敷一抗(11000),4 ℃摇床过夜,PBST 洗 3 遍后室温下敷辣根过氧化物酶标记二抗( 12 000) 2~3 h,均匀加入发光液与 PVDF 膜反应后曝光,将带有蛋白条带的胶片进行扫描之后,使用Quantity one软件对蛋白条带进行定量分析。
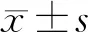
2 结果
2.1 miR-21在Rb组织、正常视网膜组织以及Weri-Rb-1细胞中的表达miR-21在RB组织中的表达水平为2.214±0.162,高于正常视网膜组织(0.703±0.071)的3倍以上,差异有统计学意义(t=1448.26,P<0.001)。 miR-21 在 Weri-Rb-1 细胞中表达水平为2.251±0.134,转染后48 h,miR-21在NC组表达水平为2.245±0.213,在miR-21 inhibitor组表达水平(0.683±0.075)较NC组明显降低,差异有统计学意义(t=1673.67,P<0.01)。
2.2 NC组与miR-21 inhibitor组细胞增殖比较使用阴性对照或miR-21抑制剂转染Weri-Rb-1细胞,分别在培养24 h、48 h、72 h和96 h后,通过MTT测定法检测细胞存活率。结果显示:两组24 h 的A值比较,差异无统计学意义(P>0.05);miR-21 inhibitor 组 48 h、72 h 、96 h的A值均低于 NC 组,差异均有统计学意义(均为P< 0.05)。见表1。
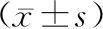
表1 NC组与miR-21 inhibitor组细胞增殖(A值)比较
2.3 NC组与miR-21 inhibitor组细胞凋亡率的比较NC组凋亡细胞早晚期在总细胞中百分比分别为(3.045±0.301)%和(4.832±0.493)%,miR-21 inhibitor组凋亡细胞早晚期在总细胞中百分比分别为(2.593±0.257)%和(40.167±4.014)%,miR-21 inhibitor组Weri-Rb-1细胞的凋亡率明显高于NC组(P< 0.01)。荧光显微镜观察结果显示: miR-21 inhibitor组凋亡细胞核数量明显高于NC组。见图1和图2。

图2 荧光显微镜下经Hoechst 33342染色的两组细胞 蓝色为存活细胞正常核染色,染色白亮的细胞核表明染色质浓缩和凋亡(红色箭头)。放大倍数:×200

图1 流式细胞仪检测经过Annexin V-FITC/PI试剂双染色的两组细胞象限图
2.4 NC组与miR-21 inhibitor组凋亡相关蛋白PDCD4、Bax和Bcl-2表达比较NC组凋亡相关蛋白PDCD4表达(0.192±0.045)相比miR-21 inhibitor组(0.683±0.091)明显减少,NC组Bax蛋白表达水平(0.143±0.036)相比miR-21 inhibitor组(1.192±0.054)也明显减少,差异均有统计学意义(t=131.42、367.91,均为P<0.01),NC组Bcl-2蛋白表达(0.864±0.038)相比miR-21 inhibitor组(0.257±0.026)明显增多,差异有统计学意义(t=1.76,P<0.01)。见图3。

图3 凋亡相关蛋白PDCD4、Bax和Bcl-2在两组细胞中的表达
3 讨论
miRNAs广泛分布于角膜、视网膜以及晶状体等眼部组织细胞中,在正常的眼部组织中呈现出特异性的表达,在眼部组织的生长发育、分化、受损后的组织再生以及调控昼夜节律等多种生理功能中发挥重要的作用[7-9];而miRNAs发生突变或者表达异常会影响正常组织细胞的生长增殖、分化、凋亡,从而导致细胞发生癌变。miRNAs在肿瘤中的表达具有组织特异性,不同肿瘤组织中的miRNAs表达不同。在眼部组织的恶性肿瘤中,miRNAs根据功能的不同被分为两类,分别是发挥促癌作用的miRNAs,这类小RNAs在正常组织中表达情况较低,然而在肿瘤组织中呈现高表达;如miRNA-17~92家族;而另外一类是发挥抑癌作用的miRNAs,其在正常组织表现为高表达,而在肿瘤组织中呈现低表达,如let-7和miR-22等[10-12]。RB是起源于视网膜胚胎性核层的一种恶性肿瘤,近年来已有关于miRNAs在RB中发挥作用的相关报道,为RB的治疗提供了新的突破点,miR-21也在不同的RB细胞系Weri-Rb-1、Y79以及 RB355细胞中都有表达[13]。但是miR-21作为一个特殊的miRNA,是如何在RB发生发展过程中发挥作用的、而且其影响细胞生长或凋亡的具体机制及途径也未知。
本研究首先对RB组织以及正常视网膜组织中的miR-21水平进行了相对的定量分析,结果发现:与正常视网膜组织中的miR-21表达比较,RB组织中miR-21含量要高3倍以上;表明在RB的发生发展过程中,miR-21可能发挥了促进作用。为了进一步研究miR-21在RB中的作用,对Weri-Rb-1细胞进行了阴性对照以及miR-21 inhibitor的转染,发现转染miR-21 inhibitor能显著抑制Weri-Rb-1细胞中miR-21的转录。随后通过MTT实验发现,miR-21 inhibitor在抑制miR-21转录的同时,也抑制了Weri-Rb-1细胞的存活率,随后通过流式细胞术以及荧光显微镜成像等技术手段发现,Weri-Rb-1细胞凋亡率增加。这些结果均表明:miR-21是RB的促癌基因,即在肿瘤发生过程中起到促进肿瘤生长的作用,抑制miR-21可有效抑制Weri-Rb-1细胞的存活,促进其凋亡。
为了进一步探讨miR-21在Weri-Rb-1细胞凋亡中的具体作用机制,我们通过免疫蛋白印迹法对凋亡相关蛋白进行了定量研究。首先对PDCD4进行了研究,一方面是因为PDCD4是程序性死亡相关基因,而细胞凋亡属于I型程序性细胞死亡;另一方面是因为已有相关研究表明PDCD4可能是miR-21的靶基因;miR-21抑制剂很可能通过调控PDCD4,来参与细胞的凋亡过程[14-17]。除此之外,我们也对典型的促凋亡蛋白Bax,以及抑凋亡蛋白Bcl-2进行了定量研究。本研究结果发现:与NC组相比,miR-21 inhibitor的转入明显增加了PDCD4、Bax蛋白表达水平,相反却抑制了抑凋亡蛋白Bcl-2蛋白水平。这些结果表明:miR-21通过调控Weri-Rb-1细胞中凋亡相关蛋白的表达,来抑制细胞凋亡的发生。
综上所述,miR-21在RB的发生发展过程中起到促癌基因的作用,通过调控各种凋亡蛋白的表达来影响肿瘤细胞的增殖与凋亡,miR-21是否会对肿瘤细胞的迁徙、转移及细胞周期产生影响,及其具体细胞通路仍需进一步研究。

