奈诺沙星对巨噬细胞特异性免疫调控作用研究
张昳馨 , 陈楠烨, 冯美卿, 林东昉, 黄金伟, 赵 旭
喹诺酮类抗菌药物是吡酮酸类化学合成抗菌药物,具有4-喹诺酮结构,因其广谱抗菌活性在临床广泛应用于各类感染的治疗[1]。目前熟知的环丙沙星、左氧氟沙星、莫西沙星等氟喹诺酮类抗菌药物,其结构特点为喹诺酮母核的6位均含有氟[2]。现已开发一系列无氟喹诺酮类新药。奈诺沙星(nemonoxacin)作为新的无氟喹诺酮类选择性拓扑异构酶抑制剂的代表,具有广谱抗菌活性,对各种革兰阳性菌和阴性菌、厌氧菌及非典型病原体均有良好抗菌活性,该药的口服制剂已于2016年在中国大陆地区上市,适用于治疗轻、中度成人社区获得性肺炎[3-4]。
近年来国内外研究显示,氟喹诺酮类抗菌药物对宿主的非特异性及特异性免疫均有调控作用[5-6]。如莫西沙星对脂多糖(LPS)刺激单核巨噬细胞产生白细胞介素(IL)-8、肿瘤坏死因子(TNF)-α、IL-1β等均有抑制作用[7]。本课题组前期研究表明,奈诺沙星在体外和体内试验中均显示对LPS诱导的炎性反应具有免疫调节作用,表现为抑制促炎因子IL-6、TNF-α分泌,促进抑炎因子IL-10分泌,从而抑制宿主产生过度免疫反应,对宿主具有一定保护作用。同时奈诺沙星能显著降低高剂量LPS引起严重内毒素血症小鼠的死亡率[8]。在此基础上,本课题组采用流式细胞技术研究奈诺沙星对LPS诱导的小鼠内毒素血症模型中脾脏免疫细胞的影响;研究奈诺沙星对巨噬细胞吞噬功能的免疫调控作用;采用酶联免疫吸附试验(ELISA)检测奈诺沙星对LPS诱导巨噬细胞分泌细胞因子的作用;采用免疫印迹试验(Western blot)方法检测奈诺沙星对细胞因子相关信号转导通路的调控作用。现报道如下。
1 材料与方法
1.1 材料
1.1.1 细胞株 RAW264.7细胞,属小鼠单核巨噬细胞系,购自美国Thermo Fisher公司。
1.1.2 试剂 奈诺沙星标准品由浙江医药股份有限公司提供;流式细胞技术所用抗体anti-CD16/anti-D32、太平洋蓝-PE、异硫氰酸荧光素(FITC)、别藻蓝蛋白(APC)等荧光标记的CD11b、CD11c、 F4/80、 Ly6G结合抗体购自美国Bio-Rad公司;DMEM培养液(高糖)购自美国Gibco公司;青霉素、链霉素双抗、LPS、二甲基亚砜(DMSO)、细胞裂解液RIPA缓冲液购自美国Sigma公司;类胎牛血清购自美国HyClone公司;96孔ELISA试剂盒购自美国Bio-Rad公司;用于Western blot的10%十二烷基硫酸钠(SDS)聚丙烯酰胺胶、聚偏二氟乙烯(PVDF)膜、吐温20、TBS缓冲液均购自美国Sigma公司。二辛可宁酸(BCA)蛋白浓度检测试剂盒、化学发光试剂ECL prime显色溶液均购自美国Bio-Rad公司,p38 MAPK抗体、ERK1/2抗体、p-JNK抗体、p-100抗体(1∶1 000 稀释)及对照β-actin抗体购自美国R&D公司。
1.1.3 实验动物 C57BL/C小鼠,鼠龄8~10周,体质量20~25 g,雄性,合格证号为SCXK(沪):2017-0002,购自上海斯莱克实验动物有限公司。小鼠饲养温度18~25 ℃,相对湿度50%~70%,本研究使用15只。
1.1.4 菌株 进行巨噬细胞吞噬试验的菌株为华山医院临床分离菌株肺炎克雷伯菌18-218,来源于1例呼吸机相关性肺炎患者的肺泡灌洗液,奈诺沙星对该菌株的最低抑菌浓度(MIC)为32 mg/ L。
1.1.5 仪器与软件 LSR II流式细胞仪为BD公司产品;流式细胞结果分析采用美国TreeStar公司FlowJo软件。Western blot凝胶成像采用美国Bio-Rad公司凝胶成像仪。
1.2 方法
1.2.1 流式细胞技术检测奈诺沙星对小鼠脾脏免疫细胞的作用
1.2.1.1 LPS诱导小鼠内毒素血症、奈诺沙星干预及分离小鼠脾脏免疫细胞 15只小鼠随机分为3组,每组5只:组1为正常对照组;组2为LPS组,在实验当日每只小鼠腹腔注射5 mg/kg LPS 200 μL,2 h后腹腔注射0.9%NaCl溶液200 μL;组3为LPS+奈诺沙星组,每只小鼠腹腔注射5 mg/kg LPS 200 μL,2 h后腹腔注射奈诺沙星40 mg/kg。6 h后统一处死3组小鼠。解剖小鼠,取出小鼠脾脏,迅速浸泡在PBS缓冲液中,用注射器的活塞研磨成单细胞,并通过尼龙网过滤成单细胞悬液。在4 ℃下300~400 g离心4~5 min,除去上清液,最后加入红细胞裂解液1 mL裂解红细胞,作为小鼠脾脏细胞悬液。
1.2.1.2 流式细胞技术检测小鼠脾脏巨噬细胞、中性粒细胞和树突状细胞的绝对计数 取上述3组小鼠脾脏细胞悬液20 μL,加入PBS缓冲液380 μL,采用细胞计数板在电子显微镜下计数。在每个流式检测管分别加入50 μL细胞悬液(稀释到约106/ mL),并轻轻混匀,加入10 mg/L的封闭抗体anti-CD16/CD32,封闭10 min,再加入带有太平洋蓝-PE、FITC、APC等荧光标记的CD11b、CD11c、 F4/80、 Ly6G结合抗体冰浴下染色孵育20 min。孵育完成后,加入FACS缓冲液(每流式检测管中加2 mL) 4 ℃下300~400 g离心5 min,弃去上清液,重复洗涤过程3次,重悬细胞后上流式细胞仪检测。数据采用FlowJo软件分析。采用流式细胞技术检测小鼠脾脏髓样细胞亚群如巨噬细胞[CD11b (+)、CD11c (-)、F4/80 (+)]、中性粒细胞[CD11b (+)、CD11c (-)、Ly6G (+)]和树突状细胞[CD11c (+)]等细胞的绝对计数,之后对3组小鼠进行比较。
1.2.2 巨噬细胞RAW264.7培养与吞噬肺炎克雷伯菌试验 自-80 ℃冰箱中取出RAW264.7细胞,加入含10%胎牛血清的DMEM高糖培养基(含青霉素、链霉素双抗),在37 ℃、5% CO2培养箱中培育至生长约80%传代,取4~5 代生长状态良好的细胞,以约105/mL的密度接种于24孔板中培育至约80%进行巨噬细胞吞噬肺炎克雷伯菌试验。在实验当天吸去细胞培养基随即放入新鲜的无血清DMEM高糖培养液后孵育2 h,然后按不同组别加入奈诺沙星、肺炎克雷伯菌进行孵育。实验分为2组:组1为奈诺沙星+肺炎克雷伯菌组,先将800 mg/L奈诺沙星溶液10 μL加入1 mL细胞培养基(奈诺沙星用无菌蒸馏水配制,奈诺沙星终浓度为8 mg/L),2 h后再加入3×108CFU/mL的肺炎克雷伯菌菌液10 μL(肺炎克雷伯菌终浓度为3×106CFU/mL)继续培养;组2为肺炎克雷伯菌对照组,不加奈诺沙星,但与组1同时加入肺炎克雷伯菌菌液。加入菌液后巨噬细胞吞噬2 h,接着吸取上清液,并用PBS多次清洗,收集所有上清液,经稀释涂LB平皿,培养过夜后LB平皿菌落计数,统计胞外菌数量;另外此24孔板中每孔再次加入无菌蒸馏水1 mL,由于渗透压不同,巨噬细胞会裂解并释放出吞噬的肺炎克雷伯菌,故裂解细胞2 h后收集所有上清液,经稀释涂LB平皿,培养过夜后再次行LB平皿菌落计数,研究奈诺沙星干预后RAW264.7细胞吞噬肺炎克雷伯菌差异。
1.2.3 奈诺沙星对LPS诱导巨噬细胞分泌细胞因子的相关信号转导通路试验 同1.2.2方法培养RAW264.7细胞,以5×105/mL的密度接种于12孔板中培育至约80%进行LPS诱导炎性反应。在实验当天吸去细胞培养基随即放入新鲜的无血清DMEM培养基后孵育2 h,然后按不同组别加入奈诺沙星、LPS进行孵育。实验分为3组:组1为奈诺沙星+LPS组,先将400 mg/L的奈诺沙星溶液20 μL加入2 mL细胞培养基(奈诺沙星用无菌蒸馏水配制,奈诺沙星终浓度为4 mg/L),2 h后再加入1 mg/ L的LPS 20 μL(LPS终浓度为10 μg/L)继续培养;组2为LPS组,不加奈诺沙星,但与组1同时加入LPS;组3为空白对照组,不加奈诺沙星和LPS。巨噬细胞裂解液抽提蛋白后,根据BCA蛋白浓度检测试剂盒测定的蛋白浓度。取出部分蛋白,加入RIPA缓冲液和SDS,制备成20 μL备孔的蛋白样品,100 ℃加热10 min后冰浴,接着点样至10% SDS聚丙烯酰胺胶,经电泳及电转膜后,蛋白转移至PVDF膜上,PVDF膜采用含5%无脂牛奶的TBST(含0.1%吐温的TBS溶液)封闭1 h,后采用TBST溶液洗涤3次,与磷酸化p38 MAPK抗体 (p-p38抗体,1∶2 000 稀释)、磷酸化 ERK1/2抗体 (p-ERK1/2抗体,1∶2 000稀释)、磷酸化JNK1抗体(p-JNK1抗体,1∶1 000稀释)、p-100抗体(1∶1 000 稀释)、对照为β-actin抗体在4 ℃共孵育过夜。采用TBST洗涤3次,加入二抗后室温振摇2 h后,再次采用TBST洗涤3次,每张膜加入ECL prime显色溶液,采用Bio-Rad凝胶成像系统检测相关条带。
1.2.4 统计学处理 采用GraphPad Prism 5.0 进行作图和分析。实验数据计量资料均以均数±标准差表示,两组之间计量数据的比较采用t检验。
2 结果
2.1 奈诺沙星对小鼠脾脏免疫细胞数量的调控作用
采用LPS(5 mg/kg)诱导小鼠内毒素血症,通过电子显微镜计数正常对照组、LPS组、LPS+奈诺沙星组3组小鼠的脾脏免疫细胞,图1A示流式细胞分选过程,结果显示3组小鼠脾脏免疫细胞总数不同(图1B),正常对照组、LPS组、LPS+奈诺沙星组小鼠的脾脏免疫细胞总数分别为(1.84±0.13)×108/L、(6.40±1.06)×108/L 、(2.87±0.25)×108/L,即LPS组小鼠脾脏免疫细胞数最高,平均值是正常小鼠的3.5倍,LPS+奈诺沙星组小鼠免疫细胞均值也较正常小鼠高,是正常小鼠的1.6倍,但明显低于LPS组(降低55.1%),LPS组与LPS+奈诺沙星组的差异有统计学意义(P=0.012),提示LPS能引起小鼠炎性反应,小鼠脾脏内免疫细胞数量明显增多,而奈诺沙星可以抑制免疫细胞的数量增多,即抑制炎性反应。图1C示3组小鼠脾脏中巨噬细胞数量,结果显示对照组、LPS组、LPS+奈诺沙星组小鼠脾脏巨噬细胞数量分别为(5.47±0.15)×105/L、(3.25±0.68)×106/L、(1.20±0.06)×106/L,
LPS组巨噬细胞数量仍为最高,均数值是正常小鼠的5.9倍,LPS+奈诺沙星组小鼠巨噬细胞数量均值较正常小鼠有升高,是正常小鼠的2.2倍,但明显低于LPS组(降低63.1%),LPS组与LPS+奈诺沙星组组间差异有统计学意义(P=0.017)。图1D示3组小鼠中性粒细胞数量,对照组、LPS组和LPS+奈诺沙星组分别为(6.67±0.11)×105/ L、(5.46±1.77)×106/ L和(5.13±0.96)×106/L, LPS与LPS+奈诺沙星两组小鼠中性粒细胞数量比较差异无统计学意义。图1E示3组小鼠树突状细胞数量,对照组、LPS组和LPS+奈诺沙星组分别为(4.86±0.11)×106/L、(2.76±1.20)×107/ L和(9.36±1.63)×106/L, LPS+奈诺沙星组小鼠树突状细胞均值较LPS组也明显降低(降低66.1%),且差异有统计学意义(P=0.01),这一结果提示当LPS引起小鼠炎性反应时,小鼠脾脏中的各种免疫细胞数量会明显上升,而奈诺沙星对于小鼠脾脏中免疫细胞数量增加有明显抑制作用,且奈诺沙星的抑制作用有特异性,主要作用于巨噬细胞和树突状细胞,对中性粒细胞基本无抑制作用。

图1 流式细胞技术检测小鼠脾脏免疫细胞数量Figure 1 Population of immune cells in spleen by flow cytometry
2.2 奈诺沙星对巨噬细胞RAW264.7吞噬肺炎克雷伯菌的影响
巨噬细胞RAW264.7吞噬肺炎克雷伯菌试验中,加入无菌蒸馏水后2 h由于渗透压不同,巨噬细胞会裂解并释放出吞噬的肺炎克雷伯菌,检测有无奈诺沙星干预的两组胞内菌菌落计数,各组均检测了6个巨噬细胞样本,结果如图2所示。其中奈诺沙星+肺炎克雷伯菌组胞内菌计数为(4.12±2.10)×103CFU/mL,而肺炎克雷伯菌组胞内菌计数为(2.08±1.09)×103CFU/mL,奈诺沙星+肺炎克雷伯菌组菌落计数均数是肺炎克雷伯菌组的2.0倍,两组之间差异有统计学意义(P=0.047),结果显示当奈诺沙星存在时,巨噬细胞RAW264.7吞噬入胞内的肺炎克雷伯菌数量增加1.0倍,提示奈诺沙星可以提高巨噬细胞的细菌吞噬能力。
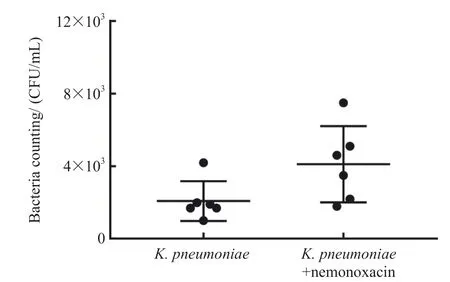
图2 奈诺沙星+肺炎克雷伯菌组和肺炎克雷伯菌组巨噬细胞吞噬细菌计数Figure 2 Count of the bacteria engulfed by macrophages after treatment with nemonoxacin + K. pneumoniae or K. pneumoniae alone
2.3 奈诺沙星对LPS诱导巨噬细胞分泌细胞因子的信号转导通路调控作用
采用Western blot方法研究奈诺沙星对IL-6、TNF-α的抑制作用主要依赖于MAPK还是NF-κB信号转导通路途径,结果见图3。本试验采用LPS诱导巨噬细胞炎性反应模型,加以奈诺沙星干预后,检测MAPK通路的p-p38 MAPK、p-JNK1、ERK1/2,NF-κB信号转导通路的p-100蛋白表达水平。Western blot结果显示对于p-p38 MAPK的表达,在LPS作用后3 h,LPS组与LPS+奈诺沙星组p-p38 MAPK表达水平类似,而在LPS作用后6 h,LPS组表达水平明显较LPS+奈诺沙星为强,在12 h两组又基本相同;对于p-JNK1,LPS作用后3 h,LPS组与LPS+奈诺沙星组p-JNK1表达水平类似,而在LPS作用后6 h,LPS组表达水平明显较LPS+奈诺沙星为强,在12 h,LPS组较LPS+奈诺沙星组p-JNK1表达水平仍高,但两组差异变小;对于MAPK通路的另一家族成员ERK1/2,LPS作用后3、6、12 h,LPS组与LPS+奈诺沙星组ERK1/2的表达水平基本相同;检测 NF-κB其p-52亚基的前体形式p-100,LPS作用后3、6、12 h,LPS组与LPS+奈诺沙星组p-100的表达水平基本相同。提示奈诺沙星对IL-6、TNF-α的抑制作用主要还是依赖于MAPK信号转导通路途径,奈诺沙星可能通过抑制p-p38 MAPK、p-JNK1的表达,进而抑制IL-6等促炎性细胞因子的表达,从而抑制LPS诱导巨噬细胞的炎性反应。奈诺沙星在LPS诱导巨噬细胞炎性反应时,抑制NF-κB表达的作用不强,推测NF-κB不是奈诺沙星抑制巨噬细胞炎性反应依赖的信号转导通路途径。

图3 Western blot方法检测信号转导通路Figure 3 Western blot assay of signal transduction pathways
3 讨论
奈诺沙星是一种新型无氟喹诺酮类抗菌药物,具有良好的抗菌活性,在临床上得以广泛应用[9]。本课题组前期的研究已经发现,奈诺沙星具有一定的免疫介导作用,体内、体外试验均显示奈诺沙星对LPS诱导的炎性反应有抑制作用,表现为抑制IL-6、TNF-α等促炎因子的分泌,促进IL-10等抑炎因子的分泌;并且奈诺沙星能降低LPS诱导的内毒素血症小鼠的病死率,保护作用达60%[8]。但以上前期实验仅仅是研究奈诺沙星免疫调控作用的初步试验,即药物对细胞因子的作用。但奈诺沙星是否对巨噬细胞、中性粒细胞具有特异性免疫抑制作用,是否能增强巨噬细胞的吞噬能力,以及奈诺沙星抑制IL-6等促炎细胞因子是否依赖于MAPK或NF-κB信号转导通路途径未见相关研究报道,课题组就以上问题进行了深入研究。
本研究采用流式细胞技术检测LPS组和LPS+奈诺沙星组小鼠脾脏髓样细胞亚群,结果发现小鼠腹腔注射LPS后,会诱导炎性反应,处死小鼠后分离小鼠脾脏免疫细胞,可以看到无论免疫细胞总量、巨噬细胞、中性粒细胞、树突状细胞都较正常小鼠有明显上升,达到正常小鼠的3.6~8.2倍,而LPS+奈诺沙星组以上免疫细胞数量较正常小鼠有所上升,但免疫细胞总量、巨噬细胞和树突状细胞数量较LPS组有明显降低,其中免疫细胞总量下降55.1%,巨噬细胞数量下降63.1%,树突状细胞数量下降66.1%,而中性粒细胞数量两组相仿,无明显差异。这一结果提示奈诺沙星能够抑制LPS诱导小鼠的炎性反应,且能够抑制小鼠脾脏中与炎性相关的免疫细胞数量上升,但此种免疫抑制作用有特异性,即奈诺沙星特异性地抑制小鼠脾脏中巨噬细胞和树突状细胞的数量,而对中性粒细胞基本无抑制作用,但奈诺沙星的抑制作用是抑制髓样细胞亚群的增殖还是减少趋化因子的分泌、抑制免疫细胞在脾脏等炎症部位的聚集需要进一步研究证实。
本研究通过体外试验检测了奈诺沙星对巨噬细胞RAW264.7吞噬肺炎克雷伯菌功能的影响,结果显示8 mg/L奈诺沙星可以提高巨噬细胞RAW264.7吞噬肺炎克雷伯菌的能力,加入奈诺沙星2 h后,巨噬细胞吞噬入胞内的肺炎克雷伯菌数量增加1.0倍,这一结果提示奈诺沙星可提高巨噬细胞的吞噬能力。其他氟喹诺酮类药物也有类似的研究结果,如采用0.5 MIC加替沙星对小鼠腹腔巨噬细胞预处理,该药能显著增强巨噬细胞的吞噬并提高细胞内杀菌能力。半体内试验即小鼠静脉给加替沙星20 mg/kg,收集腹腔巨噬细胞体外测定对细菌的吞噬作用,结果表明也有增强作用 [10]。
本课题组既往研究结果提示奈诺沙星对LPS诱导的炎性反应有抑制作用,表现为抑制IL-6的分泌[8],相关研究显示与IL-6相关的信号转导通路主要为LPS与炎性细胞表面受体结合后,通过Toll样受体4(TLR4),激活IL-1受体连接的蛋白激酶(IRAK),从而激活MAPK或NF-κB信号转导通路[11-12],其中MAPK信号转导通路又包括ERK、JNK和p-38 MAPK等蛋白[13]。本研究仍采用LPS诱导巨噬细胞炎性反应,通过Western blot方法检测奈诺沙星+LPS及LPS组 ERK、JNK、p-38 MAPK以及NF-κB等蛋白的表达,结果显示奈诺沙星主要抑制p-p38 MAPK、p-JNK的表达,对JNK及NF-κB抑制作用不强,推测p-p38 MAPK、p-JNK是奈诺沙星抑制LPS诱导的炎性反应主要依赖的信号转导通路途径而非NF-κB。国外相关报道显示其他氟喹诺酮类抗菌药物对信号转导通路的调控作用与奈诺沙星不同[14],如莫西沙星既通过抑制NF-κB的活性起到抗炎效应,也能抑制LPS刺激后引起的ERKl/2、p-JNKl/2的活性增强[15],这与奈诺沙星明显不同。
以上研究结果是在前期研究基础上更加深入地研究了奈诺沙星的免疫调控作用机制,结果提示奈诺沙星能够抑制小鼠脾脏中与炎性相关的免疫细胞数量上升,同时可以显著提高巨噬细胞对细菌的吞噬功能,这将可能有助于重症感染性疾病患者免疫功能的改善,并提高疾病治疗的有效率和治愈率,降低宿主的病死率。应在动物实验及临床研究中进一步验证奈诺沙星对感染炎性反应的免疫调节作用的获益。

