热处理对糖基化大豆蛋白乳液冻融稳定性的影响
王喜波 周国卫 王小丹 王 琳 张安琪 王玉莹
(东北农业大学食品学院, 哈尔滨 150030)
0 引言
大豆分离蛋白是一种优良的植物蛋白,不仅含有许多人体必需的氨基酸,还具有保水性、凝胶性等功能性质。此外,大豆分离蛋白中还含有具有表面活性的7 S和11 S组分,所以蛋白质还具有亲水亲油性,在食品乳液中被广泛用作乳化剂[1]。为了保持食品乳液的化学稳定性、延长乳液的保质期,冷冻储存成为最重要的保存方法之一。然而,大部分水包油乳液在冷冻后非常不稳定,导致乳液出现聚结、乳析、相分离等现象,所以提高乳液的冻融稳定性很有必要。
目前,通过糖基化以及糖基化协同酶解改性来提高蛋白的冻融稳定性多有报道。文献[2]用β-乳球蛋白和葡聚糖生成共价接枝物,并制成乳液,观察室温下乳液粒径随储存时间的变化。结果显示,随着时间的延长,用未改性β-乳球蛋白制成的乳液液滴增大,而改性蛋白的乳液液滴并未发生显著变化,说明接枝物能够提高乳液的稳定性。文献[3]在研究乳清分离蛋白-葡聚糖接枝产物功能性质时发现,接枝物在水包油乳液中能够快速、更为紧密地吸附在油-水界面上,在油滴表面形成较厚的界面膜,提高了乳清分离蛋白的乳化性能,并且能够显著提高乳液的冻融稳定性。文献[4]研究了糖基化协同酶解改性对大豆分离蛋白乳液冻融稳定性的影响,指出SPH3-D乳液经3次冻融循环后的乳液粒径最小,表明SPH3-D乳液具有最好的冻融稳定性。但是不同温度处理下乳液对糖基化蛋白乳液冻融稳定性的研究却鲜有报道。
经限制性酶解后蛋白结构展开,酶解产物再与多糖发生糖基化反应,能够显著增强蛋白质的界面性质、乳化性质以及抗氧化活性[5-6],而湿法糖基化又使蛋白质和多糖之间的接触最大化,并在反应前省去了耗能、耗时的冷冻干燥步骤[7-8]。本文通过湿法糖基化和限制性酶解后糖基化来制备产物,探究温度对乳液冻融稳定性的影响,以研究外界环境对乳状液的影响,初步探究其冻融机理,拓宽大豆蛋白在食品领域的应用范围。
1 材料与方法
1.1 材料与试剂
低温脱脂豆粉,山东禹王实业有限公司;葡聚糖,国药集团化学试剂有限公司;考马斯亮蓝R250,Schiff试剂,北京索莱宝科技有限公司;十二烷基磺酸钠(SDS),北京博奥拓达科技有限公司;胰蛋白酶,Sigma公司;5×蛋白上样缓冲液,北京博奥拓达科技有限公司;大豆油,九三粮油工业集团有限公司;溴酚蓝,北京索莱宝科技有限公司;其他化学试剂均为分析纯。
1.2 主要仪器设备
T18 Basic型高速分散机/匀浆机,德国IKA公司;AVP-2000型高压均质机,英国Stansted Fluid Power公司;EPS 601型胶电泳仪,美国伯乐公司;Mastersizer 2000S型激光粒度分析仪,英国Malvern公司;U-1800型紫外可见分光光度计,北京普析通用仪器有限责任公司;Olympus UIS2型光学显微镜,日本Olympus公司。
1.3 试验方法
1.3.1大豆分离蛋白的制备
根据文献[9],改进方法制备SPI(大豆分离蛋白)。将低温脱脂大豆粉(200 g)按液料比10 mL/g溶于去离子水中,并用2.0 mol/L NaOH将其pH值调节至8.5,搅拌2 h。然后将悬浮液在4℃下以4 000g离心20 min以除去不溶物质。随后,使用2.0 mol/L HCl将上清液的pH值调节至4.5,静置2 h(4℃)后继续在4℃下以4 000g离心15 min收集沉淀物,沉淀物用去离子水洗涤两次并重新溶解在去离子中,并用2.0 mol/L NaOH将混合物的pH值调节至7.0,并透析(4℃)24 h。最后将SPI溶液冻干。
1.3.2SPH及SPI-D、SPH-D糖基化产物的制备
根据文献[10],通过pH-stat法测定水解度。将SPI(2 g/(100 mL))分散在10 mmol/L PBS(磷酸盐缓冲液)(pH值8.0)中并搅拌2 h。随后,加入胰蛋白酶(0.25 g/(100 mL)),将分散体在37℃下恒温搅拌200 min后[4],95℃加热10 min灭酶,获得水解度为3%的SPH(大豆分离蛋白水解物),将其冷冻干燥得到SPH固体,冷冻储存备用。
将SPI(4 g/(100 mL))和葡聚糖(40 ku)按质量比为1∶3、SPH(4 g/(100 mL))和葡聚糖(40 ku)按质量比为2∶3的比例溶解于10 mmol/L磷酸缓冲溶液(pH值8.0)中并搅拌4 h[11],然后冷藏12 h。随后,将SPI和葡聚糖混合物在95℃恒温水浴中加热4 h、SPH和葡聚糖混合物在85℃水浴中加热1 h,反应结束后在冰浴中冷却至室温(20℃),通过冷冻干燥获得样品并在-20℃下储存。
1.3.3聚丙烯酰胺凝胶电泳分析
根据文献[12]的方法并稍加修改进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试验。用10 mmol/L pH值8.0的磷酸缓冲溶液将样品稀释为5 mg/mL,并与5×SDS上样缓冲液按体积比4∶1混合,沸水浴5 min后冷却,并取7 μL注入到每个样孔中。设定浓缩胶中的电压为90 V,分离胶中的电压为120 V。当溴酚蓝距离凝胶底部边缘约1 cm时,关闭电源,电泳结束,起胶。
蛋白染色:电泳结束后,将凝胶条放置在考马斯亮蓝染色液中染色12 h,之后用脱色液洗脱3~4次,直至凝胶中出现清晰的蓝色条带。
糖染色:电泳结束后,将凝胶条放入过碘酸溶液中氧化处理12 h,之后用冰醋酸-三氯乙酸溶液漂洗3~4次(每次2 h)。然后将漂洗后的凝胶条放置在Schiff试剂中避光染色16 h后再用5%的醋酸溶液浸泡,直至观察到粉色的糖蛋白条带。
1.3.4乳液制备
根据文献[13],将大豆油与1%蛋白质分散体混合以制备水包油乳液(溶液与大豆油的体积比调节至9∶1)。通过在高速搅拌器中以10 000 r/min均质1 min来制备粗乳液。然后用高压均质机在40 MPa下处理1次得到乳液。
1.3.5冻融循环
将新鲜制备乳液的pH值调为7.0并放入玻璃试剂瓶中,加盖密封,在不同温度下加热(30、50、70、90℃)30 min,冷却至室温。将乳液转移到25 mL具塞试管中,在-20℃冷冻储存22 h后置于25℃的恒温水浴中解冻2 h[14],然后评估蛋白质乳液的冻融稳定性,样品经历3次冻融循环。
1.3.6粒径测定
使用Mastersizer 2000S型激光粒度分析仪测量新鲜和冻融乳液中液滴的平均粒径。设定分散相折射率和吸附率分别为1.460和0.001,连续相折射率为1.330[15]。将样品适当稀释后,测定体积平均粒径D4,3。
1.3.7聚结程度测定
根据文献[16]的方法,使用体积平均粒径计算聚结程度,公式为
(1)
式中D4,3f——冻融后乳液的体积平均粒径
D4,3i——初始乳液的体积平均粒径
还有一部分是从拟声词转换而来的AA式重叠动词,如:嘚嘚、叭叭、叨叨、吵吵、哼哼、嘎嘎、记记、咧咧、曲曲、嗡嗡、囔囔等。从感情色彩来看,动词重叠AA式多数是表示贬义的。
1.3.8出油率测定
参照文献[17]的方法略加改动。称取0.015 g苏丹Ⅲ试剂加入到1 000 g大豆油中,室温搅拌12 h得到苏丹Ⅲ油溶液。准确称取4 g苏丹Ⅲ油溶液和16 g待测乳液于50 mL离心管中,振荡混匀,以16 000g、4℃离心20 min,收集上层油液于508 nm处测定吸光度,同时以大豆油做空白。出油率计算公式为
(2)
式中m0——染料溶液的质量,g
a——离心前后染料吸光度的比值
me——乳液的质量,g
φd——油体积分数,%
1.3.9乳析指数测定
经冻融处理后,乳液会分离成顶部的不透明的“乳油”层和底部的透明(或混浊)“血清”层。参照文献[18]的方法,乳析指数计算公式为
(3)
Ht——乳液总高度,cm
1.3.10光学显微镜分析
在分析之前振荡乳液以确保混合均匀。取20 μL乳液置于显微镜载玻片,然后盖上盖玻片,并通过Olympus UIS2型光学显微镜观察乳液的微观结构。
1.4 数据处理
使用SPSS Statistics 19统计软件进行数据的处理与分析(ANOVA),并采用Duncan检验(显著性水平P<0.05),所有试验重复3次,数据表示为平均值±标准偏差。所有的图都使用Origin 8.6软件制图。
2 结果与讨论
2.1 SDS-PAGE分析
SDS-PAGE证实了蛋白质与葡聚糖在美拉德反应过程中发生了共价结合。如图1所示,泳道1为Marker,泳道2为SPI对照样品,在分离胶顶部没有新的条带出现,而泳道3(SPI-D)和泳道4(SPH-D)在分离胶的顶端区域颜色变深,说明蛋白质-葡聚糖共价结合发生,产生更高分子量的物质,从而导致其在分离胶顶部积累[19]。另外,SPI-D相较于SPH-D在分离胶顶部附近的颜色较深,说明相同分子质量下SPI-D比SPH-D数量多。
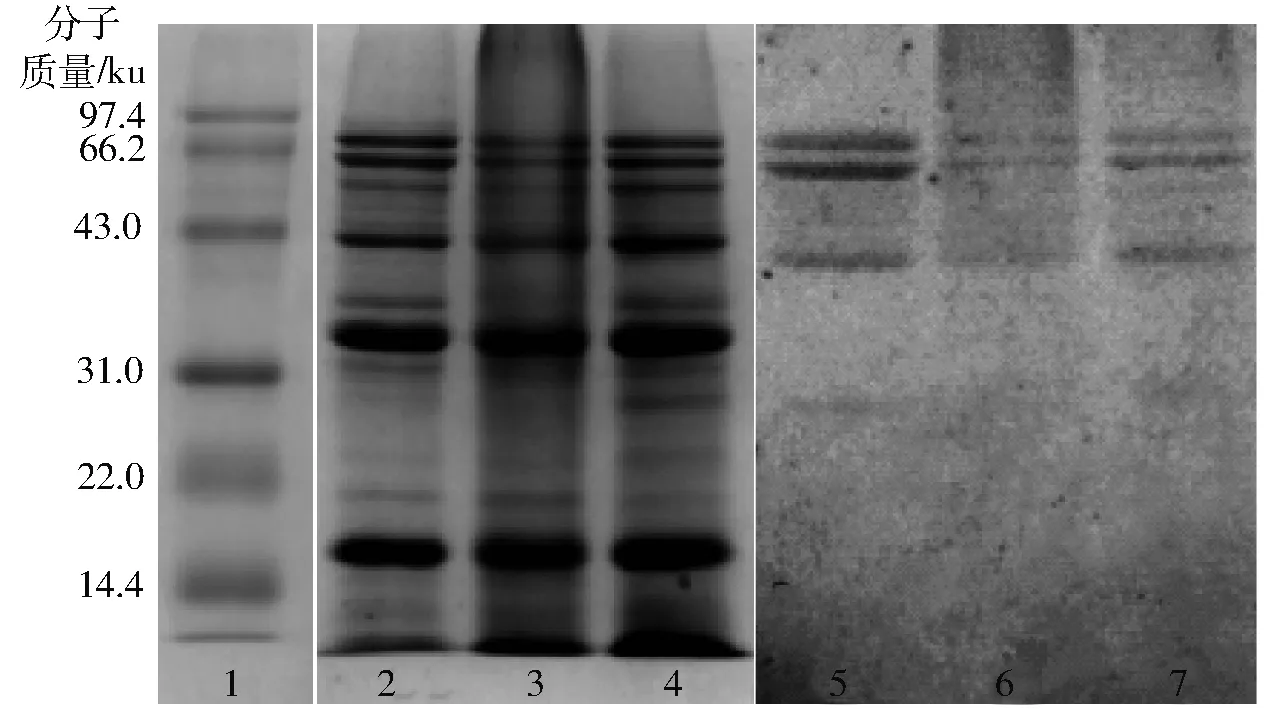
图1 SPI、SPI-D和SPH-D的SDS-PAGEFig.1 SDS-PAGE of SPI, SPI-D and SPH-D
糖染色可以进一步证实糖基化反应的发生,其中,泳道5是SPI的糖染色条带,与泳道2一致,没有新条带出现,而泳道6、7分别是SPI-D和SPH-D的糖染色条带,泳道6、7显示在分离胶顶部有糖染色条带出现,与泳道3、4条带一致,表明蛋白质和葡聚糖发生糖基化反应生成共价结合物。这与文献[20-21]结果相似,蛋白质和多糖的糖基化反应导致在分离胶顶部出现高分子条带。SDS-PAGE证实了蛋白和葡聚糖发生糖基化反应。
2.2 温度对SPI、SPI-D和SPH-D乳液粒径的影响
蛋白质乳液的平均液滴尺寸与乳液的稳定性相关,一般粒径越小,乳液越稳定。通常,体积平均粒径D4,3可以用来表征乳液中大的液滴聚集[22]。图2(图中不同字母表示相同图例、不同温度条件下具有显著性差异,下同)为温度对样品乳液冻融前后体积平均粒径的影响。从图中可以看出,乳液经过加热处理后,初始乳液的粒径随着温度的增加总体呈增加的趋势,这可能是乳液经过热处理,液滴之间剧烈运动,液滴相互碰撞机会增加,导致乳液聚集,粒径变大,还有可能是热处理引起蛋白变性,结构展开,疏水基团暴露,从而促进蛋白质分子通过疏水相互作用相互聚集,导致粒径变大[23]。在冻融后,SPI-D和SPH-D乳液的粒径比SPI的小,说明葡聚糖链的接入改善了蛋白的冻融稳定性,这可能是由于多糖的加入具有增稠作用,使得蛋白质分子处在一个相对稳定的状态,糖基化反应后,蛋白分子会迅速吸附在油滴表面形成界面膜,这可以防止部分液滴聚结[2],SPH-D乳液经过3次冻融循环后粒径仍相对较小,这可能是因为SPI水解后又暴露了更多的疏水基团并产生一些具有表面活性的多肽[24],与多糖结合后具有更好的界面性质,乳液稳定性提高,这与文献[4]的研究结果一致。并且热处理后的乳液经过冻融循环后具有更小的粒径,说明热处理后乳液的冻融稳定性得到改善。在50℃时,3次冻融循环后SPI、SPI-D和SPH-D粒径分别降低了47.52、27.25、22.96 μm,这说明了对乳液进行热处理可提高乳液的冻融稳定性,原因可能是热处理后蛋白分子之间相互聚集增强了凝胶网络结构,提高了乳液的冻融稳定性,但温度过高又会导致乳液粒径增大。
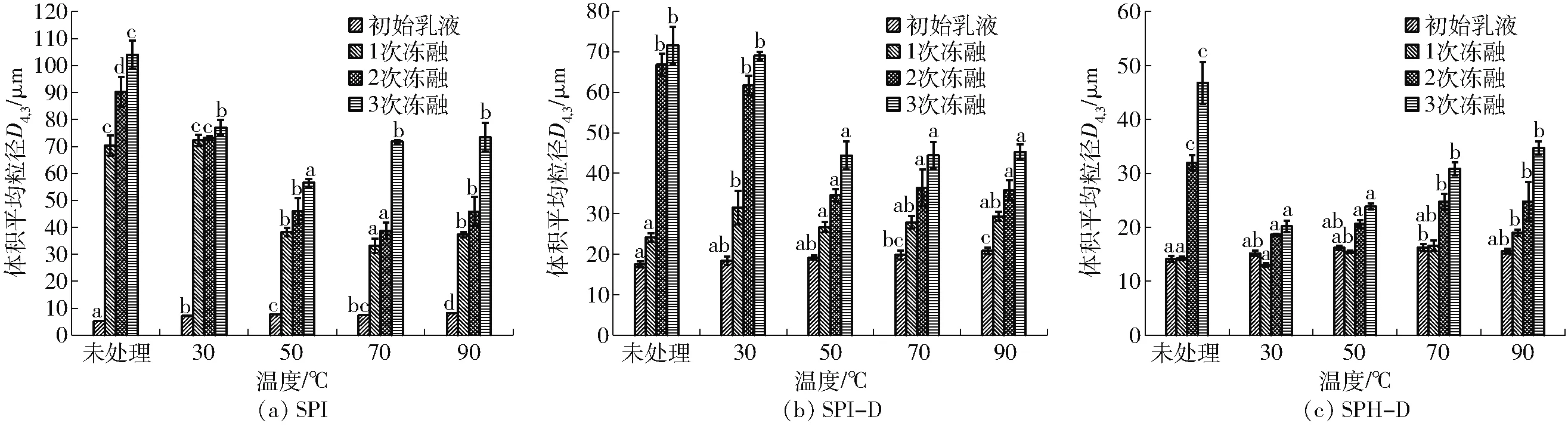
图2 温度对SPI、SPI-D和SPH-D乳液体积平均粒径的影响Fig.2 Effects of temperature on volume average particle size of SPI, SPI-D and SPH-D emulsions
2.3 温度对SPI、SPI-D和SPH-D乳液聚结程度的影响
乳液在冻融循环过程中,尖锐的冰晶会刺破油-水界面膜,造成液滴之间发生聚结现象,使得乳液不稳定。聚结程度C可作为判断乳液冻融稳定性的一个指标。温度对SPI、SPI-D和SPH-D乳液聚结程度的影响如图3所示。从图中可以看出,冻融循环后的乳液的聚集程度不断增大。但是相对于未改性的SPI,SPI-D和SPH-D乳液的聚集程度稍低一些。这可能是由两方面原因造成,一方面多糖的加入能够减少冷冻过程中冰晶形成的量,使得未冻结水的量和水相的粘度增加,减少油滴的运动,并在油滴周围形成界面层,降低液滴的聚结[25-28];另一方面大分子量球蛋白被水解成相对较小分子量的肽段,改变了其空间结构,使其柔性增加,有助于形成良好的界面膜,有效抑制了液滴的聚结[29]。并且对乳液进行热处理后,通过数据分析表明热处理对乳液的聚结有一定的影响,随着温度的增加,乳液的聚结程度呈降低的趋势,3次冻融循环后,SPI的聚结程度从未处理的3 403.90%降低到90℃处理的348.75%,SPI-D从1 181.49%降低到191.59%,SPH-D从806.17%降低到138.73%,这些数据表明热处理对乳液的聚结有很好的抑制作用,这可能是由于热处理导致吸附在同一或不同液滴上的蛋白分子相互交联,使得液滴界面膜更加紧密,凝胶网络结构增强,乳液的抗聚结能力增强。在改性淀粉稳定的乳液中也有类似的现象被报道[30-31]。这些结果表明SPI-D和SPH-D的聚结程度在热处理后降低,这可能是因为亲水性多糖链的接入形成更大的聚合物,吸附在油滴表面提供良好的空间稳定性[32],经过热处理后形成致密的界面膜,提高了乳液的抗聚结能力。
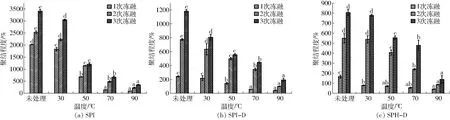
图3 温度对SPI、SPI-D和SPH-D乳液聚结程度的影响Fig.3 Effects of temperature on coalescence degree of SPI, SPI-D and SPH-D emulsions
2.4 温度对SPI、SPI-D和SPH-D乳液出油率的影响
乳液经过冻融,乳化态脂肪会变为游离的脂肪分布在乳液的顶层,因此,可以通过测量游离脂肪来判断乳液的冻融稳定性。一般出油率越小,乳液越稳定[33]。图4为温度对SPI、SPI-D和SPH-D出油率的影响。从图中可以看出,在未热处理的情况下,乳液的冻融稳定性较差。冻融循环3次后SPI、SPI-D和SPH-D出油率分别达到了23.33%、14.33%和10.23%,由此可以看出,SPI-D和SPH-D的出油率显著低于未改性SPI,文献[34]也得出相似的结论,指出SPI乳液在经历冻融循环后出油率逐渐增大,而加入葡聚糖的蛋白具有较低出油率。这可能是由于蛋白质被糖基化后,提高了蛋白质的溶解度;同时葡聚糖的引入也产生空间位阻效应,使得结合物能够更为紧密地吸附在油-水界面上,形成致密的界面膜[3],有利于阻止油滴的析出。文献[4]也指出SPH-D共价复合物具有较好的乳化性,能够在油滴表面形成较厚的界面膜,可以阻止油滴聚集。如图4所示,当热处理后,乳液的出油率明显降低,随着温度的增加,乳液的出油率总体呈现降低的趋势,当温度达到90℃时,SPI、SPI-D和SPH-D乳液的出油率分别降低了62.53%、43.26%和42.62%,这可能是由于未吸附的蛋白质在乳液加热过程中与油滴界面的蛋白质分子发生热聚集作用,并继续吸附在油滴界面上,使得油滴周围界面膜厚度增加,改善了乳液的冻融稳定性[35],所以降低了冻融过程中的出油率。
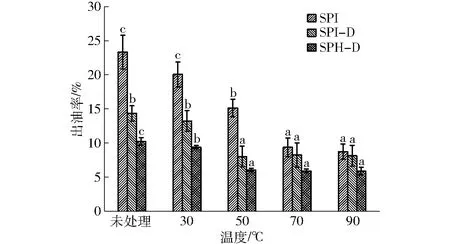
图4 温度对SPI、SPI-D和SPH-D 3次冻融循环后出油率的影响Fig.4 Effect of temperature on oil yield of SPI, SPI-D and SPH-D emulsions after three freeze-thaw cycles
2.5 温度对SPI、SPI-D和SPH-D乳液乳析指数的影响
未热处理的SPI乳液在3次冻融循环之后,乳液几乎完全破乳,乳析指数为73.92%,而SPI-D和SPH-D的乳析指数相对较低,分别为66.18%和60.66%,这与文献[36]得出的结论相类似,文献指出糖基化后的绿豆分离蛋白乳液经过3次冻融循环后仍具有较小的乳析指数。温度对SPI、SPI-D和SPH-D乳析指数的影响如图5所示,在冻融循环过程中,乳析指数呈现增加的趋势。热处理后,乳液的稳定性继续升高,当温度达到90℃时,SPI乳析指数降低了22.46%,表明热处理提高了乳液在冻融循环过程中的抗乳析稳定性,这是因为随着温度的升高,使得吸附在油滴上的SPI结构展开,疏水基团暴露,在疏水作用下,蛋白聚集形成致密的界面膜[35],使得乳液乳析指数变小。另外,SPI-D和SPH-D在热处理后乳析指数也呈现总体下降的趋势,但温度对乳析指数的影响不显著。
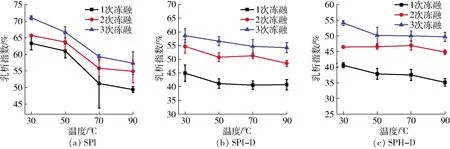
图5 温度对SPI、SPI-D和SPH-D乳液乳析指数的影响Fig.5 Effects of temperature on creaming index of SPI, SPI-D and SPH-D emulsions
2.6 蛋白乳液光学显微镜分析
分别在未热处理和温度为90℃处理时,观察冻融前后SPI、SPI-D和SPH-D乳液的微观结构。从图6可以看出在未加热处理时,3种样品初始乳液的液滴分布均匀,尺寸较小,微观结构没有明显差异。当温度达到90℃时,乳液出现聚集,说明热处理导致液滴之间发生交联反应。乳液经过冻融处理后,纯SPI 乳液中出现较大的油滴,这是因为未改性的SPI形成的界面膜较薄,抗冻融稳定性较差,而SPI-D和SPH-D在冻融循环后表现出较好的稳定性,产生的油滴较小,这可归因于多糖链的接入使得界面膜增强,这和本文2.4节研究结果一致。从冻融循环可以看出,未热处理的乳液出现较大的油滴,而热处理的3种乳液产生的油滴均较小,这可归因于热处理导致液滴交联,使得凝胶网络增强,界面膜变厚,更加致密,提高了乳液的冻融稳定性[35]。

图6 SPI、SPI-D和SPH-D乳液在未处理和90℃热处理后冻融循环前后的光学显微结构Fig.6 Optical microstructures of SPI, SPI-D and SPH-D after freeze-thaw cycle at different temperatures
3 结束语
以粒径、聚结程度、出油率和乳析指数为评价指标,研究不同温度处理对糖基化大豆蛋白乳液冻融稳定性的影响。研究发现,热处理后乳液的冻融稳定性提高。3次冻融循环后,热处理后的乳液粒径相对较小,乳液的聚结程度和出油率也降低,SPI的聚结程度从未处理的3 403.90%降低到90℃处理的348.75%,SPI-D从1 181.49%降低到191.59%,SPH-D从806.17%降低到138.73%,出油率也分别降低了62.53%、43.26%和42.62%。随着温度(30~90℃)的升高,乳析指数呈降低的趋势。通过显微镜观察发现,未经热处理的乳液中经冻融循环后出现较大的油滴,而经90℃热处理后的3种乳液产生的油滴均较小,说明热处理可提高乳液的冻融稳定性。

