菠萝蜜果醋发酵菌种的选育及发酵特性
何宇宁,黄 和,2,*,钟赛意,刘 海,秦小明
(1.广东海洋大学食品科技学院,广东 湛江 524088;2.广东省亚热带果蔬加工科技创新中心,广东 湛江 524000)
菠萝蜜(Artocarpus heterophyllus Lam.),俗称大树菠萝,属于桑科、菠萝蜜属的常青乔木。菠萝蜜的果实柔软可口,香气扑鼻,是一种珍贵的热带水果[1]。研究表明,菠萝果肉营养丰富,富含碳水化合物、蛋白质、氨基酸、多酚、脂肪酸、维生素和矿物质,可作为一些重要营养物质的良好来源[2-3]。同时,菠萝蜜具有抗氧化、抗炎、抗菌、防龋、抗肿瘤和降血糖等多种生物活性[4-7]。目前菠萝蜜种植业面临的最大问题是其易腐性导致的巨大损失。因此,开发菠萝蜜新产品,为栽培者创造更高的收益,具有十分重要的现实意义[8]。菠萝蜜果实含有多种营养物质,其发酵产品也能很好的保存原有的风味和营养成分[9]。
醋酸菌是可将乙醇氧化生成乙酸的一类细菌[10],也是世界酿醋工业的重要微生物[11]。醋酸菌不仅广泛用于生产乙酸、葡萄糖酸、山梨酸以及合成必要的维生素如VC[12-14],还在生化反应糖类和乙醇氧化的研究中扮演重要角色[15-16]。关于菠萝蜜果醋发酵醋酸菌的选育研究相对较少,缺乏可参考数据。李文等[17]从猕猴桃中筛选出一株产酸量大和耐乙醇、耐高温能力强的醋酸菌,可使醋酸产量提升30.54%。陈洋等[18]从醋醅中筛选出菌株FY4,在高乙醇体积分数和高温状态下仍保持高产酸率,并成功用于热带水果的醋酸发酵。目前菠萝蜜果醋的研究鲜见报道,同时缺乏菠萝蜜果醋发酵的专用醋酸菌。
本研究通过菠萝蜜自然发酵与菌种三级筛选、生理生化鉴定、16S rRNA基因序列分析,筛选出适合菠萝蜜果醋发酵的醋酸菌;再通过发酵特性实验,比较选育的菌株与商业菌株As1.41在高乙醇体积分数和高温条件下的产酸能力。最终选育出菠萝蜜发酵果醋专用醋酸菌,提高菠萝蜜果醋产酸量和品质,为菠萝蜜果醋发酵提供优良菌种。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
菠萝蜜 广东湛江市麻章区湖光镇农贸市场;醋酸菌As1.41 中国工业微生物菌种保藏管理中心;安琪葡萄酒高活性干酵母 湖北安琪酵母股份有限公司。
葡萄糖、酵母膏、琼脂 广东环凯微生物科技有限公司;结晶紫染液、番红染液、碘液、95%乙醇、无水乙醇、酚酞指示剂、NaOH、CaCO3广东光华科技股份有限公司;Ezup柱式细菌基因组DNA提取试剂盒、San Prep柱式DNA胶回收试剂盒 生工生物工程(上海)股份有限公司;pUm-T载体试剂盒、dNTP 宝生物工程公司;GeneRuler DNA Ladder Mix Marker 赛默飞世尔科技有限公司。
1.1.2 培养基
基础培养基:葡萄糖1.0%,酵母膏1.0%,pH值自然,121 ℃灭菌20 min,冷却至70 ℃,加入体积分数4.0%无水乙醇;碳酸钙平板分离培养基:葡萄糖1.0%,酵母膏1.0%,CaCO32.0%、琼脂1.5%,pH值自然,121 ℃灭菌20 min,冷却至70 ℃,加入体积分数4.0%无水乙醇;斜面保藏培养基:葡萄糖1.0%,酵母膏1.0%,琼脂1.5%,pH值自然,121 ℃灭菌20 min,冷却至70 ℃,加入体积分数4.0%无水乙醇;发酵培养基:葡萄糖2.0%,酵母膏1.0%,pH值自然,121 ℃灭菌20 min,冷却至70 ℃,加入体积分数4.0%无水乙醇。
1.2 仪器与设备
SW-CJ净化工作台 苏州净化设备有限公司;722s紫外-可见分光光度计 上海精密科学仪器有限公司;DYY-5电泳仪 北京六一仪器厂;3-18K高速冷冻离心机德国Sigma公司;2720 Themalcyder聚合酶链式反应(polymerase chain reaction,PCR)仪 美国应用生物系统公司;AUY120电子天平 日本岛津制作所;SPX-250B-2生化培养箱 上海博讯实业有限公司医疗设备厂;HZQ-F160振荡培养箱 北京东联哈尔仪器制造有限公司;HH-6数显恒温水浴锅 国华电器有限公司。
1.3 方法
1.3.1 菠萝蜜果醋自然发酵醋醪制备
将新鲜菠萝蜜果肉洗净,匀浆后装入己灭菌500 mL锥形瓶中,用4 层纱布封口,置于实验室阴暗处,室温环境(25~30 ℃)自然发酵30 d,每隔5 d在无菌环境下取醋醪样品待测。
1.3.2 菠萝蜜果酒发酵液制备
参考张玲等[19]制备菠萝蜜果酒的方法。选取新鲜菠萝蜜,取果肉洗净后切碎,在护色剂中浸泡20 min,取出果肉按料液比1∶1.5(g/mL)加入蒸馏水后匀浆,加入0.1 g/L焦亚硫酸钠,混匀静置2 h,加入0.5 g/L果胶酶,在30 ℃酶解3 h。酶解后的菠萝蜜果浆用蔗糖调节糖度至200 mg/mL,用柠檬酸调节pH值至4.5,100 ℃灭菌7 min。待菠萝蜜果浆冷却后,以5%体积分数接入活化酵母菌,28 ℃发酵6 d后,65 ℃巴氏灭菌30 min。
1.3.3 醋酸菌的筛选
1.3.3.1 菌种一级筛选
采用平板涂布分离法,取1 mL醋醪样品稀释至10-4~10-6,将稀释液涂布在碳酸钙平板分离培养基上,每个稀释度进行2 个重复实验,在30 ℃培养箱中培养2~3 d后观察现象,挑选长势良好,溶钙圈大而清晰的单菌落,进行革兰氏染色镜检,筛选出革兰氏阴性菌。
1.3.3.2 菌种二级筛选
将一级筛选的菌株各取1 环,接种于100 mL基础培养基中,30 ℃、120 r/min振荡培养3 d,5 000 r/min离心10 min后取5 mL上清液用0.1 mol/L NaOH溶液中和至pH 7.0,煮沸后加入4~5 滴FeCl3溶液,有红褐色沉淀生成,表明为产醋酸细菌[20]。
1.3.3.3 菌种三级筛选
将二级筛选的菌株各取1 环,接种于100 mL菠萝蜜果酒中,30 ℃、120 r/min振荡培养5 d,对发酵液的香气进行感官评价。
1.3.4 醋酸菌生理生化实验
取筛选出的菌株和商业菌株As1.41进行生理生化实验[21]。
1.3.5 醋酸杆菌的分子生物学鉴定
1.3.5.1 基因组提取
按照Ezup柱式细菌基因组DNA提取试剂盒的说明书要求,提取筛选得到的5 株醋酸杆菌基因组DNA作为模板DNA。
1.3.5.2 PCR扩增
PCR引物:正向引物5’-CAGAGTTTGATCCTGGCT-3’,反向引物5’-AGGAGGTGATCCAGCCGCA-3’;PCR反应体系:模板DNA 1 μL,正向引物2 μL,反向引物2 μL,dNTP 2 μL,10×缓冲液5 μL,Taq(5 U/μL)0.5 μL,加入双蒸水调节至50 μL;PCR反应程序: 95 ℃预变性4 min;94 ℃变性30 s,58 ℃退火25 s,72 ℃延伸50 s,35 个循环。
1.3.5.3 PCR产物检测
取5 μL PCR产物在1.0%琼脂糖凝胶上进行电泳,电泳参数:150 V,100 mA,10~20 min,若胶体上形成清晰条带,则PCR扩增成功。
1.3.5.4 16S rRNA基因片段的测序及分析
委托生工生物工程(上海)股份有限公司进行测序工作。利用BLAST程序在NCBI数据库中进行同源性比对分析,选择与目标菌株有较高同源性的模式菌株[22],通过MEGA7.0软件构建系统发育树。
1.3.6 醋酸菌发酵性能实验
1.3.6.1 生长曲线测定
将筛选的醋酸杆菌各挑取1 环接种于100 mL基础培养基中,30 ℃、120 r/min振荡培养,每隔6 h用分光光度计在600 nm波长处测吸光度,以商业菌株As1.41为参照。
1.3.6.2 温度对发酵性能的影响
将筛选的醋酸杆菌活化后分别取1 mL接入100 mL菠萝蜜果酒发酵液中,乙醇体积分数4.0%,分别在25、28、31、34、37 ℃,120 r/min振荡培养96 h,测定醋酸杆菌产酸量、生长量、醇酸转化率,以商业菌株As1.41为参照。
1.3.6.3 乙醇对发酵性能的影响
将筛选的醋酸杆菌活化后分别取1 mL接入100 mL菠萝蜜果酒发酵液中,乙醇体积分数分别为2%、4%、6%、8%、10%,30 ℃、120 r/min振荡培养96 h,测定醋酸杆菌产酸量、生长量、醇酸转化率,以商业菌株As1.41为参照。
1.3.6.4 产酸量测定
参照GB/T 12456—2008《食品中总酸的测定》[23]方法进行测定。
1.3.6.5 醇酸转化率测定
参考孙一帆等[24]方法,计算公式如下:

1.4 数据处理
采用Microsoft Office Excel 2010软件进行数据处理和表格制作,采用Origin 2017软件进行数据图绘制,利用BLAST程序在NCBI数据库对16S rRNA测序结果进行同源性比对分析。每组实验重复3 次,取其平均值进行各数据统计分析。
2 结果与分析
2.1 醋酸菌筛选
2.1.1 一级筛选
由表1可知,经过72 h培养后有14 株菌有较小透明圈,31 株菌周围都有明显透明圈(图1)。对这31 株菌进行革兰氏染色镜检,均为革兰氏阴性菌(图2)。

表1 一级筛选结果Table 1 Results of primary screening

图1 平板培养基上菌落形态图Fig. 1 Colony morphology on medium plates

图2 菌株革兰氏染色镜检图(16×100)Fig. 2 Microscopic observation of bacterial strains after Gram staining (16 × 100)
2.1.2 二级筛选

表2 产酸定性实验结果Table 2 Evaluation of acid production ability
由表2可知,一级筛选的31 株菌进行产酸定性实验中,只有15 株菌生成红褐色沉淀。
2.1.3 三级筛选

表3 发酵液感官评价结果Table 3 Sensory evaluation of fermentation broths
由表3可知,二级筛选的活化醋酸菌经过5 d连续发酵,15 瓶发酵液由于醋酸菌的不同,呈现出不同的气味,有醋香味、菠萝蜜果香味、馊臭味等,从中筛选出5 株产醋香和菠萝蜜果香的醋酸菌用于后续实验。
2.2 生理生化实验

表4 菌株的生理生化实验结果Table 4 Results of physiological and biochemical tests of acetic acid bacteria
根据表4和《伯杰细菌鉴定手册》[21]的描述,初步判断筛选出的5 株疑似醋酸菌Aa723、Aa747、Aa844、Aa847和Aa941均属于醋酸杆菌属。
2.3 16S rRNA鉴定
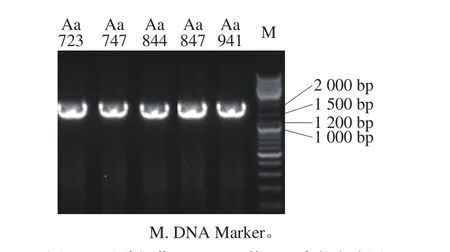
图3 醋酸杆菌16S rRNA的PCR产物电泳图Fig. 3 Agarose gel electrophoresis of PCR amplification products of 16S rRNA genes from selected strains
由图3可知,5 株醋酸杆菌的PCR扩增产物的片段大小约为1 500 bp,且条带清澈无弥散,说明PCR扩增成功,可进行下一步的16S rRNA基因片段测序。

图4 醋酸杆菌的系统发育树Fig. 4 Phylogenetic tree of acetic acid bacteria
由图4可知,5 株醋酸杆菌在系统发育树中属于4 个不同的种。通过bookstrap检验1 000 次支持该进化树分支可信度,综合各菌株的生理生化特征和形态学结果,可以确定5 株醋酸杆菌:Aa723和Aa941为巴氏醋酸杆菌(A. pasteurianus),Aa847为法布拉姆醋酸杆菌(A. fabarum),Aa747为热带醋酸杆菌(A. tropicalis),Aa844为醋化醋酸杆菌(A. aceti)。其中筛选出的A. fabarum、A. tropicalis、A. aceti均为首次在菠萝蜜果醋醋醪中分离得到。
2.4 醋酸菌发酵性能实验
2.4.1 生长曲线测定
由图5可知,Aa723、Aa847的对数生长期在6~60 h之间,其他菌株的对数生长期为6~48 h。Aa941的生长量最大,OD600nm值达到1.31,其次分别是As1.41、Aa747、Aa844、Aa847和Aa723,说明Aa941在筛选出的5 株菌株中具有较强的适应能力,且与商业菌株As1.41具有相似的生长曲线。菌种在对数期内具有较强的活力和繁殖能力,同时对外界刺激的应激反应较为灵敏[25],因此,选择48 h为醋酸杆菌种子液培养时间。
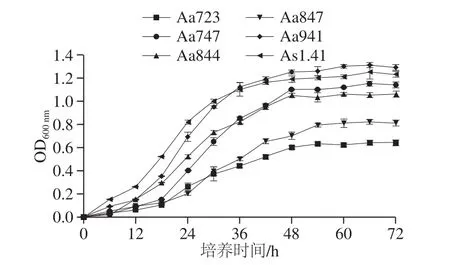
图5 醋酸菌生长曲线Fig. 5 Growth curves of acetic acid bacteria
2.4.2 温度对发酵性能的影响

图6 温度对菌株生长量(A)、产酸量(B)和醇酸转化率(C)的影响Fig. 6 Effect of temperature on OD600 nm (A), acetic acid production (B)and alcohol-acid transform ratio (C) of strains
种属不同的醋酸杆菌有不同的最适生长温度[26]。有研究表明,在一定范围内,随着温度的升高,醋酸杆菌的生长速率和产酸代谢速率呈现先升高后下降的趋势[27-28]。由图6可知,在25~37 ℃范围内,除Aa723外,其他5 株醋酸杆菌的生长量、产酸量和醇酸转换率随着温度先升高后下降。Aa723与Aa941、As1.41分别在25、31 ℃时具有最高的生长量和产酸量,Aa723、Aa747在28 ℃时有最高醇酸转换率。在25~31 ℃范围内,Aa847、Aa941和As1.41的醇酸转换率变化较小,Aa844的生长量和产酸量波动较小,相比较而言,Aa723和Aa747的在该温度范围内敏感性较强。Aa941在31、34、37 ℃时的产酸量均为各醋酸杆菌中最高,分别达到38.70、35.78、19.79 g/L;在37 ℃时,6 个菌株均能保持一定的产酸量,但只有Aa941和As1.41的OD600nm值能达到0.650以上,且能维持较高的醇酸转换率,分别达到65.10%和63.10%。
对比国内外相关研究,李文等[17]从猕猴桃中筛选出一株耐高温醋酸杆菌WT08(A. pasteurianus),在36 ℃培养72 h,产酸量为10.65 g/L,相同发酵时间,本研究筛选的醋酸杆菌Aa941在37 ℃产酸量为19.79 g/L,明显优于WT08。
2.4.3 乙醇体积分数对发酵性能的影响

图7 乙醇体积分数对菌株生长量(A)、产酸量(B)和醇酸转化率(C)的影响Fig. 7 Effect of ethanol concentration on OD600 nm (A), acetic acid production (B) and alcohol-acid transform ratio (C) of strains
乙醇既是醋酸菌生长的能量来源,也是醋酸发酵的底物[29],但高体积分数乙醇将严重抑制醋酸菌的生长和代谢速率[30]。由图7可知,随着乙醇体积分数的上升,各醋酸杆菌的生长量基本呈现下降的趋势,产酸量和醇酸转换率呈先上升后下降趋势;各醋酸杆菌在乙醇体积分数为2%时OD600nm值最大,均高于0.950;在乙醇体积分数为4%时产酸量最高,说明低体积分数的乙醇不利于醋酸杆菌的产酸代谢。当乙醇体积分数大于8%时,6 株菌的生长值、产酸量和醇酸转换率均受到不同程度的抑制,其中Aa844受到的抑制最为严重,OD600nm值和产酸量分别低于0.400 g/L和10.00 g/L,只有Aa941和As1.41的生长虽受抑制,但依然保持着较高的产酸量和醇酸转换率。在6 株醋酸菌中,当乙醇体积分数为4%,Aa941的产酸量最大,达到36.50 g/L;乙醇体积分数为6%、8%时,Aa941的产酸量和醇酸转换率均大于其他5 株醋酸菌,分别为30.15 g/L、74.85%和25.11 g/L、74.10%。
对比国内相关研究,张志燕等[31]在香醋醋醅中筛选出优势醋酸菌D-3-4,在乙醇体积分数为5%~11%时,产酸量随着乙醇体积分数上升而下降,产酸量在11%时受到较严重抑制,与本研究结果基本一致。李大为等[32]从自然发酵的苹果醋中分离出一株高耐受性醋酸杆菌B103(A. pasteurianus),产酸量为35.6 g/L,耐受乙醇体积分数为7%,本研究筛选出的醋酸菌Aa941(A. pasteurianus)其乙醇体积分数耐受性和产酸量均高于B103。
3 结 论
本研究通过富集培养、生理生化实验验和16S rRNA分子生物学鉴定的方法,对自然发酵的菠萝蜜果醋醋醪中醋酸菌进行发酵特性研究。结果表明,从菠萝蜜果醋醋醪中分离鉴定出5 株醋酸杆菌,分别为Aa723和Aa941(A. pasteurianus)、Aa847(A. fabarum)、Aa747(A. tropicalis)以及Aa844(A. aceti),其中不同醋酸杆菌对温度和乙醇体积分数的耐受性具有显著性差异。菌株Aa941发酵性能最佳,31 ℃连续发酵96 h,在乙醇体积分数为4%时产酸量最大,达到38.70 g/L;乙醇体积分数为6%时,30 ℃发酵96 h醇酸转化率达到最高,为74.85%。Aa941在8%高乙醇体积分数条件下,30 ℃发酵96 h产酸量和醇酸转换率分别为25.11 g/L和74.10%;在37 ℃高温下生长良好,乙醇体积分数4%发酵96 h产酸量和醇酸转换率分别为19.79 g/L和65.10%,其耐乙醇和耐高温性能优于商业菌种As1.41。醋酸杆菌Aa941能将菠萝蜜果酒发酵成具有菠萝蜜特征香气的果醋,可作为菠萝蜜果醋发酵的菌种,进一步丰富了果醋发酵所需的菌种资源。

