酸热诱导大豆分离蛋白纳米颗粒形成及其荷载姜黄素的特性
袁 丹,赵谋明,张思锐,黄 燚,周非白
(华南理工大学食品科学与工程学院,广东 广州 510640)
随着人们对膳食营养与健康的日益重视,功能性食品的开发己成为食品领域研究者的关注热点。姜黄素(curcumin,Cur)是一种天然来源的疏水性多酚,具有一系列潜在有益的生物和药理作用,包括抗氧化、抗菌、抗炎和抗癌等活性[1],在功能性食品领域发展前景广阔。然而,Cur存在水溶性低、加工稳定性差以及生物利用度低等问题,严重制约了产业化应用及人群积极性反馈。大量研究表明,通过包埋荷载技术可有效实现Cur等功能因子的稳态化。包括纳米颗粒[2]、乳液[3]、脂质体[4]、胶束[5]以及凝胶[6]等多种输送载体不仅可以提高Cur的水溶性和环境稳定性,还能增强其在肠道细胞内的渗透性,提高Cur的生物利用度。与合成聚合物及其他生物大分子相比,蛋白质在生物相容性及环境友好等方面更具优势[7]。其中通过纳米技术制备纳米级的蛋白载体还利于发挥Cur的尺度效应[8-10]。相比于动物蛋白,植物蛋白来源广泛、价格低廉、资源可再生且营养价值可观,是蛋白基纳米输送载体的理想原料。作为现今食品工业生产和利用最广泛的植物蛋白,大豆蛋白市场可接受度高,且己有研究将其用于β-类胡萝卜素[11]、香草醛[12]和白藜芦醇[13]等多种疏水活性物质的荷载。
基于Cur在有机溶剂中的溶解特性,为了提高其包埋率,反溶剂法被广泛应用。但是反溶剂过程中消耗大量的有机试剂以及纯水,不符合现代食品工业环保绿色的生产原则。此外,许多研究表明经反溶剂法制得的高荷载Cur纳米颗粒,容易发生因本身结构性质不够稳定导致的桥连聚集或解离,一般还需通过加入化学试剂进行二次交联[14-15]。因此,研究操作简便且绿色环保的物理方法制备大豆分离蛋白(soy protein isolate,SPI)-Cur纳米颗粒极具工业应用价值。通过粉碎、研磨、均质、超声、X射线处理均可制备出包载Cur的纳米颗粒,其中均质和超声处理工序简单、绿色环保,可在工业生产中得到大规模应用[16-17]。Tapal等[18]利用均质成功制备了稳定的SPICur纳米颗粒,提高了Cur的水溶性和生物利用率。Zhang Yuanhong等[19]利用超声技术诱导SPI酶解不溶性聚集体与Cur共组装,制备出了大豆肽-Cur纳米复合颗粒,显著提高了Cur在细胞内的生物活性。
关于Cur稳态化的研究表明,SPI的结构很大程度上影响其与Cur之间的相互作用,进而影响蛋白质-Cur颗粒形成并对Cur溶解度的提高起关键作用。SPI疏水性氨基酸含量较高(>60%),还含有相当大比例的极性和带电残基,这为其与生物活性小分子通过疏水相互作用、氢键以及经典相互作用提供了可能[20-21]。Chen Feiping等[22]发现蛋白质的疏水性质是影响SPI与Cur结合的重要因素,其中疏水相互作用和二硫键是保证结合亲和力的必要条件。Chang Chao等[23]则发现氢键、疏水相互作用和静电作用在蛋白-多糖复合体系中对Cur稳定性的提高起决定作用。实验室前期研究不同pH值、加热温度和时间条件下蛋白的粒径、多分散系数(polydispersity index,PDI)、浊度、电位等的变化,发现通过在等电点附近加热处理(pH 5.9,95 ℃,30 min)SPI可诱导蛋白自组装,形成最大量的、稳定的、球形的、具有核-壳结构的SPI纳米颗粒[24]。结合蛋白结构对Cur稳态化的影响,上述通过二硫键和疏水相互作用稳定且具有疏水内核的蛋白结构为荷载以Cur为例的疏水性活性物质提供了可行性。
本实验以SPI为原料,在特定pH值条件下(pH 7.0、5.9)静态加热处理(95 ℃、30 min)诱导SPI自组装形成纳米颗粒,分别记作HSPI及HSPI(pH 5.9),系统表征了它们的粒径、PDI、表面疏水性以及表观形貌,并利用荧光光谱研究它们与Cur的相互作用。通过均质或超声处理制备SPI-Cur纳米颗粒,探究蛋白-Cur纳米颗粒中Cur的水溶解度以及颗粒的性质和贮藏稳定性。
1 材料与方法
1.1 材料与试剂
冷冻脱脂豆粕(蛋白质质量分数约为45%) 山东禹王实业有限公司;Cur 上海麦克林生化科技有限公司;无水乙醇(分析纯) 广州市丛源仪器有限公司。
1.2 仪器与设备
SL2000A多功能粉碎机 青岛纳丽雅厨具设备有限公司;RW20电动搅拌机 德国IKA公司;pH计 瑞士梅特勒-托利多仪器有限公司;CR22N高速冷冻离心机日本Hitachi公司;UH-150A超声波细胞破碎仪 天津Autoscience公司;WN7501V紫外-可见分光光度计上海佑科工业设备有限公司;Zetasizer Nano ZSP纳米粒度仪 英国Malvrern公司;JEM-2100F透射电镜(transmission electron microscope,TEM) 日本电子株式会社;荧光光谱仪 芬兰Thermo Fisher Scientific公司。
1.3 方法
1.3.1 SPI的制备
采用传统碱溶酸沉的方法[25]。将脱脂低温豆粕粉碎至粉末,过筛,然后以1∶10的质量比加入去离子水分散,将分散液调节至pH 8.0,室温下搅拌2 h,然后10 000×g离心20 min,上清液经纱布过滤后调至pH 4.5,于4 ℃静置30 min后10 000×g离心20 min,收集沉淀,将沉淀用去离子水洗2~3 遍后称质量,再以1∶7的质量比加入去离子水缓慢搅拌,该过程溶液调至pH 7.5,充分溶解后4 ℃透析48 h,最后冷冻干燥备用。
1.3.2 SPI纳米颗粒的制备
特定pH值条件下热处理蛋白制备蛋白纳米颗粒的方法参照课题组己有的条件开展[24]。称取一定量的SPI溶解于去离子水中配成质量分数1%的SPI溶液,室温下搅拌2~3 h,4 ℃水化过夜,待恢复至室温后,一部分SPI溶液用1 mol/L NaOH溶液调至pH 5.9,剩余SPI溶液调节至pH 7.0。取一定量pH 5.9和pH 7.0的SPI溶液置于95 ℃的水浴锅中静态加热处理30 min,冷却至室温,所得溶液即为热处理SPI溶液,分别记为HSPI和HSPI(pH 5.9)。
1.3.3 SPI纳米颗粒的结构表征
1.3.3.1 颗粒粒径分布及PDI的测定
采用动态光散射(dynamic light scattering,DLS)技术,蛋白溶液用磷酸盐缓冲液(phosphate buffer saline,PBS)(10 mmol/L、pH 7.0)稀释至0.5 mg/mL后用纳米粒度仪测定。所有样品均在25 ℃进行测定,平行测定3 次。
1.3.3.2 蛋白质表面疏水性测定
SPI、HSPI和HSPI(pH 5.9)的表面疏水性采用1-苯胺基萘-8-磺酸盐(8-anilino-1-naphthalenesulfonic acid,ANS)法[26]。ANS-和蛋白溶液分别用10 mmol/L、pH 7.0的PBS配制成浓度为8 mmol/L和质量浓度1 mg/mL,蛋白溶液再稀释至0~0.5 mg/mL,在试管中分别加入3 mL稀释后的蛋白溶液和20 μL ANS-溶液,振荡混匀后测定混合液的荧光强度,测定条件为:激发波长365 nm、发射波长484 nm、狭缝宽度2.5 nm。以荧光强度为纵坐标、蛋白浓度为横坐标作图,线性拟合后得到的斜率即为样品的表面疏水性。
1.3.3.3 颗粒形貌
蛋白颗粒的形貌特点通过TEM进行观察。将蛋白溶液稀释至0.5 mg/mL后取一滴置于碳支持膜铜网上,于白炽灯下照射30 s后立即用滤纸吸去过量的样品,然后在铜网上滴加一滴磷钨酸(20 mg/mL)继续在白炽灯下照射60 s,然后用滤纸吸去过量的磷钨酸,过夜晾干后用TEM进行观察,扫描电压为80 kV。
1.3.4 荧光光谱分析
蛋白质与Cur之间的相互作用通过蛋白质内源荧光和Cur荧光光谱分析,参考Tapal等[18]的方法。SPI、HSPI和HSPI(pH 5.9)蛋白溶液用10 mmol/L、pH 7.0的PBS稀释至蛋白质质量浓度为0.5 mg/mL,Cur溶于无水乙醇至0~200 μmol/L,取一定体积稀释后的蛋白溶液和Cur溶液,使得最终Cur浓度分别为0~10 μmol/L,搅拌5 min后用荧光光谱仪测定,测定条件为:激发波长280 nm,发射波长300~450 nm,激发和发射狭缝宽度均为2.5 nm。等体积PBS与Cur溶液混合作为空白对照,最终样品实际荧光光谱为减去空白对照后的光谱。
Cur用Tris-HCl(50 mmol/L、pH 7.4)溶解至10 μmol/L,将SPI、HSPI和HSPI(pH 5.9)蛋白溶液用去离子水稀释至蛋白质质量浓度为0~10 mg/mL,然后将蛋白溶液与Cur溶液等体积混合搅拌1 h后测定其荧光光谱,测定条件为:激发波长420 nm,发射波长450~700 nm,激发和发射狭缝宽度分别为2.5 nm和5 nm。等体积蛋白溶液与Tris-HCl混合后作为空白对照,最终样品实际荧光光谱为减去空白对照后的光谱。
1.3.5 SPI-Cur纳米颗粒的制备
将新鲜制备好的10 mg/mL的SPI、HSPI和HSPI(pH 5.9)蛋白分散液,加入过量的Cur粉末,搅拌20 min混合均匀后,将混合液进行均质或超声处理。均质条件为12 000×g、2.5 min,均质后在20 ℃、3 000×g离心15 min去除游离的Cur,得到的上清液即为均质后样品,分别记为SPI-Cur、HSPI-Cur和HSPI(pH 5.9)-Cur。超声条件为:超声功率150 W、输出频率22 kHz、时间5 min,超声后离心,离心条件同上,得到的上清液即为超声后样品,分别记为U-SPI-Cur、U-HSPI-Cur和U-HSPI(pH 5.9)-Cur。
1.3.6 SPI-Cur纳米颗粒的形成与表征
1.3.6.1 SPI-Cur纳米颗粒中Cur水溶性的测定
SPI-Cur纳米颗粒中Cur的质量浓度即为Cur在水溶液中的溶解度,通过如下方法测得:将均质和超声后离心得到的上清液用无水乙醇充分萃取出其中的Cur,在10 000×g、20 min条件下离心除去蛋白质后,测定上清液于426 nm波长处的吸光度,并根据标准曲线y=0.084x+0.000 7(R2=0.999 9)计算Cur的浓度。
1.3.6.2 蛋白-Cur纳米颗粒粒径及其分布的测定
SPI-Cur纳米颗粒的颗粒粒径及其分布的测定方法同1.3.3.1节。
1.3.6.3 SPI-Cur纳米颗粒荧光光谱分析
将均质和超声后得到的SPI-Cur样品稀释20 倍后测定其蛋白质内源荧光及Cur荧光光谱,测定条件同1.3.4节。
1.3.7 超声后SPI-Cur纳米颗粒的贮藏稳定性
将新鲜制备的超声后SPI-Cur样品等分分装至同样的实验瓶中,密封后在室温(25 ℃)避光贮藏,定期测定颗粒粒径的大小、分散性以及其上清液中Cur的含量。
1.4 数据分析
2 结果与分析
2.1 SPI纳米颗粒的形成与表征
2.1.1 颗粒粒径、分散性和表面疏水性
实验首先利用DLS探究了pH 7.0及pH 5.9条件下加热对蛋白粒径及PDI的影响。如表1所示,SPI虽然平均粒径小(<80 nm),但是粒径分布不均匀(PDI>0.5),与相关报道一致。热作用使得SPI发生热变性形成聚集体,显著增加其平均粒径,但是同时增加其分散均一性。这是由于热处理引起了蛋白构象部分去折叠而诱导聚集,同时过程中形成了更多的二硫键使得颗粒相对稳定均一[27]。其中,经pH 5.9加热得到的样品HSPI(pH 5.9)因加热后回调至pH 7.0过程中吸水溶胀导致粒径增大[24];而加热后暴露出来的α’-、α-亚基具有延伸区域,己被证明可以抑制SPI的聚集,所以使颗粒能够维持均一[28]。进一步通过ANS-法测定3 个蛋白样品的表面疏水性,结果表明,热处理可显著增加蛋白表面疏水性(P<0.05),可能与热变性会引起其结构的伸展及表面修饰有关。其中,pH 5.9条件下加热蛋白可使巯基转变成二硫键[24],而二硫键的周围常聚集着疏水性氨基酸,这使得HSPI(pH 5.9)的表面疏水性最高。

表1 SPI、HSPI和HSPI(pH 5.9)的粒径、PDI以及表面疏水性Table 1 Particle size, PDI and surface hydrophobicity of SPI,HSPI and HSPI (pH 5.9)
2.1.2 形貌学
为了更好地了解SPI纳米颗粒以及比较SPI、HSPI和HSPI(pH 5.9)三者的差异,通过TEM观察其表观形貌,如图1所示。SPI表面光滑,大部分为近乎球形颗粒,其颗粒大小不一;HSPI表面粗糙,颗粒感减弱,有明显的聚集体出现;而HSPI(pH 5.9)均为球形,表面较SPI略粗糙,颗粒大小均一,虽有部分聚集在一起,但仍以单独的颗粒呈现,表观粒径较SPI大;这些结果与DLS测得的结果一致。HSPI和HSPI(pH 5.9)聚集体的形成是由于热处理导致SPI构象部分去折叠,暴露了球蛋白分子内部的疏水基团,表面疏水性升高,同时诱导形成的二硫键促进了蛋白颗粒或肽段之间的相互作用[29]。而加热使得肽段伸展并吸附在颗粒的表面,因此HSPI和HSPI(pH 5.9)的表面呈现粗糙状。HSPI(pH 5.9)粒径较大可能是由于在从弱酸性条件回调至pH 7.0过程中颗粒吸水溶胀所致。此前对HSPI(pH 5.9)结构特征的研究发现带正电的碱性多肽与β-亚基一起被包裹在颗粒的内部,形成了疏水核心,同时由于带负电的α’-、α-亚基和酸性多肽相对更亲水而位于颗粒的表面[24]。由此得出结论,通过在95 ℃加热SPI溶液(pH 5.9)30 min诱导了SPI发生自组装,形成了具有核-壳结构的球形SPI纳米颗粒。此外,与DLS测定的平均粒径相比,TEM的结果普遍偏小,可能与空气干燥过程及颗粒在干燥过程中的结构收缩有关[24]。

图1 SPI(A)、HSPI(B)和HSPI(pH 5.9)(C)颗粒的TEM图Fig. 1 TEM images of SPI (A), HSPI (B) and HSPI (pH 5.9) (C) particles
2.2 SPI与Cur相互作用研究

图2 不同浓度Cur对SPI、HSPI和HSPI(pH 5.9)内源荧光的影响Fig. 2 Effects of different concentrations of curcumin on intrinsic fluorescence of SPI, HSPI and HSPI (pH 5.9)
SPI分子中因含有疏水性氨基酸(色氨酸、酪氨酸和苯丙氨酸)而具有荧光特性,蛋白质内源荧光的变化可直接反映疏水性氨基酸所处微环境的变化。生物活性小分子的结合会导致蛋白质荧光猝灭,因此为了研究SPI、HSPI和HSPI(pH 5.9)和Cur之间的相互作用,通过分析蛋白质和Cur的荧光光谱阐述。如图2A~C所示,在280 nm的激发波长处,SPI、HSPI和HSPI(pH 5.9)都呈现出强荧光强度,其中SPI在334 nm波长处具有最大荧光强度,HSPI和HSPI(pH 5.9)在340 nm波长处具有最大荧光强度。这一现象表明经过热处理后SPI内源疏水氨基酸所处微环境更加亲水,这是由于热作用诱导聚集的同时使得蛋白质结构伸展和疏水基团暴露所致。而随着加入的Cur浓度(0~10 μmol/L)增加,蛋白质的荧光强度逐渐降低,并且最大荧光发射波长发生蓝移,表明Cur与蛋白质的疏水性氨基酸发生了结合,使得它们所处的微环境极性降低,说明了Cur与SPI结合的作用力主要是疏水相互作用。为了更直接的表征两者结合的亲和力,通过Stern-Volmer方程计算Cur对SPI、HSPI和HSPI(pH 5.9)内源荧光的猝灭常数(Ksv):

式中:F0和F分别为未加入Cur和加入Cur时蛋白的荧光强度;C为混合液中Cur的浓度/(μmol/L);Ksv为Stern-Volmer猝灭常数。
以F0/F为纵坐标、Cur浓度为横坐标作图(图2D),经线性拟合后发现Cur浓度与SPI、HSPI和HSPI(pH 5.9)三者的F0/F值都呈现出良好的线性关系(R2≥0.99),表明Cur可均匀的结合在蛋白的疏水基团上。计算得到SPI、HSPI和HSPI(pH 5.9)与Cur结合的Ksv值分别为0.274、0.454、0.550 μmol/L,可以发现热处理SPI的Ksv值相比SPI显著提高(P<0.05),并且HSPI(pH 5.9)猝灭效果更加显著,说明HSPI(pH 5.9)与Cur之间具有更高的亲和力,这是HSPI(pH 5.9)表面疏水性高赋予蛋白的独特性质。
Cur的固有荧光对其周围环境的极性高度敏感,因此,研究了不同SPI、HSPI和HSPI(pH 5.9)浓度下Cur的荧光特性。如图3所示,没有SPI的情况下在420 nm波长处激发游离Cur时呈现的荧光峰强度非常低,这主要是由于水溶液中Cur的溶解性差。随着蛋白质量浓度(0~5 mg/mL)的增加,Cur的最大荧光强度也随之增加,这表明SPI、HSPI和HSPI(pH 5.9)有效提高了Cur的溶解性。另外,Cur的最大荧光发射波长从长波长向短波长变化,这种荧光峰的蓝移表明Cur向极性更小的环境移动,可能是由于Cur分子通过疏水相互作用与蛋白质中的色氨酸、酪氨酸等结合,其他类似研究也得出了相同的结论[30-32]。由图3还可看出,HSPI(pH 5.9)对于Cur荧光强度的提高相比SPI和HSPI更加显著,该结果与图2结果一致。
综上,具有核-壳结构的HSPI(pH 5.9)纳米颗粒与Cur具有强结合亲和力,这主要是归因于Cur与蛋白质之间的疏水相互作用,这种核-壳结构对于提高Cur溶解性有显著效果,可用于荷载及递送Cur的潜在壁材。

图3 不同质量浓度的SPI、HSPI和HSPI(pH 5.9)对Cur荧光的影响Fig. 3 Effects of different concentrations of SPI, HSPI and HSPI(pH 5.9) on curcumin fluorescence
2.3 SPI-Cur纳米颗粒的形成与表征
2.3.1 SPI-Cur中Cur的水溶性及其粒径和分布
SPI-Cur纳米颗粒中Cur的含量是评价其对Cur是否成功包载及增溶的有效依据。将SPI、HSPI和HSPI(pH 5.9)与Cur粉末混合搅拌后经均质或超声,离心后得到的上清液为黄色、透明状液体(图4A),超声处理对SPI提高Cur水溶性更加有效(表2),说明超声处理有利于蛋白与Cur之间的结合。相关研究表明,超声波处理后将大分子颗粒破碎重组成较小的颗粒,从而可以增加蛋白的溶解性和表面疏水性[33-35]。此外,热处理后SPI提高Cur水溶性效果更加显著(表2),这是由于热处理增加了蛋白质的表面疏水性,相似的报道也见于β-乳球蛋白[36]。值得关注的是,超声后HSPI(pH 5.9)可将Cur粉末在水中的溶解量提高至12.43 μg/mL,相比Cur粉末在水中的溶解度11 ng/mL,其溶解度提高了1 130 倍左右。除了HSPI(pH 5.9)蛋白自身表面疏水性高以及超声的驱动作用影响外,HSPI(pH 5.9)的核-壳结构中大量疏水基团形成的强疏水内核更有利于与Cur的结合也是主要原因(图5)。
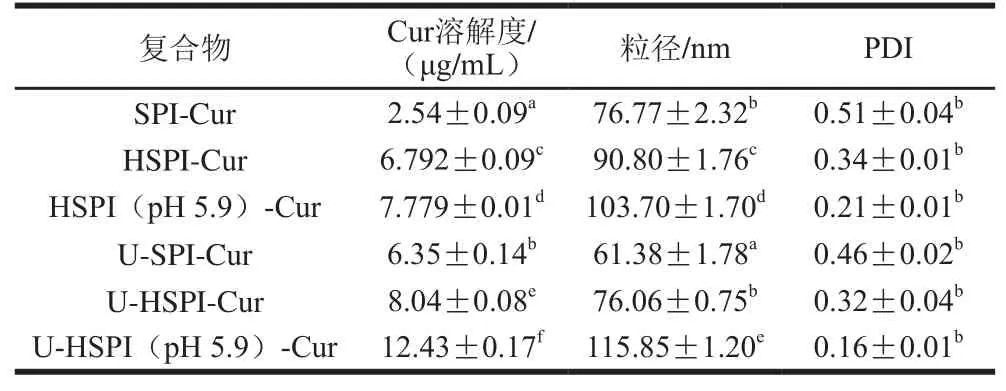
表2 SPI-Cur中Cur溶解度及其粒径、PDITable 2Curcumin solubility, particle size and PDI of SPI-curcumin
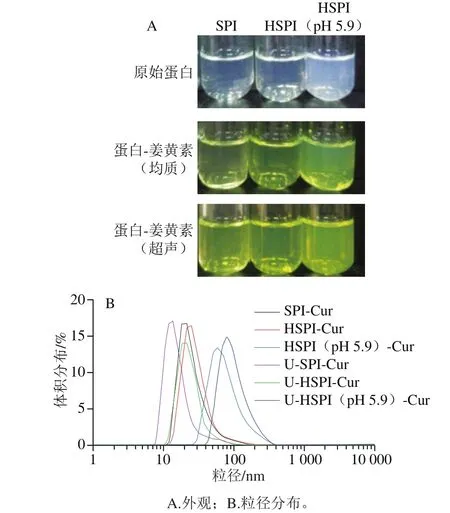
图4 不同处理对SPI、HSPI、HSPI(pH 5.9)-Cur的影响Fig. 4 Effect of different treatments on SPI, HSPI, and HSPI (pH 5.9)-Cur
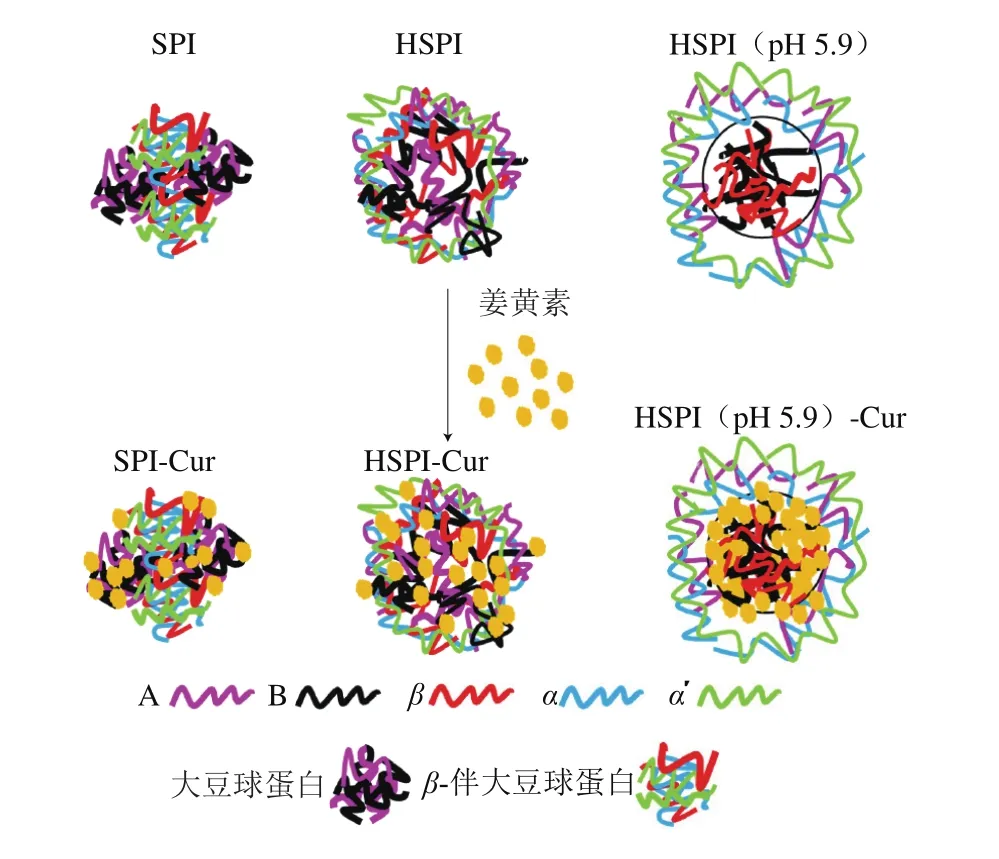
图5 SPI-Cur、HSPI-Cur和HSPI(pH 5.9)-Cur形成机理图(部分参考Chen Nannan等[24])Fig. 5 Schematic illustration of the formation of SPI-Cur, HSPI-Cur and HSPI (pH 5.9)-Cur
颗粒在溶液中的稳定性与颗粒本身的尺寸大小及其分散性具有密切关系,普遍认为,颗粒的粒径小且均一易分散,稳定性也越好,反之则容易发生聚集或沉淀。SPI -Cur颗粒的平均粒径及其分布如图4B所示,与SPI、HSPI和HSPI(pH 5.9)相比,均质后SPI-Cur、HSPI-Cur和HSPI(pH 5.9)-Cur颗粒粒径以及PDI大小的变化均不显著,这可能是均质功率比较小且时间短,并没有导致蛋白质颗粒聚集或解聚。与均质后样品颗粒相比,经超声处理得到的U-SPI-Cur和U-HSPI-Cur颗粒平均粒径均减小,但PDI值没有显著变化,这主要是因为超声处理诱导蛋白颗粒与Cur共组装的同时也使得一些大颗粒或聚集体分解成较小的颗粒。与之不同的是超声后U-HSPI(pH 5.9)-Cur颗粒粒径虽略有增加,但分散性却依旧保持良好,其粒径的增加可能是由于超声后蛋白溶解度提高导致HSPI(pH 5.9)出现了轻微溶胀。
2.3.2 蛋白-Cur纳米颗粒荧光光谱研究
进一步利用荧光光谱研究蛋白-Cur纳米颗粒中蛋白质及Cur结构的变化。从图6A、B可以发现,经过均质或超声处理后,SPI、HSPI和HSPI(pH 5.9)的内源荧光最大发射波长均发生了红移,这可归因于均质和超声增加了蛋白的溶解度,使得疏水基团所处环境极性增强。由于Cur与蛋白结合,导致了蛋白内源荧光不同程度的猝灭,说明它们之间主要通过疏水相互作用而结合。此外,由蛋白-Cur纳米颗粒中Cur的荧光光谱结果表明超声处理后荧光强度比均质后更低,超声颗粒中Cur的最大发射波长红移,说明超声可以诱导SPI与Cur共组装。图6C、D对Cur荧光的研究结果表明SPI、HSPI和HSPI(pH 5.9)与Cur作用后,增强了Cur的荧光强度,改善了Cur的溶解性,超声处理后效果更加显著。无论是均质还是超声形成的纳米颗粒,都表明了HSPI(pH 5.9)与Cur结合的能力更强,蛋白质荧光猝灭和Cur荧光增强与蛋白-Cur纳米颗粒中Cur水溶性提高的结果一致。
综上结果表明,超声处理可以增强SPI与Cur的相互作用,进而提高Cur的水溶性,HSPI(pH 5.9)的核-壳结构更有利于与Cur在均质和超声过程中的共组装形成均一分散性好的纳米颗粒。


图6 SPI、HSPI、HSPI(pH 5.9)-Cur的荧光光谱Fig. 6 Fluorescence spectra of SPI, HSPI, and HSPI (pH 5.9)-Cur
2.4 超声后蛋白-Cur纳米颗粒的贮藏稳定性
除了不溶性之外,Cur易降解是限制其开发利用的另一因素。研究表明,Cur在中性环境下非常不稳定,30 min则有90%被降解[37]。为了考察蛋白-Cur颗粒(U-SPI-Cur、U-HSPI-Cur和U-HSPI(pH 5.9)-Cur)中Cur以及颗粒本身的贮存稳定性,在25 ℃贮存30 d进行监测。
图7A显示,新鲜制备的U-SPI-Cur和U-HSPI-Cur中Cur含量迅速减少,第3天时上清液中Cur的保留率分别仅有50%和60%,随着贮藏时间的延长,Cur的保留率缓慢降低,而U-HSPI(pH 5.9)-Cur中Cur含量在7 d后才开始逐渐降低。在贮存30 d后,U-HSPI(pH 5.9)-Cur中Cur保留率为77%,远高于U-SPI-Cur(35%)和U-HSPI-Cur(44%)。U-SPI-Cur和U-HSPI-Cur中Cur保留率在1~3 d降低迅速可能是因为SPI和HSPI与Cur结合较弱,当开始贮藏后Cur与蛋白解结合成为游离态而被迅速降解,HSPI(pH 5.9)因其核-壳结构将Cur包裹在疏水内核所以保持稳定。从图7B、C可以看出,贮藏过程中,超声后形成的蛋白-Cur颗粒粒径和PDI均保持稳定。上述实验结果表明,相比SPI和HSPI,HSPI(pH 5.9)的核-壳结构对Cur的保护作用更佳,形成的纳米颗粒具有良好的贮藏稳定性。

图7 SPI、HSPI、HSPI(pH 5.9)-Cur随贮藏时间的变化Fig. 7 Changes in SPI, HSPI, and HSPI (pH 5.9)-Cur with storage time
3 结 论
本实验以SPI为原料,在pH 7.0和pH 5.9条件下对其进行静态热处理,得到了SPI、HSPI和HSPI(pH 5.9)3 种蛋白颗粒,其中HSPI(pH 5.9)是具有疏水核心和亲水壳的核-壳结构,它们均可通过疏水相互作用与Cur结合以提高Cur的水溶性。通过均质或超声等物理处理可成功制备SPI-Cur纳米颗粒,其中超声处理对于增强蛋白与Cur之间的相互作用更加显著。HSPI(pH 5.9)的核-壳结构更加有利于蛋白在超声过程中与Cur发生共组装,形成粒径小(<120 nm)、分散均一(PDI<0.2)的U-HSPI(pH 5.9)-Cur纳米颗粒,极大提高Cur的水分散性及贮藏稳定性。综上研究结果表明,HSPI(pH 5.9)可作为潜在的优质纳米级壁材用于Cur等疏水活性物质的包埋与输送。

