直链淀粉和支链淀粉分子结构研究进展
韩文芳,林亲录,赵思明,李江涛,*,牛桂红
(1.稻谷及副产物深加工国家工程实验室,中南林业科技大学食品科学与工程学院,湖南 长沙 410004;2.华中农业大学食品科学技术学院,湖北 武汉 430070)
淀粉是植物中储存能量的主要单元,以不同形态的颗粒状广泛存在于谷物、豆类、块茎类等植物的种子、根、主干、块茎、叶子和果实中,是许多食物的主要成分,并为生命活动提供最基本能量保障。淀粉是由α-1,4-和α-1,6-糖苷键连接的D-吡喃葡萄糖单元所构成的水不溶性葡聚糖,含有2 种主要组分,即支链淀粉(amylopectin,AP)和直链淀粉(amylose,AM)。大多数正常淀粉通常含有15%~35%的AM和65%~85%的AP,一些突变株淀粉的AM或AP质量分数分别高达85%和100%[1-2]。作为多数植物淀粉主要成分的AP由许多短链构成,这些短链在还原端通过α-1,6-糖苷键连接在一起,这使得AP成为了高度分支、结构较复杂的大分子葡聚糖。AM是淀粉的次要组成成分,被认为是基本线性的长链葡聚糖[3]。在淀粉颗粒的形成过程中,AP的生物合成主要是由可溶性淀粉合成酶(soluble starch synthases,SS)、淀粉分支酶(starch branching enzymes,SBE)包括SBE I、SBE IIa、SBE IIb等)和淀粉脱支酶(starch debranching enzymes,DBE)所催化的,而AM则主要是由蜡质基因编码的颗粒结合型淀粉合成酶(granulebound starch synthase,GBSS(包括GBSS I、GBSS Ib、GBSS II等)所催化合成[4-5]。天然淀粉中AM、AP分子并不是以松散的个体形式存在,而是通过分子链内和链间的氢键连接形成高度有组织的颗粒结构[6],其精细结构对于淀粉的结构及功能特性均有非常大的影响。本文对淀粉中AM和AP的精细结构及相关模型等方面进行了综述,为淀粉的研究及开发提供参考。
1 AM的含量、结构及其对淀粉颗粒结构的贡献
AM在大多数植物淀粉中约占15%~35%,传统上将其定义为由α-D-吡喃葡萄糖通过α-1,4-糖苷键连接起来的线性葡聚糖分子,在一些淀粉中发现了分支程度很低的AM分子[7]。
1.1 AM的含量
AM与AP的比例已被公认为是淀粉物化性质与功能特性的重要决定因素,大量研究认为AM含量直接影响谷物(尤其是大米)在烹煮等加工过程中的吸水膨胀、受热糊化以及成品品质,并将AM含量作为预测淀粉加工性质、淀粉质食品品质的重要指标[8-9]。
AM含量的测定主要有碘比色法、碘亲和力滴定法、伴刀豆球蛋白A沉淀法、尺寸排阻色谱法(size-exclusion chromatography,SEC)等方法。不同方法所得结果往往存在明显差异,这是因为各自的测定原理是基于淀粉性质或结构的不同方面。此外,大多数测定方法并没有考虑到淀粉颗粒中与AM分子质量相近但带分支(链长较长)的葡聚糖链对结果的影响,这些葡聚物在大多数天然淀粉中的含量很低,但在一些突变品种如高AM中含量较高,对结果影响较大[2]。目前最常用的测定方法仍然是基于碘络合AM的螺旋构象呈现蓝色的碘比色法,所得到的结果被认为是表观AM含量(apparent amylose content,AAC)。
对于相同来源的淀粉,其不同大小、形态的颗粒中AM含量也各不相同。大米淀粉颗粒的AAC依次为中空凹陷状>细长形>多聚集体>多边形[10],普通玉米淀粉的AAC随着颗粒尺寸的减小略有下降,但高直链玉米淀粉的AAC随着颗粒尺寸的减小显著增加[11]。研究表明,AM扩增基因(amylose extender,ae)、dull-1、surgary-1或某些其他突变基因都能诱导合成高直链含量的淀粉。在众多影响胚乳直链含量的突变基因中,以ae基因的效应最为显著,ae的隐性突变能使淀粉合成途径中的淀粉分支酶SBEIIb的活性降低,AP合成减少而籽粒淀粉中AM比例显著增高[4,12]。高直链玉米淀粉因缺乏SBEIIb使得ae突变,所合成的淀粉有着更长的内链和外链的支化分子,导致其碘结合值偏高[4,12]。
1.2 AM的结构
AM本质上是一种的基本线性α-(1,4)-D-葡聚糖链,由于AM的多分散性,通常以聚合度(degree of polymerization,DP)、链长的平均值来描述AM的分子尺寸和链长。AM的DP因植物来源不同而存在显著差异,根、块茎类AM的分子尺寸通常较谷物类大得多[7]。玉米、小麦、大米、大麦等典型谷物AM的DP分布较窄(190~3 880),且小分子质量组分(DP<1 000)的质量分数为50%~75%,而马铃薯、木薯、甘薯等块茎类淀粉AM的DP分布则相对较宽(440~9 770),其小分子质量组分质量分数仅为10%~25%[13]。
AM的线性链结构理论上能被β-淀粉酶完全水解,然而大多数淀粉的部分AM存在少量分支结构。与AP的β-水解极限值(55%~61%)相比,大部分普通谷物淀粉AM的β-水解极限值大于80%,而高直链玉米AM约为75%[14-15]。不同植物来源淀粉的AM分支结构可以采用化学和酶法表征并获得。据报道,芒果核AM有DP至少几百的长侧链[16];皱皮、滑皮豌豆AM在非还原端附近有1 个或2 个长侧链[17];葛根AM有9 个分支链[18];不同品种大米AM有3.4~7.6 个侧链[19];不同品种马铃薯AM同时含有短侧链(DP>4)、长侧链(DP>100),共约6~12 个[18,20]。Gunning等采用原子力显微镜揭示了豌豆AM的真实分支结构是既存在单独的长分支链又含有较多分支的短链[21]。目前对AM分支结构的研究很少,鲜有报道指出带分支AM是否支持簇结构理论。带分支AM的分子结构通常被当着一个整体来进行描述,主要包括其β-水解极限值为72%~95%,平均DP为200~600,每个分子有5~20 条分支链[22]。
1.3 AM对淀粉颗粒结构的贡献
一直以来,AM在淀粉颗粒结构中的存在形态、位置以及贡献都极具争议[23]。大量研究表明,AM在颗粒内的分布不均匀,由于AM的生物合成在淀粉积累后期更为活跃,导致其主要集中在颗粒边缘[6,24]。淀粉溶液中大部分AM在略低于糊化温度时可以从淀粉颗粒中溶出,且这些溶出的AM链是单螺旋状态而非双螺旋状态,而部分AM只有在90 ℃以上才能完全从颗粒中溶出。因此,单螺旋状态被认为是天然淀粉颗粒内AM链的主要状态,而小部分AM可能与脂质复合形成了单螺旋复合物,一些尺寸大的AM则可能随机参与了AP的双螺旋结构或者与AP在淀粉颗粒的复杂结构内相互缠结从而保持了淀粉颗粒在加热、剪切过程中的完整性[22,25]。V型单螺旋AM链有一个相对较大的疏水空腔形成螺旋结构,能够与多种有机和无机络合剂如碘、脂类、二甲基亚砜、风味化合物或脂肪酸等形成螺旋状络合物。在这种单螺旋结构中,AM的内表面是由C—H基团与糖苷氧原子形成一个亲脂性的核心,而所有的极性羟基则位于螺旋的外表面[26-27]。在大麦、小麦、玉米、燕麦等大多数谷物淀粉颗粒中发现了AM-脂质复合物,主要存在于无定形区域,对颗粒的膨胀有限制作用,熔融温度为94~100 ℃[28-29]。
在目前普遍接受的理论中,AM被认为主要存在于无定形区,可能与AP相混合或共同形成重复性的片层结构[30-31]。有学者提出,AM链是横向穿插在结晶片层中的[32],该观点被进一步假设为AM系链,即AM穿插于结晶区和无定形层在淀粉(尤其是高直链)结晶片层的组装中扮演了重要角色[33]。由于结晶片层中系链的存在,高AM的晶体结构缺陷较普通淀粉更为明显,AM含量增加意味着位于结晶片层缺陷区的AM系链和无定形片层中横向取向的AM链同时增多。而AM对层状结构的参与仍然难有定论,AM结构的一部分可能妨碍了AP双螺旋的结晶排列,部分长链AM则可能参与了双螺旋的形成并穿插了几个结晶片层,其有助于淀粉颗粒的结晶结构,由此导致高AM糊化温度较高(高达130 ℃)。AM对淀粉颗粒结晶结构的贡献应该不只取决于含量,特定的植物来源可能是关键[33-34]。
2 AP的分支链结构
AP由许多α-D-吡喃葡萄糖通过α-1,4-糖苷键连接而成的短链所构成,这些短链在还原端通过α-1,6-糖苷键连接在一起,这使得AP成为Mw为107~109的高度分支大分子[35-36]。AP的确切Mw很难获得,这是因为其Mw过大,在采用凝胶渗透色谱(gel permeation chromatography,GPC)法或SEC法分析时通常没有合适的介质,另外AP在溶液中易形成分子聚集体或存在链段断裂的风险[37]。
近年来,随着学者们对淀粉精细结构的深入探索以及分子模拟技术的引入,淀粉的分支结构特性在一定程度上得到了较为确切的评估。结合实验性和理论性的研究认为高度支化的AP大分子存在几个结构层次,最基础的结构包括单元链、由链段组成的簇以及构造单元(AP链段最小的分支单元),更高阶的结构则包括螺旋秩序中链的构象以及淀粉颗粒中AP与AM的组织排列[6]。虽然目前AP单元链的实际组织排列还没有明确,但已推导出2 个主要假说,即簇结构模型和构造单元骨架结构模型。
2.1 AP的簇结构模型
AP最初的簇结构是基于酸处理淀粉颗粒的结构研究所提出的,分支结构的主要部分被酸水解,余下的集群被称为簇,位于颗粒的无定形区[38]。AP分支点被认为在簇中,外部支链在双螺旋结晶结构中。学者们先后提出了许多簇状模型,具有代表性的是French模型[39]、Robin模型[40]、Hizukuri模型[41]、Thompson模型[42]等。根据这些学者们的相关研究,AP结构的簇概念主要包括:1)多分支低聚糖的分离,指的是约占AP分支35%的多分支构造单元,其内链长仅为1个葡萄糖残基;2)淀粉颗粒经酸水解后留下的抗酸极限糊精的形成;3)离散性短链和长链链段的存在;4)经环糊精糖基转移酶或α-淀粉酶部分水解产物大分子糊精(即簇)的形成;5)淀粉颗粒内离散性周期(即片层)的存在[43]。这些研究认为对淀粉颗粒的结晶作出贡献的基础成分是AM而不是AP,这是因为AM与碘络合的螺旋结构得到了证实,而淀粉颗粒中存在类似的螺旋结构[44]。
目前,最为广泛接受的AP簇结构模型见图1[41,45-46]。从图1可以看出,AP分子的不同分支链分别被定义为A链、B链和C链。其中,A链为最短链,通过α-1,6-糖苷键连接到AP分子的其他链段,一般将其称为外链,不能被其他链段所取代。B链则被定义为支撑A链或其他B链的链段,依据其各自的长度以及所跨越簇的数量可进一步分为B1、B2、B3、B4等链段。其中,B1链是短链,仅跨过一个簇结构,是该簇结构的组成部分,而B2、B3、B4链等则是长链,分别跨过2、3 个或多个簇结构,并将其接起来[47]。这些长链跨越不同的簇结构,维持整个淀粉分子的刚性,同时也维持淀粉颗粒内部的长程有序[1,6]。此外,每个AP分子只有一个C链,即携带唯一还原末端的单链,C链可与荧光染料结合来描述其分布[1]。从图1的簇结构模型可以明显看出,AP中A、B、C链链长分布情况的差异很有可能对链的有效堆积能力产生了较大影响。根据不同的链在簇中的位置可以进一步被分成特征性的片段,外链指从最外面的分支点延伸到非还原端的部分,即所有的A链均为外链,而部分B链也属于外链。其他B链称作总内链,包括分支点上的葡萄糖残基[3,48]。
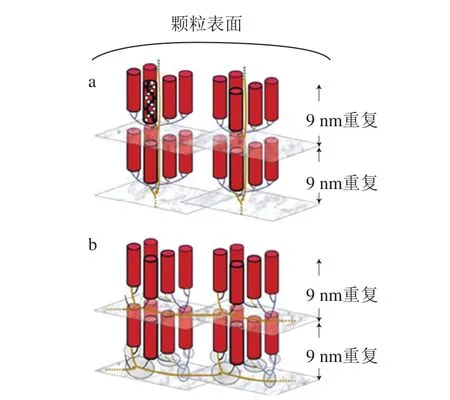
图2 AP在淀粉颗粒内形成交替的结晶片层与无定形片层(9 nm重复距离)的示意图[1]Fig. 2 Schematic drawings of amylopectin molecules forming the alternating crystalline and amorphous lamellae (9 nm repeat distance) in a starch granule[1]
图2a显示了基于簇结构模型对AP分子在淀粉颗粒内形成交替的结晶片层与无定形片层的直观理解。结合图2a与簇结构模型理论可知,AP分支结构的大多数并不形成结晶,而是参与AP在无定形片层的内部组织排列。AP的外链部分在结晶片层以双螺旋结构参与结晶,且其取向垂直于颗粒的表面,该特性使得淀粉颗粒在偏振光下显示为颗粒的基础双折射的性质,即“马耳他十字”。此外,AP短链的径向排列表明大分子在淀粉颗粒内的排列是以非还原端取向于颗粒表面,唯一的还原末端则是取向于颗粒的中心脐点[1]。
图2b显示了基于构造单元骨架结构模型对AP分子在淀粉颗粒内形成交替的结晶片层与无定形片层的直观理解。结合图1、2b与构造单元骨架模型理论可知,AP的短链基本上是垂直于骨架上的长链[49],这使得淀粉颗粒中AP分子彼此之间通过逐层排列形成重复间隔的片层,而不是通过分子在层与层之间的延伸[50]。该结构与淀粉颗粒经酸水解去除无定形片层所留下抗酸解结晶层的结构相符,这种结晶层以纳米晶体的形成被分离出来,其尺寸表明是由数百个双螺旋所组成[51]。而一个单独的簇通常只包含3~8 个双螺旋秩序,这意味着一个结晶片层是几个簇的构造单元所形成的协同结构,且可能是AP分子的贡献[6]。
2.2 AP的构造单元骨架结构模型
在对AP簇结构的研究中,学者们发现簇内的分支明显不是均匀分布的,同时从AP糊精单独分离得到的簇中一些内部长链仍然存在,这样的结构特征并不支持簇结构模型,由此推测所分离的簇中可能存在着更小、分支更为密集的亚级结构[52]。Bertoft[48,53]和Zhu Fan[54]等通过大量的实验确定了淀粉簇结构更小的分支单元即构造单元的存在,并对簇及其构造单元在AP大分子结构中的组织排列进行了相关的探讨。在此基础上,Bertoft等提出了一个二维骨架模型假设,簇以α-1,6-分支糖苷键与长链骨架相连,该骨架沿着几乎垂直的方向延伸,且位于颗粒的无定形片层。该假设模型进一步揭示了单个AP分子可能存在的超螺旋结构[55]。在随后的改进模型中,主要提出了以下概念:1)AP的一些长B2链通过外链参与了结晶片层,而无定形骨架中发现了更长的长链;由此可以认为AP的长B2链同时参与了簇结构和无定形骨架结构,而长B3链等更长的链段可能仅存在于骨架结构中[56];2)簇通过自身的构造单元与构造单元之间的链段(interblock segments,IB-S)形成了骨架的一部分,而不是作为单独存在的部分附着在骨架上[57];3)簇的结构特征是构造单元的组成,构造单元直接附着在骨架上,且因骨架链的长度及IB-S的数量差异明显,这解释了在某些分离的簇中仍存在长B2链的现象[49]。这个结构可以与AP侧链液晶模型共存,构造单元相当于液晶原经由“柔性空间臂”附着在骨架上[6]。如果链接到骨架的链太短,不具备合适的“柔性空间”,则可能无法有效排列从而导致结晶片层的结构缺陷而不是促进结晶[33-34]。
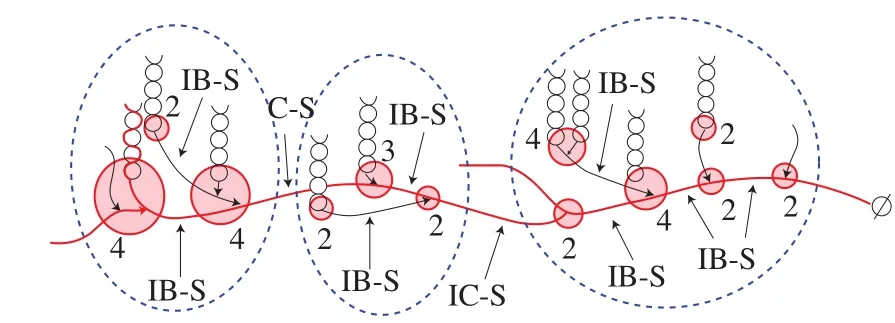
图3 构造单元骨架结构的示意图Fig. 3 Schematic representation of the building block backbone structure
构造单元骨架模型中明确指出簇是由更小的构造单元所组成,在骨架模型的实际基本结构单元是构造单元,而不是簇(图3)[58]。图3的构造单元骨架模型中AP大部分外链形成的双螺旋以几乎垂直的方向连接在骨架上,这表明AP的BL链是骨架的主要部分,可能没有参与形成双螺旋,而BS链主要是骨架的侧链以及构造单元相互连接的链段。簇内构造单元与构造单元之间距离一般小于9 个葡萄糖单位即IB-S的DP小于9,簇与簇之间链段(intercluster segments,IC-S)的DP不大于9。此外,每个簇内额外连接在骨架上的构造单元的内部链长DP增加,较IB-S(DP约5~7)的大,这说明簇内存在长链。一般认为,随着构造单元大小的增加,B链的长度增加。此外,构造单元的分支度高,且随着单元的尺寸增加而显著增加[58-59]。
2.3 AP的结构层次
2.3.1 AP的单元链
AP的多分支结构通常用单元链的链长及分布来表征,其结果一般以簇模型中不同类型链段的组成来进行描述。AP单元链分布通常是采用异淀粉酶、普鲁兰酶对样品进行脱支处理后经GPC、SEC、高效阴离子交换色谱-脉冲安培检测法(high performance anion exchange chromatography with pulsed amperometric detector,HPAEC-PAD)、荧光辅助糖电泳法(fluorophore-assisted carbohydrate electrophoresis,FACE)等手段进行分析。
研究发现,几乎所有来源的AP基本上都含有主要的短链组分(DP 6~36)和少量的长链组分(DP>36),但来源不同的AP在分支点的位置、分支链长度等方面均存在极大的差异[3]。大多数AP短链的峰值DP为11~15,长链的峰值DP为43~50[60]。不同植物来源AP的短链含量/长链含量为4.4~22,通常情况下,A型结晶淀粉(尤其是谷类淀粉)的短链/长链高达10~22,而B型仅为4.4~8,这使得B型淀粉的平均链长较A型更长[3,61]。此外,高直链AP所含有的长链数量通常较普通AP更多,较多或较长的长链可能是ae淀粉AP的典型特征[50,62]。
Hanashiro等采用HPAEC比较了不同植物来源AP的单元链分布,发现以DP 12为一个特定周期进行分布,由此建议根据簇结构的单元链分布模式可将AP各分支单元链区分为fa(DP 6~12即A链)、fb1(DP 13~24即B1短链)、fb2(DP 25~36即B2链)、fb3(DP>36即B3链)[45]。需要注意的是这样的链级分划分会使得A链∶B链比真实值偏小,因为所获得的A链只是AP中的一部分。不同来源AP的A链:B链不同,约0.8~1.4[61]。研究认为,短链簇与淀粉结晶类型及其AP的链长有关,A型淀粉中短链簇含量高其链长短,反之亦然。同时,DP为6~8的最短链分布模式是许多天然存在A型、B型淀粉AP所特有的,即A链典型的指纹区(“fingerprint” A-chains,Afp),其特性可以表征植物的来源。这些Afp短外链可能引发了结晶结构的缺陷,妨碍了淀粉颗粒结晶片层的排列堆积,而不是参与了双螺旋结构利于结晶的形成[62-63]。与山药相比,马铃薯和美人蕉更高含量的Afp表明其结构缺陷程度更大,这可以解释其更低的糊化温度[64]。
一些AP超长链(DP约为100)在玉米、小麦、燕麦、大米、马铃薯和木薯淀粉中被发现,每个AP大分子仅有1 条或几条超长链,一般质量分数为1%~10%,这些超长链大多是一类有较长或较短外链的B链[65]。通常认为参与AM合成的颗粒结合淀粉合成酶是AP超长链合成的原因,且蜡质淀粉AP中并没有发现超长链[66-67]。由于超长链有几百个葡萄糖残基相应的DP被认为具有AM链的性质,可能导致碘亲和力或脱支淀粉样品测链段组成时得到的AM含量过高[2]。
对于AP的C链分布,学者Hanashiro等在几种植物淀粉AP脱支前预先用荧光染料2-氨基吡啶标记了还原末端,然后经SEC分析发现大多数AP带荧光的C链其DP在10~130之间,且在DP 38~43附近有一特征峰。然而,山药AP的特征峰在DP 49,高直链玉米AP的特征峰在DP 80,还有一些样品的特征峰在DP 21~25。由于每个AP分子有且只有一条C链,但整体所显示出较宽的分子尺寸分布则表明来自于单个AP分子中的C链尺寸差异很大[68]。
2.3.2 AP的内部单元链
AP外链指的是从最外层的分支点延伸到非还原性末端的链段,内链则被定义为AP分支间的链段。所有A链都是外链,因其完全位于最外面的分支,而所有B链既有外链部分又有内链部分[48]。由于AP单元链的链长分布及链段组成并不能描述这些链段的组织排列,AP的内部结构需要通过分支极限糊精(limit dextrin,LD)的单元链特性来了解。此外,AP的平均外链长度(average external chain length,ECL)、平均内链长(average internal chain length,ICL)也需要结合AP与极限糊精单元链结构的差异来计算。采用淀粉酶对AP进行限制性水解可以获得带分支结构特性的极限糊精,便于采用色谱法分析AP分子的特征性链段。
Bertoft等所发展的表征AP内部单元链特性的基本思路如下:1)采用α-淀粉酶限制性水解有效地释放淀粉的簇,得到α-分支糊精;2)进一步采用兔肌磷酸化酶a、β-淀粉酶依次去除α-分支糊精的外链得到φ,β-LDs;3)φ,β-LDs簇经α-淀粉酶进一步充分水解,获得比簇尺寸更小、分支模式更紧密的构造单元;4)采用异淀粉酶、普鲁兰酶对φ,β-LDs或构造单元进行脱支,并以GPC、HPAEC-PAD来表征其链段组成[37,69]。如果分析样品是全淀粉,则用β-淀粉酶去除其α-分支糊精的外部链段得到β-LDs,再次采用α-淀粉酶对簇进行深度水解以释放小的、紧密的分支构造单元[70]。
在采用多种淀粉酶差异性水解制备簇及其构造单元的进程中,线性直链分子链段逐渐变短,最终产物仅含麦芽糖和麦芽三糖。支化淀粉分子经α水解得到α-分支糊精的外部链段能够被β-淀粉酶或者是兔肌磷酸化酶a和β-淀粉酶除去,得到β-LDs(全淀粉)或φ,β-LDs(分离得到的AP),再次采用α-淀粉酶对簇进行深度水解则能释放小的、紧密的分支构造单元。根据簇及其构造单元的结构差异能够获得簇中分支构造单元的相互联系和组成[1,70]。同时,不同植物淀粉AP及其φ,β-LDs簇有着同样的单元链组成(即短链、长B2链、长B3链),这说明单元链的分布是源于自身在大分子内部结构的链长度,且外部链段的链长是一致的。不同来源AP有着不同的外链长和内链长,ECL为10.7~15,ICL只有4.4~8(即分支点之间的链段长度),总内链长TICL为12~19.9(含有B链中除外部的链段)[3,61]。基于φ,β-LDs簇中短链的尺寸分布特性,DP 3~7(峰值DP为5或6)的短B链被认为是一个植物来源AP的特征区,即B链的“指纹区”(“fingerprint” B-chains,Bfp),而短B链的主要组成链段(DP 8~25)则被称为BS major-chains[61]。
Bertoft等基于AP的内部单元链特性(即φ,β-LDs的单元链分布)将淀粉样品分为4 个典型的结构类型。具有A型结晶的大麦、黑麦和燕麦淀粉通常属于第1类,其AP含有极少的长B链,短B链∶长B链DP比约为7.3~9.4,且因短B链尺寸分布宽泛,二者在色谱图中难以明确区分,根据颗粒的结晶性质及其AP的结构类型可将这类淀粉标记为“A∶1”型[61]。第2类AP的短B链尺寸分布相对较窄,与长B链在DP 23附近区分开,短B链与长B链的物质的量之比约为4.4~6.8。有更多长B链的第2类AP在A型、C型淀粉中均有发现,玉米、大米和穇子属于“A∶2”型,野葛和西米棕榈则属于“C∶2”型[61]。第1、2类AP的内部链分布均有明显的Bfp链段峰,玉米、大米等部分谷物淀粉的Bfp链质量分数高达20%。第3类AP的长B链较第2类的更多,但其Bfp链更少,短B链与长B链的物质的量之比约为3.7~4.7。据报道,竹芋淀粉为“C∶3”型,木薯、绿豆淀粉则属于“A∶3”型[61]。几乎所有的B型淀粉(马铃薯、美人蕉、山药等)均为第4类AP,有着较第3类AP更高含量的长链(尤其是长B3链)而被区分,短B链与长B链的物质的量之比约为2.3~3.0[61]。该学者还指出AP的这4种类型划分并不是绝对的,某些淀粉的某些结构特征可能与2 个类型均有联系和差异。在随后的研究中,红薯淀粉AP的结构被认为介于第2、3类之间[71],小麦AP结构则介于第1、2类之间[72]。就现有研究来看,正常生物合成的普通淀粉可以根据上述结构进行分类,而突变株淀粉的结构类型难以确定。
2.3.3 AP的构造单元
AP结构类型的划分是基于内部单元链分布,这表明AP的内部结构体现了簇单元的尺寸和结构,而簇的结构特征则是构造单元的组成。构造单元被认为是AP的最小分支单元,可通过α-淀粉酶深度水解φ,β-LDs(AP)或β-LDs(全淀粉)获得[73]。
AP构造单元的DP约为5~45,最小的构造单元DP为1~6,一般是单独的分支结构,仅由2 条链段组成,即group 2。group 3、group 4、group 5的DP依次为6~12、12~24、24~36。group 6的结构最为复杂,平均组成链段有10~12 条,DP大于36。现有研究所发现的最大构造单元与最小的簇尺寸相当,但其分支更为紧密,分支度高达16%~23%(簇12%~15%),ICL仅为1~3[74-75]。
研究发现几乎所有淀粉的构造单元均含有group 2~6,构成比例依次是group 2(46.2%~64.4%)>group 3(22.4%~30.5%)>group 4(7.0%~12.5%)>group 5(3.9%~9.7%)>group 6(0.5%~0.8%),具体组成因淀粉的植物来源、合成部位以及成长阶段等的差异而不同[69,74,76]。大的构造单元(group 5、group 6)被认为具有与簇基本一致的性质,可能可以用于分析不同来源淀粉的典型特征指纹区,且在淀粉生物合成中可能对无定形区的形成起着很重要的作用[72]。簇内分支构造单元的组间链长(average interblock chain length,IB-CL)与簇的构造单元数量(average number of building blocks in the cluster,NBbl)是描述构造单元在簇内排列的重要结构参数,其中IB-CL被定义为簇内相邻构造单元之间链段的长度。二者均与AP的结构类型密切相关。第1类AP的IB-CL最短(DP 5.5~5.9),其NBbl最多(DP 5.5~6.4);而第4类AP的IB-CL最长(DP 7~8),其NBbl最少(DP 3.7~3.9);第2、3类AP介于第1、4类AP之间。由此可以认为,第1、2类AP较第3、4类AP的簇尺寸更大,构造单元数量更多,IB-CL,即其骨架相对分支化程度更高[77]。目前,已有研究初步证实AP簇内构造单元的ECL、IB-CL、NBbl等结构参数与糊化参数存在相关性,并指出AP分支链段的内部排列决定了淀粉结晶晶格内链的排列,从而决定了淀粉颗粒的热特性[3]。现有研究虽然认为构造单元的精细结构及其在AP中的组织排列与淀粉特定的性质与功能有关[1,3],但其具体的分子结构及其对淀粉颗粒体系的影响尚待探究。
3 结 语
近年来,由于现代分析仪器和技术的高速发展,淀粉的结构研究取得了非常大的进展。AP、AM在淀粉中的组成比例、AP的分支结构在一定程度上决定了淀粉颗粒的理化性质和功能特性,这些特性对淀粉及淀粉质原料在食品工业中的应用影响很大。但现如今对于分子链结构研究大多集中在AP上,而对于AM的研究大多停留在分子质量等方面,对于其分子链结构、分支结构等研究较少。同时,在富含淀粉的植物生长过程各阶段,淀粉中AM及AP的结构及构造单元的变化情况及对淀粉结构的影响等方面的研究也较缺乏,而这对于理解淀粉结构的形成过程及分子结构特点具有非常重要的借鉴意义。因此,探寻更加准确、合理的AM和AP分子结构模型及高效的检测手段是目前的主要研究方向之一。关于AM及AP的分子结构大多集中在链长、构造模型及对淀粉性质的影响方面,对于两者在淀粉中的结合状态及模式等方面还有待更加深入,从而便于研究者更好地理解淀粉结构及功能特性间的关系。
——中核工程创新驱动改革,奋力打造核工程产业链“链长”

