CP4-EPSPS蛋白抗体的制备及其夹心ELISA定量检测方法的建立
,*
(1.吉林农业大学食品科学与工程学院,吉林长春 130118;2.吉林省农业科学院,吉林长春 136100)
转基因作物与传统作物相比,具有抗逆性强、产量高等特点,为解决当前世界“粮食危机”作出了贡献[1-2];草甘膦(glyphosate)又称农达,是一种低毒广谱除草剂[3]。从土壤农杆菌株CP4中分离得到抗草甘膦基因Epsps,其编码的CP4-EPSPS蛋白对草甘膦具有高抗性而被广泛应用于转基因大豆,使大豆过量表达EPSPS蛋白,赋予大豆草甘膦抗性[4-5]。目前,转Cp4 epsps基因抗除草剂大豆是世界上种植面积最大的转基因作物[6],我国是世界上最大的大豆进口国,每年都要从美国、巴西、阿根廷等国进口大量的转基因大豆[7]。随着转基因作物种类的增加及其产品的大规模商业化,使得人们对转基因农产品的安全性产生一定的质疑[8],监管部门、企事业单位、科研单位和消费者对转基因检测产品提出更高的要求。因此,建立一种快速转基因大豆及其产品的鉴定方法是十分必要的[6-8]。
我国目前对转Cp4 epsps基因大豆的检测技术主要分为两大类,基于外源核酸成分和外源蛋白靶标的检测技术。目前,检测效果最直观的是对基因编码的外源蛋白进行检测[9-12]。酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)是基于外源蛋白检测的常规检测方法,它具有操作简便、重复性好、特异性强、灵敏度高、耗时短、成本低等特点[13-16]。由于该方法对检测环境、操作方法等要求低,所以适合基层广泛推广应用[17-19]。
本研究利用表达纯化的CP4-EPSPS可溶性蛋白免疫BALB/c小鼠和绵羊,制备鼠单克隆抗体和羊多克隆抗体,并建立CP4-EPSPS蛋白双抗夹心ELISA检测方法。通过对该方法工作条件的优化,提高该检测方法的准确性及灵敏度,以期为CP4-EPSPS蛋白定量检测试剂盒的开发提供一定基础。
1 材料与方法
1.1 材料与仪器
PAT蛋白、Cp4 epsps工程表达菌株 本实验室保存;6~8周龄BALB/c小鼠 辽宁省实验动物资源中心;Cp4 epsps转基因大豆、非转基因大豆 吉林省农业科学院农业生物技术研究所;弗氏佐剂、辣根过氧化物酶(HRP)标记兔抗小鼠IgG和兔抗绵羊IgG Sigma公司;脱脂奶粉、硫酸卡那霉素 生工生物工程(上海)股份有限公司;Ni-NTA-琼脂糖亲和层析柱 上海意弘生物科技有限公司;抗体亲和介质Protein G Sepharose 4Fast Flow 上海羽朵生物科技有限公司;双组分TMB显色液、DAB显色试剂盒、BCA蛋白定量试剂盒 北京索莱宝科技有限公司。
CO2恒温培养箱 日本三洋公司;EL-X800酶标仪 美国BIO-RAD仪器有限公司。
1.2 实验方法
1.2.1 CP4-EPSPS蛋白纯化 复苏实验室保存的Cp4 epsps表达菌,用LB液体培养基(含终浓度为50 ng/mL的硫酸卡那霉素)37 ℃振荡培养至OD600值达到0.6,加入终浓度为1 mmol/L的IPTG,摇床180 r/min,37 ℃诱导4 h;诱导后菌体用PBS重悬3次,超声波破碎菌悬液,12000 r/min离心20 min,取上清经Ni-NTA-琼脂糖亲和层析柱纯化后获得可溶性CP4-EPSPS蛋白[20],SDS-PAGE分析蛋白纯化效果[20],BCA蛋白试剂盒对其定量。
1.2.2 CP4-EPSPS单克隆抗体的制备 单克隆抗体的制备参照文献[20]的标准程序进行。将纯化的CP4-EPSPS蛋白与弗氏佐剂混合,以100 μg/只经肌肉注射免疫BALB/c小鼠,两周免疫1次,免疫3次,在细胞融合前3 d加强免疫1次,200 μg/只。以重组蛋白CP4-EPSPS和转Cp4 epsps基因大豆叶片粗提物为抗原,筛选CP4-EPSPS特异性单克隆抗体。Protein G柱纯化制备的单抗[21],SDS-PAGE分析抗体纯化效果[22],BCA蛋白试剂盒对其定量。
1.2.3 CP4-EPSPS多克隆抗体的制备 将纯化后的可溶性CP4-EPSPS蛋白与弗氏佐剂混合肌肉多点注射免疫3只绵羊,两周免疫一次,2 mg/只。免疫3次后颈静脉采血,4 ℃,4000 r/min离心30 min,分离血清[22]。Protein G柱纯化羊抗血清,SDS-PAGE分析抗体纯度,BCA蛋白试剂盒测定纯化后抗体浓度。
1.2.4 Western blot分析抗体特异性 纯化的CP4-EPSPS蛋白经SDS-PAGE电泳后转印至PVDF膜上,以制备的鼠单抗和羊多抗为一抗(1∶5000稀释),HRP标记的兔抗小鼠IgG和兔抗绵羊IgG为二抗(1∶10000稀释),对抗体的特异性进行Western blot分析。
1.2.5 双抗夹心ELISA方法的建立 将制备的单抗包被96孔酶标板,100 μL/孔,4 ℃静置过夜;加入5%脱脂奶250 μL/孔,37 ℃封闭30 min;加待测抗原100 μL/孔,20 ℃,静置孵育1 h;加检测抗体100 μL/孔,20 ℃,静置孵育1 h,以上每一步操作结束后PBST洗涤3遍;TMB显色液90 μL/孔,避光显色30 min;2 mol/L H2SO4溶液45 μL/孔,终止反应;酶标仪测定OD450处吸光度值。根据公式:OD450待测抗原(P值)/OD450阴性抗原(N值)≥2.1判定检测结果为阳性。
以上实验重复3次,同时设置阳性、阴性、空白(阳性为CP4-EPSPS蛋白;阴性为PAT蛋白;空白为去离子水)3个对照。
1.2.6 双抗夹心ELISA工作条件的优化 检测抗体的筛选:采用间接ELISA对制备的3份CP4-EPSPS蛋白羊抗血清进行效价检测,以免疫前羊血清为阴性血清,包被1 μg/mL CP4-EPSPS蛋白,一抗为倍比稀释的羊血清,二抗为HRP标记的兔抗绵羊IgG,选择效价最高的羊多抗血清为检测抗体,并由南京钟鼎生物技术有限公司进行HRP标记。
捕获抗体的筛选:运用双抗夹心ELISA方法对5株单克隆抗体进行筛选,以制备的5株CP4-EPSPS单克隆抗体分别为作为捕获抗体,包被96孔酶标板,HRP标记的多抗为检测抗体,待测抗原20 ℃静置孵育15 min,选择P/N最大值对应的单抗为捕获抗体。
抗体工作浓度优化:通过矩阵滴定法[20]确定捕获抗体和检测抗体的最佳工作浓度。抗原、抗体孵育条件优化:运用双抗夹心ELISA方法分别优化捕获抗体、抗原及检测抗体的孵育条件,以P/N最大值确定最佳孵育条件[23-24]。
1.2.8 重复性试验 分别采集4份转Cp4 epsps基因大豆叶片和籽粒,用10倍体积PBS缓冲液研磨,12000 r/min离心5 min,取上清,运用建立的双抗夹心ELISA方法检测,每份材料3个平行,根据P/N值计算出板内、板间标准差及其变异系数[26]。
1.2.9 检测转Cp4 epsps基因抗除草剂大豆 采集转Cp4 epsps基因大豆结荚期的根、茎、叶、种子各10份,每个样品3个重复,用10倍体积PBS缓冲液研磨,12000 r/min离心5 min,取上清,运用建立的双抗夹心ELISA方法检测CP4-EPSPS蛋白表达量。
1.3 数据处理
使用 Excel 2010对原始数据进行初步分析并绘制相关图形。显著性差异分析采用SPSS 23.0软件。
2 结果与分析
2.1 CP4-EPSPS蛋白的SDS-PAGE分析
利用Ni-NTA-琼脂糖亲和层析柱对可溶性表达的CP4-EPSPS蛋白进行纯化,如图1所示,在49 kDa处有清晰的蛋白条带。
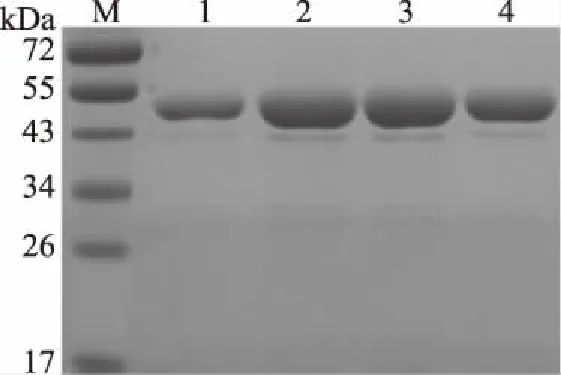
图1 CP4-EPSPS蛋白的SDS-PAGE分析Fig.1 SDS-PAGE analysis of CP4-EPSPS protein注:M:Marker;1~4:Ni-Native-100缓冲液依次洗脱下的4管CP4-EPSPS蛋白。
2.2 CP4-EPSPS蛋白抗体特异性分析
本研究共制备了5株单抗,分别为1D10、2D3、6A6、10H4、1D12,3份多抗分别为8092、7040、7038。如图2所示,抗体经Protein G柱纯化,SDS-PAGE显示有两条带,分别为免疫球蛋白G(IgG)的轻链(25 kDa)和重链(50 kDa)。由Western blot分析(如图3),5株单抗和3份多抗均能特异性识别CP4-EPSPS蛋白。

图2 抗CP4-EPSPS抗体纯化的SDS-PAGE分析Fig.2 SDS-PAGE analysis of purification of anti-CP4-EPSPS antibody注:M:Marker;1D10、2D3、6A6、10H4、1D12:单抗;7038、7040、8092:多抗。

图3 抗CP4-EPSPS抗体特异性Western blot鉴定Fig.3 Identification of anti-CP4-EPSPS antibody specific Western blot注:M:Marker;阴:为PAT蛋白;阳:CP4-EPSPS蛋白1D10、2D3、6A6、10H4、1D12:均为单抗;8092、7040、7038:均为多抗。
2.3 CP4-EPSPS蛋白双抗夹心ELISA检测方法的建立
对3份羊多抗血清效价进行测定,如图4所示,3只羊中,8092效价最高,效价为128000,因此,确定其为检测抗体。运用双抗夹心ELISA筛选捕获抗体,如表1所示,5株单克隆抗体中MAb 1D12 P/N值最大,表明MAb 1D12与多抗8092配对效果最佳,确定1D12为捕获抗体。采用矩阵滴定法筛选抗体的工作浓度,如表2所示,选择捕获抗体工作浓度为1.25 μg/mL,检测抗体工作浓度为2.5 μg/mL时为最优组合,在该工作浓度下,显色反应明显,阴性背景值低。对捕获抗体、抗原及检测抗体孵育条件进行优化,如图5、图6所示,捕获抗体4 ℃包被过夜、抗原20 ℃孵育45 min、检测抗体20 ℃孵育30 min时,P/N值最大,说明在该工作条件下,建立的CP4-EPSPS蛋白双抗夹心ELISA检测方法效果最佳。
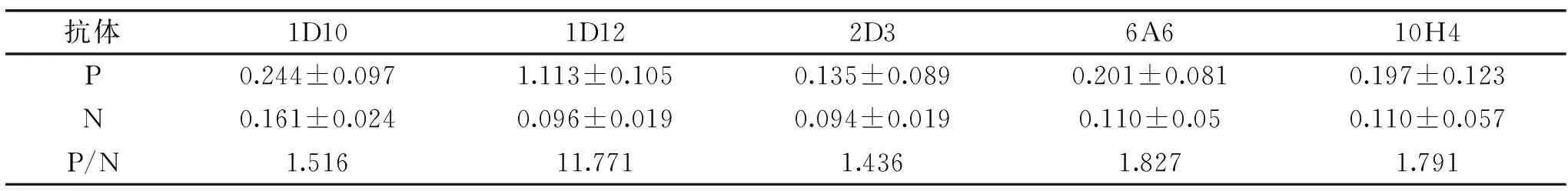
表1 捕获抗体的确定Table 1 Determination of capture antibody
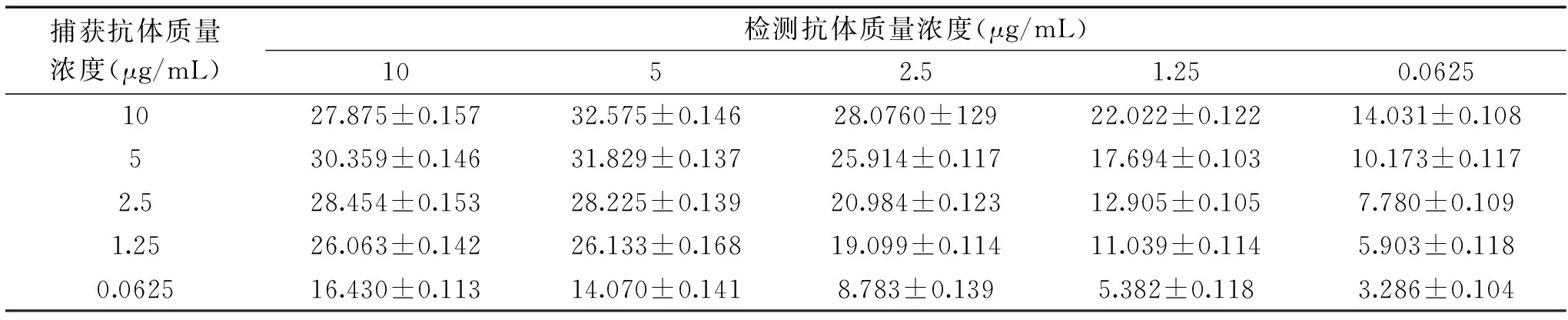
表2 抗体最佳工作浓度确定Table 2 Determination of optimum working concentration of antibody
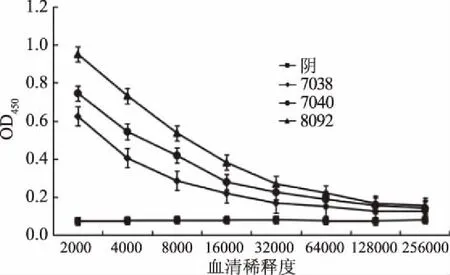
图4 多克隆抗体效价测定Fig.4 Detection of the titer of PAbs against CP4-EPSPS
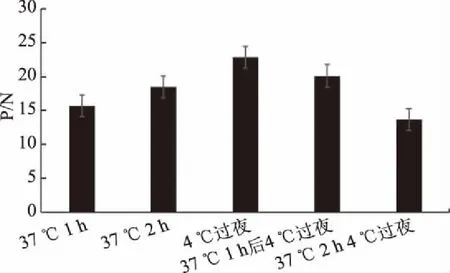
图5 捕获抗体孵育时间对检测结果的影响Fig.5 Effect of capture antibody incubation time on the results of detection
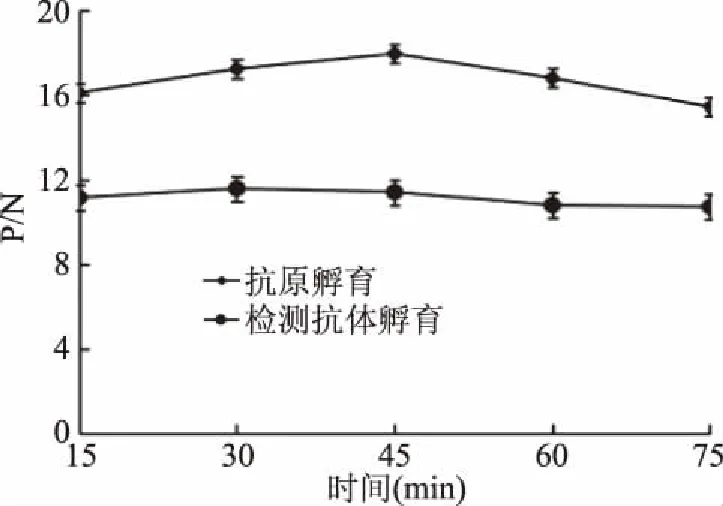
图6 抗原和检测抗体孵育时间对检测结果的影响Fig.6 Effect of antigen incubation time and detection antibody incubation time on test results
2.4 双抗夹心ELISA法的灵敏度

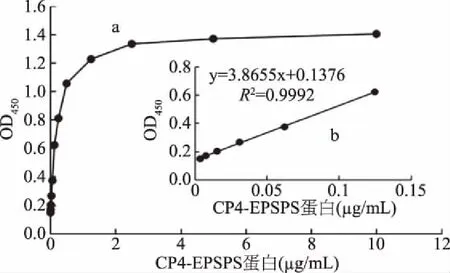
图7 双抗夹心ELISA标准曲线Fig.7 The standard curve of double antibody sandwich ELISA注:a:ELISA标准曲线;b:检测线。
2.5 重复性实验结果
如表3所示,对8份样品检测,板内变异系数为0.92%~7.98%,板间变异系数为2.09%~7.39%,均小于15%,表明建立的双抗夹心ELISA方法的重复性效果良好。
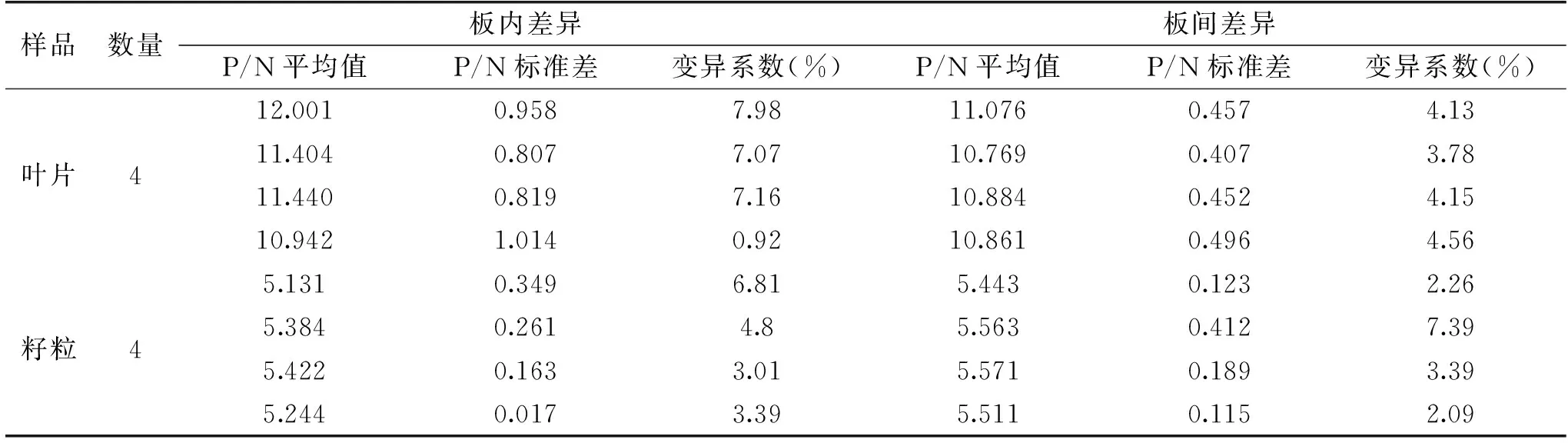
表3 重复性试验结果Table 3 Results of repetitive experiment
2.6 检测转Cp4 epsps基因抗除草剂大豆
本研究对转Cp4 epsps基因大豆材料的不同组织部位进行定量检测,表4数据显示,CP4-EPSPS蛋白在叶片中表达量最高,含量最高的为ZL-1大豆,平均达到306.118±3.976 μg/g,蛋白在同一大豆植株的茎、种子、根中表达量依次降低,且显著低于叶片表达量。不同大豆在同一组织部位蛋白表达量也存在差异,例如,蛋白在茎中表达量最高的是ZL-10大豆,平均达到230.252±4.081 μg/g,表达量最低的是ZL-7大豆,平均达到101.328±15.344 μg/g,表达量相差129 μg/g。综上所述,CP4-EPSPS蛋白在大豆植株内各部位均有表达,且表达量差异显著。
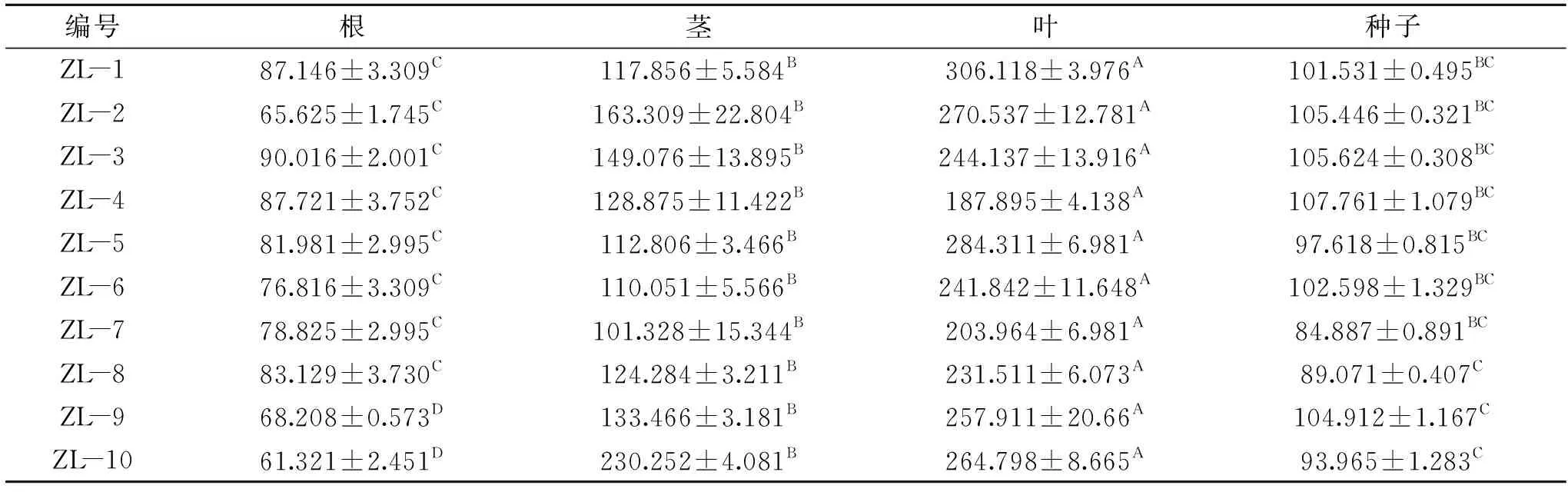
表4 大豆植株不同组织中CP4-EPSPS蛋白表达量(μg/g)Table 4 Expression of CP4-EPSPS protein in different tissues of soybean plants(μg/g)
3 结论与讨论
本研究成功建立了CP4-EPSPS蛋白双抗夹心ELISA定量检测方法,该方法最低检测限为3.6 ng/mL,检测范围为7.5~125 ng/mL;重复性变异系数小于15%。利用该方法定量检测转Cp4 epsps基因大豆的根、茎、叶和种子,发现CP4-EPSPS蛋白在根、茎、叶、种子中均有表达,且表达量存在差异。
本研究建立的检测方法中待测抗原及检测抗体的孵育温度均为20 ℃,在实际运用中,与同种类型的试剂盒相比,降低了对检测环境及设备的要求,同时,该检测方法中的检测抗体经HRP标记,简化了操作步骤,缩短了检测时间[27]。
目前,部分学者用2株单抗建立双抗夹心ELISA[28],本研究中用单抗和多抗建立双抗夹心ELISA,是因为CP4-EPSPS蛋白有多个抗原表位,单抗可以特异性识别并结合CP4-EPSPS蛋白上的一个抗原表位,有利于捕获抗原,而多抗可以识别并结合CP4-EPSPS蛋白上多个抗原表位,有助于放大检测信号;如选择单抗作为检测抗体,单抗识别的抗原表位可能被多抗占据,导致检测信号降低[23]。
目前,科研、海关、食品监督等部门对转基因生物的检测需求日益增多。所以建立一套转基因作物检测体系十分重要,本研究建立的CP4-EPSPS蛋白双抗夹心ELISA检测方法能够快速准确地定量检测转Cp4 epsps基因抗除草剂大豆,为开发CP4-EPSPS蛋白检测试剂盒和试纸条提供基础,同时为我国转基因检测的发展和我国转基因作物的推广研究提供技术支持。

