基于生物信息学分析哮喘患者鼻黏膜上皮细胞DNA及α肌动蛋白2甲基化差异性表达
张黎莎, 钱粉红
(江苏大学附属医院呼吸内科, 江苏 镇江 212001)
哮喘发病同时受环境及遗传因素影响[1]。DNA甲基化是表观遗传学的重要组成部分,也是哮喘发病中重要的生物学标志物[2]。研究发现,胎儿出生时全基因组DNA甲基化水平与儿童期哮喘风险相关,以及包括香烟烟雾或交通尾气暴露等多种变应原刺激可改变基因甲基化水平诱发哮喘[3-5]。然而,目前我国哮喘患者全基因组甲基化水平是否与健康者存在差异尚不清楚。
α肌动蛋白2(actin alpha 2,ACTA2)位于10号染色体,主要功能为编码肌动蛋白,在所有细胞中均有广泛表达。研究表明,ACTA2可通过影响细胞骨架功能促进肺腺癌侵袭和转移[6]。ACTA2基因突变或缺失可引起平滑肌收缩力减弱,此外,ACTA2表达降低可激活NF-κB,致IL-6表达升高[7-9]。但ACTA2甲基化水平与哮喘发病关系尚不清楚。因此,本研究首先对哮喘患者鼻黏膜上皮细胞全基因组DNA甲基化水平进行检测分析,其次对ACTA2基因在哮喘患者中的差异性甲基化表达进行研究,综合分析哮喘患者甲基化改变情况。
1 对象与方法
1.1 研究对象
1.1.1 全基因组甲基化测序(850K芯片)研究对象 选择2017年10月至2018年10月于江苏大学附属医院呼吸科门诊就诊的成人哮喘患者6例为哮喘组,另选择同期、同居住地、年龄相近、性别比例相似,且与哮喘组患者无直接血缘关系的健康体检者5例为对照组,一般资料如表1所示。本研究通过江苏大学附属医院伦理委员会批准,且受试者均已签署临床研究知情同意书。
1.1.2 ACTA2启动子检测分析[重亚硫酸盐法(BSP)]研究对象 选择2018年10月至2019年10月于江苏大学附属医院呼吸科门诊就诊的成人哮喘患者12例为哮喘组,另选择同期、同居住地、年龄相近、性别比例相近,且与哮喘组患者无直接血缘关系的健康体检者12例为对照组。研究对象一般资料如表2所示。
入组标准:年龄18~65岁;有明确哮喘诊断病史,符合支气管哮喘防治指南[10],且有明显胸闷或喘息等呼吸系统症状;无过敏性鼻炎病史,无明显流涕、鼻塞等鼻部症状,且近期无鼻腔给药史。排除标准:有明确肿瘤及化疗药物使用史;近1月内有上呼吸道感染病史;既往有心脑血管疾病;妊娠状态。
1.1.2 实验材料 鼻腔采样器Rhino-Pro®Curette(美国ASI公司);Ⅰ型胶原酶(美国Sigma公司);甲基化转化试剂盒(美国Zymo公司);动物组织/细胞基因组DNA提取试剂盒(上海索莱宝公司)。
1.2 全基因组甲基化测序
1.2.1 标本采样 清洁鼻腔并以少量生理盐水湿润鼻腔;以鼻刮匙于下鼻甲处反复轻刮5~10次;将鼻刮匙下端置入0.1%胶原酶中,震荡数分钟;37 ℃水浴消化1 h。
1.2.2 DNA提取及处理 将消化后所得细胞1 500 r/min常温离心5 min;取细胞沉淀,按照试剂盒说明书提取DNA,紫外分光光度计检测其总量大于2 μg,D(260 nm)/D(280 nm)≈1.8为合格标准。每份样本取1 μg DNA,按照甲基化转化试剂盒说明书操作。
1.2.3 甲基化850K芯片 芯片检测过程主要包括扩增、孵育、沉淀、杂交、洗脱等步骤,芯片结果导出后进行区域分析。具体实验操作委托上海天昊生物科技有限公司完成。
1.2.4 基因本体论(Gene Ontology,GO)分析 通过GCBI的在线实验室分析平台(https:∥www.gcbi.com.cn/gclib/html/index)对筛选获得的差异基因进行GO功能分析。
1.3 ACTA2启动子检测分析
1.3.1 引物设计 采用Primer3对处理之后的序列进行引物设计,上海天昊公司进行引物合成。ACTA2上游引物为5′-AGTGATAGATGTAAAATATAGGGTGATGG-3′,下游引物5′-ACTAAACACACTAAAAAT-TTCAATATTCCTTT-3′。
1.3.2 BSP测序 重亚硫酸盐处理后进行多重PCR反应及Illumina Hiseq平台高通量测序,具体实验操作委托上海天昊生物科技有限公司完成。
1.4 统计学分析
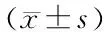
2 结果
2.1 全基因组甲基化测序结果
2.1.1 基本资料 如表1 所示,两组性别、年龄、BMI、外周血白细胞计数等等数据间差异无统计学意义(P均>0.05)。哮喘组FEV1/FVC(%)、FEV1pred(%)均明显低于健康对照组(P<0.05)。

表1 全基因组测序研究对象基本临床资料比较
2.1.2 差异性甲基化总体分布 此次一共检测除X、Y染色体外22条常染色体,共找到102 812个差异性甲基化位点,共涉及15 000余个基因。差异性甲基化位点在各染色体均有分布,且高甲基化与低甲基化改变可存在于同一条染色体。如图1所示,高甲基化位点共87 615个,低甲基化位点共15 197个。
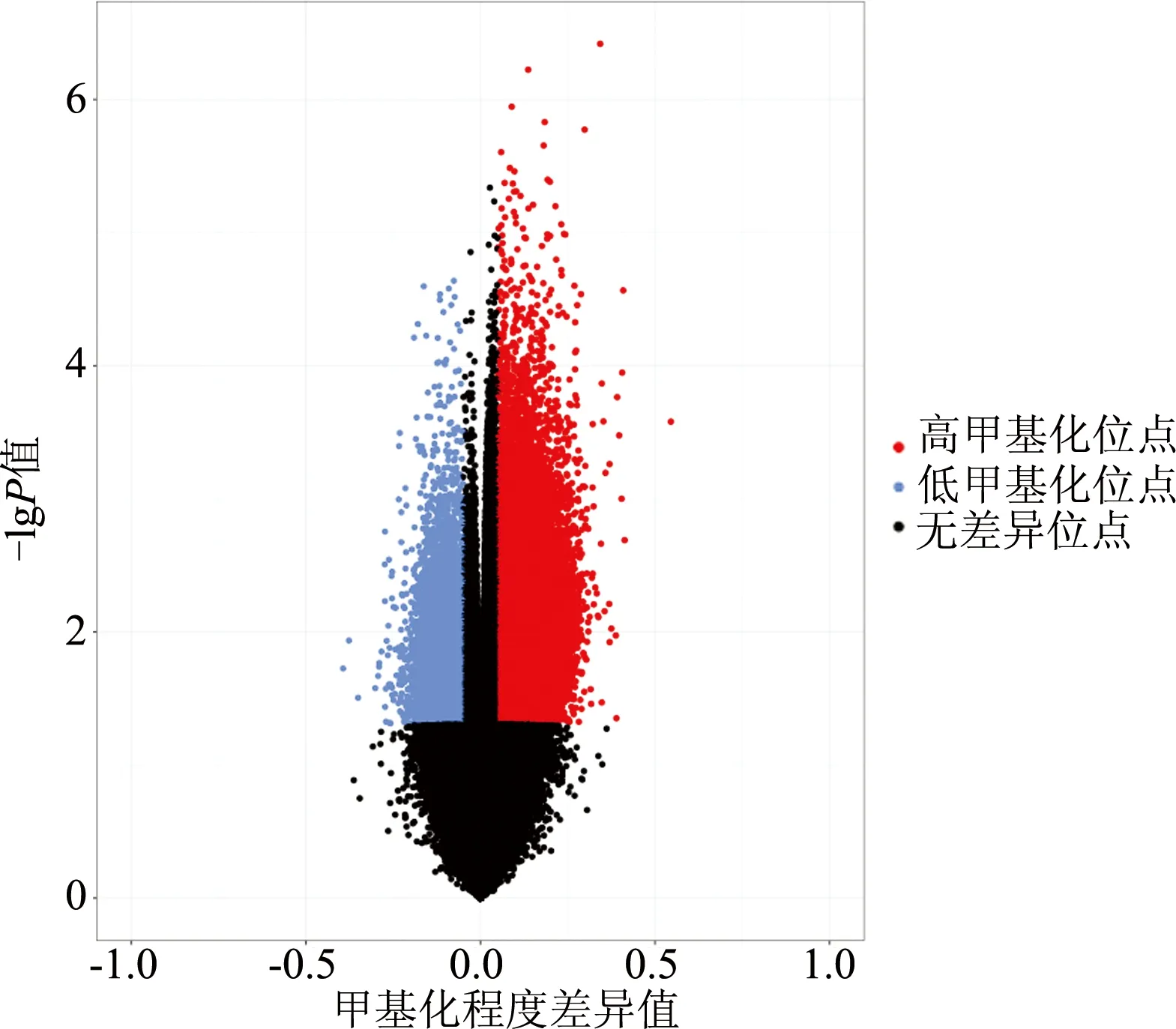
图1 差异性甲基化位点总体比例
2.1.3 甲基化区域在各功能区分布 本研究中检测所得的差异性甲基化区域绝大多数集中在基因体及基因间区,位于启动子区域的差异性甲基化位点占10%~20%,分布比例如图2所示。

1stExon:第一个外显子区域;3′UTR:3′UTR序列;5′UTR:5′UTR序列;Body:基因区域;ExonBnd:外显子区域;IGR:基因间区域;TSS1500:转录起始位点上游200~1 500 bp;TSS200:转录起始位点上游200 bp
2.1.4 GO分析 本研究中所涉及的GO功能分析包括三个方面:生物学过程、细胞组分、分子功能。哮喘患者鼻黏膜上皮细胞中相关的甲基化差异显著区域的GO富集结果分析如图3所示,其中包括了平滑肌细胞增殖及上皮管腔形成等各个方面。ACTA2基因与其中的血管平滑肌收缩、蛋白质磷酸化的正向调控、信号传感器的活动及线粒体功能等方面相关。

图3 全基因组差异性位点GO功能富集分析
2.2 ACTA2启动子检测分析
2.2.1 基本资料 如表2所示,两组性别、年龄、BMI、外周血白细胞计数等数据间差异无统计学意义(P均>0.05)。 哮喘组FEV1/FVC(%)、FEV1pred(%)均明显低于健康对照组(P<0.05)。

表2 BSP测序研究对象基本临床资料比较
2.2.2ACTA2启动子甲基化水平比较 如图4示,哮喘组ACTA2启动子区位点cg19791409甲基化水平明显高于健康对照组(Z=-3.233,P=0.001)。

图4 两组ACTA2启动子甲基化水平的比较
3 讨论
本研究采用850K甲基化芯片技术和BSP法分别对哮喘患者鼻黏膜上皮细胞中全基因组甲基化水平和ACTA2基因启动子区甲基化水平进行检测;结果显示,哮喘患者鼻黏膜上皮细胞全基因组中存在广泛甲基化,且不同基因的高甲基化和低甲基化改变可同时存在于各常染色体;其次,大多数甲基化改变发生在基因体或基因间区,仅有10%~20%的甲基化修饰发生在启动子区域,共涉及数千个不同基因。研究表明,启动子区高甲基化抑制基因表达[11],起到类似于基因沉默的作用,反之则上调基因表达。除启动子区外,基因其他功能区甲基化造成的影响还未有明确定论。有研究通过构建特殊的DNA片段的荧光素酶报告载体,人为改变基因启动子区甲基化水平,证实DNA甲基化程度能显著影响启动子区转录活性[12]。此外,有研究发现在哮喘儿童鼻黏膜上皮细胞中,存在多个与上皮屏障功能及免疫调节等相关基因(如FBXL7,NTRK1等)启动子区发生甲基化;且使用ROC曲线分析上述基因甲基化水平用于哮喘的诊断价值时,显示其曲线下面积>90%,准确率约为80%[13]。由此提示,鼻黏膜上皮细胞DNA甲基化程度与哮喘发病存在一定相关性。
本研究对出现启动子区差异性甲基化的基因进行GO分析,按P值分类排序后发现,与上皮管腔形成、平滑肌细胞增殖与调节等相关可能参与哮喘发病的基因,选取ACTA2作为目的基因,以BSP法对启动子区域甲基化位点水平进行定量检测分析,发现ACTA2基因启动子在哮喘患者中出现明显高甲基化改变。分析其机制可能为ACTA2启动子高甲基化抑制基因表达,使得其自身表达下调,激活NF-κB相关信号通路[7],或可通过减弱平滑肌细胞收缩力,引起平滑肌增生紊乱等途径导致哮喘发生[8]。
以往呼吸道疾病研究常以支气管上皮细胞为最佳标本,然而由于其采样过程为侵入性操作,哮喘患者不易接受。但是,本研究采用鼻黏膜上皮细胞进行哮喘研究,易于患者接受。有学者对哮喘患者的各种组织标本如鼻黏膜上皮细胞、血液、口腔上皮细胞、气道上皮细胞进行甲基化程度对比,结果显示鼻黏膜上皮细胞甲基化水平与支气管上皮最为相似,并优于传统使用的血液标本[14]。已有研究在哮喘患者的鼻黏膜上皮细胞中寻找到cg23602092、cg14830002、cg23602092等与哮喘症状及诱发因素相关的甲基化位点[15]。由此说明,鼻黏膜上皮细胞可作为哮喘甲基化研究的良好替代样本。本研究未阐述相关作用通路及具体作用机制,有待后期通过培养细胞,人工改变其甲基化水平来进一步研究。
总之,哮喘患者鼻黏膜上皮细胞中全基因组甲基化水平与健康者相比有明显差异,且ACTA2启动子甲基化水平明显升高,其具体作用机制仍需进一步研究。

