黄瓜幼苗光合荧光特性及根系抗氧化系统对外源肉桂酸的响应
马宁 陈碧 杨华
摘要:以津研4号黄瓜为试验材料,采用外源肉桂酸(CA)模拟自毒胁迫,研究水培方式下黄瓜幼苗生长发育、光合荧光特性和抗氧化系统对CA胁迫的响应。結果表明,外源CA处理可对黄瓜幼苗生长发育产生明显的抑制作用。当CA浓度为0.25 mmol/L时,处理4 d后黄瓜幼苗的株高和叶面积受到显著抑制,甚至造成部分死亡。黄瓜幼苗根系总根长、根表面积、根体积在CA浓度为0.25 mmol/L时分别比对照降低了19.9%、31.7%、34.7%,随着CA浓度的增加,抑制作用逐渐增强。与对照相比,CA处理下的黄瓜幼苗净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、初始荧光(Fo)、最大荧光(Fm)、最大光化学效率(Fv/Fm)、有效光化学量子产量(ΦPSⅡ)、调节性能量耗散的量子产额YNPQ和光化学淬灭系数(qP)均呈降低趋势,而胞间CO2浓度(Ci)、非光化学淬灭系数(qN)和非调节性能量耗散的量子产额YNO则呈升高趋势。此外,随着CA浓度的升高,根系过氧化物酶(POD)活性不断升高,而超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)活性呈先升高后降低的趋势。说明CA处理会造成黄瓜幼苗光系统Ⅱ(PSⅡ)的损伤,使光合性能下降,同时促进活性氧(ROS)的积累和丙二醛(MDA)含量的增加,从而影响黄瓜幼苗正常的生长发育。
关键词:肉桂酸;黄瓜;光合作用;根系形态;抗氧化系统;叶绿素荧光参数;膜脂过氧化
黄瓜(Cucumis sativus L.),别称胡瓜、刺瓜,为葫芦科一年生蔓性植物,生长周期短,上市早,产量高,深受我国人民的喜爱,其栽培面积日益增大,特别在设施栽培中。但由于良好的经济效益和有限的土地利用面积,导致栽培中连作障碍普遍发生,致使黄瓜产量锐减和产品品质下降,抗病虫害能力减弱,严重制约了设施栽培的可持续发展。杨建霞等研究发现,导致连作障碍的因素主要有3个方面,一是根系分泌自毒物质,二是土壤营养失衡,三是土传致病菌的增加,其中植物自身释放的有毒物质可影响自身根系对矿质元素的吸收及致病菌的种类和数量[1-2],是导致连作障碍发生的主要因素。
许多蔬菜作物根系可分泌出酚酸类自毒物质,进而影响正常的生理代谢。前人已从番茄、辣椒、西瓜、黄瓜、甜瓜等多种蔬菜瓜果的根系分泌物中鉴定出包括苯甲酸、肉桂酸(CA)和对羟基苯甲酸等在内的10余种酚酸类物质,并表明这些物质对植株养分吸收有直接的阻碍作用[3]。有研究表明,通过外源添加自毒物质抑制作物根系生长、叶绿素合成及离子吸收能力,可影响作物的生长发育,在黄瓜[4-5]、豌豆[6]、茄子[7]、番茄[8]等作物连作研究中均有报道。CA是瓜类作物根系分泌物中的一种重要自毒物质,能诱导根系产生大量的活性氧(ROS),从而抑制植株根系生理活性,并破坏其他组织的结构,甚至危及到植株的生命,对植物的多种生理代谢有重要影响。Yu等研究发现,CA胁迫促使黄瓜根系中产生大量ROS,引起根尖细胞的大量死亡,从而抑制了根系的生长[4-5,9]。但目前关于黄瓜在CA处理下的根系抗氧化特性缺乏系统的研究。本试验采用水培的方式,以外源CA模拟自毒胁迫,研究黄瓜植株形态、光合荧光特性、根系抗氧化系统对CA胁迫的响应,旨在从光合荧光和抗氧化生理角度探明CA对黄瓜产生毒害的生理机制,为解决黄瓜连作障碍提供理论支撑。
1 材料与方法
1.1 试验材料
供试黄瓜(Cucumis sativus L.)品种为津研4号,试验于2017年3—9月在甘肃农业大学园艺学院实验室人工智能气候箱内进行。
1.2 试验设计
选取健壮饱满且形态一致的黄瓜种子温汤浸种后,置于28 ℃人工气候箱中在黑暗条件下催芽。当黄瓜子叶大部分露出或完全退掉种皮时,移入预先准备好的水培盒(1 L)内,每盒4株,采用日本山崎黄瓜专用营养液(800 mL)进行水培[10]。培养条件:昼/夜温度25 ℃/19 ℃,白天光照度为 256 μmol/(m2·s),光—暗周期为14 h—10 h,湿度为75%,营养液的pH值和电导率分别为6.5和 1.20 mS/cm。试验期间每2 d更换1次营养液。待幼苗长至2叶1心时,选取长势一致的黄瓜苗,进行CA处理,CA浓度分别为0、0.25、0.50和 1.00 mmol/L。CA采用无水乙醇助溶,为了保持试验的一致性,每个处理均加入等量的无水乙醇,浓度控制在0.1%(体积分数)左右,该浓度对黄瓜植株生长几乎没有影响[11]。分别于处理后0、2、4、6 d,选取长势均匀一致的黄瓜幼苗测定植株的形态;于处理后6 d,测定黄瓜幼苗的光合和叶绿素荧光参数,每处理测定20株。将黄瓜幼苗的地上部与根部分开,根系用去离子水清洗干净,用于根系形态测定;同时,选取根尖液氮处理后,置于-80 ℃超低温冰箱保存,用于抗氧化指标的测定[12]。
1.3 测定指标与方法
1.3.1 植株形态及死亡率的测定 用直尺测量根茎连接处到生长点的高度作为株高;用游标卡尺测定子叶下1.5 cm处的茎粗;测量功能叶的长与宽,根据公式计算总叶面积(S),叶面积=0.743×长×宽[13]。
对20株黄瓜幼苗进行动态观察,统计死亡株数,计算死亡率。
1.3.2 光合参数测定 采用CIRAS-2型(PP-system,UK)便携式光合仪测定从生长点向下数第3张真叶的光合指标。
1.3.3 叶绿素荧光参数测定 采用调制叶绿素荧光成像系统(MAXI Imaging-PAM,Walz,Effeltrich,Germany)测定叶绿素荧光参数。
1.3.4 根系形态及抗氧化指标的测定
1.3.4.1 根系形态 采用根系扫描仪(EPSON Scan,Canada)扫描根系,并用WinRHIZO Pro LA2400软件分析根系总长度、表面积、体积和根尖数等指标。
1.3.4.2 根系抗氧化酶活性 超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法[14],过氧化物酶(POD)活性测定采用愈创木酚法[15],过氧化氢酶(CAT)活性则采用过氧化氢法[16]测定,抗坏血酸过氧化物酶(APX)活性测定采用抗坏血酸法[12]。
1.3.4.3 膜脂过氧化程度 丙二醛(MDA)含量采用硫代巴比妥酸(TBA)比色法测定[17]。
1.3.4.4 活性氧(ROS) H2O2含量测定参照刘俊等的方法[18]。O-2·产生速率采用羟胺-对氨基苯磺酸法[19]测定。
1.4 数据处理
数据整理采用Excel 2010软件进行。采用IBM SPSS Statistics 22.0统计分析软件对数据进行分析,显著性检验水平设为0.05。
2 结果与分析
2.1 CA处理对黄瓜幼苗植株形态及死亡率的影响
植物根系通过吸收矿质营养、利用光合作用合成碳水化合物,积累干物质,干物质积累量的大小直接反映在株高、茎粗和叶面积的变化上。由表1、图1可知,随着CA浓度和处理时间的增加,黄瓜幼苗的株高、茎粗、叶面积受到不同程度的抑制,死亡率不同程度上升。处理2 d后,各处理黄瓜幼苗均生长缓慢,且与对照差异不显著,但已经出现部分死亡现象,其中 0.25 mmol/L 处理的黄瓜幼苗死亡率为10.0%,0.50 mmol/L和1.00 mmol/L处理的黄瓜幼苗死亡率达到30%。处理4 d后,0.25 mmol/L 处理黄瓜幼苗的株高和叶面积分别比对照降低36.9%和37.2%,幼苗死亡率升高至20.0%,表现出显著的抑制作用;此时,0.50 mmol/L和1.00 mmol/L处理的黄瓜幼苗死亡率分别达到 50.0% 和60.0%。处理6 d后,与对照相比,0.25 mmol/L 处理的黄瓜幼苗株高、茎粗和叶面积均被抑制,分别下降43.2%、7.9%和27.9%。0.50 mmol/L 和1.00 mmol/L处理的黄瓜幼苗死亡率高达50.0%和80.0%。
2.2 CA处理6 d后黄瓜幼苗根系形态参数的变化
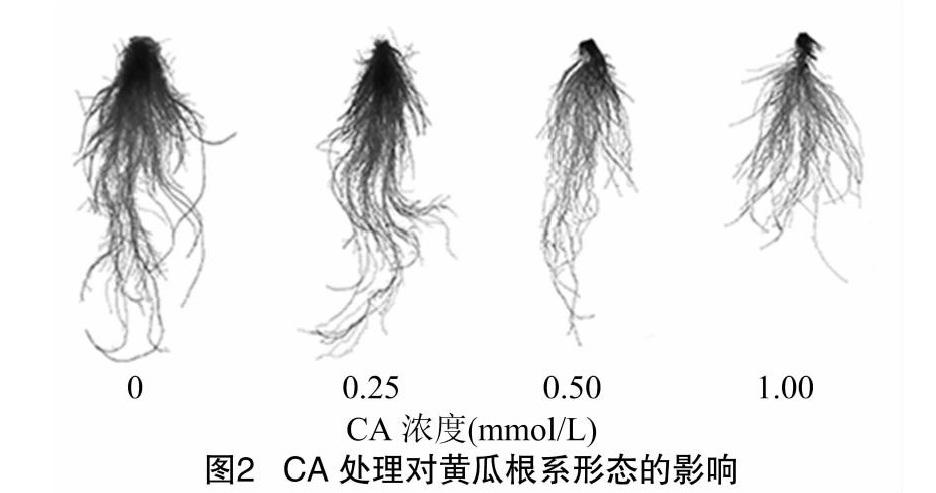
由表2可知,黄瓜根系的总根长、根表面积、根体积及根尖数在CA处理下均表现出胁迫效应。与对照相比,不同浓度CA处理均显著减小了黄瓜的总根长、根表面积和根体积,当浓度为1.00 mmol/L时,分别比对照降低了30.7%、48.1%和63.0%。0.25 mmol/L 处理显著增加了黄瓜根尖数,高于对照54.4%;而1.00 mmol/L处理则显著减少了黄瓜根尖数,低于对照45.5%。随着CA处理浓度的增加,黄瓜幼苗根系逐渐变弱,主根长逐渐减小(图2)。
2.3 CA处理对黄瓜叶片光合参数的影响
光合作用是植物体内能量运转以及积累有机生物量的必要途径。从图3可以看出,CA處理可显著影响黄瓜幼苗的光合性能。随着CA处理浓度的增大,黄瓜幼苗的Pn、Tr和Gs不断降低,0.25、0.50、1.00 mmol/L处理的黄瓜Pn分别比对照下降79.8%、91.9%、96.5%,Tr分别下降58.0%、65.5% 、66.1%,Gs分别下降77.3%、82.8%、83.5%。但Ci则随着CA浓度的升高呈先升高后降低的趋势,与对照相比,CA浓度为0.50 mmol/L时差异达到显著水平,较对照增加15.1%。
2.4 CA处理6 d后黄瓜幼苗叶绿素荧光参数变化
如表3所示,CA处理6 d后,与对照相比,黄瓜幼苗的Fo和Fm均显著降低。Fv/Fm随着CA浓度的升高呈下降趋势,0.25、0.50、1.00 mmol/L处理分别比对照下降了7.9%、25.0%、43.8%。CA对黄瓜幼苗的ΦPSⅡ和YNPQ的影响表现为随处理浓度的升高呈现下降趋势,说明随着处理浓度升高CA抑制效应增强。结果表明,不同浓度CA处理均可提高黄瓜幼苗的YNO,0.25、0.50、1.00 mmol/L处理分别比对照升高了15.0%、44.4%、73.5%。CA处理的黄瓜幼苗qN均明显上升,而qP则均显著下降,且随着处理浓度的增加,变化幅度增大。说明CA处理会造成黄瓜幼苗光系统Ⅱ(PSⅡ)的损伤。
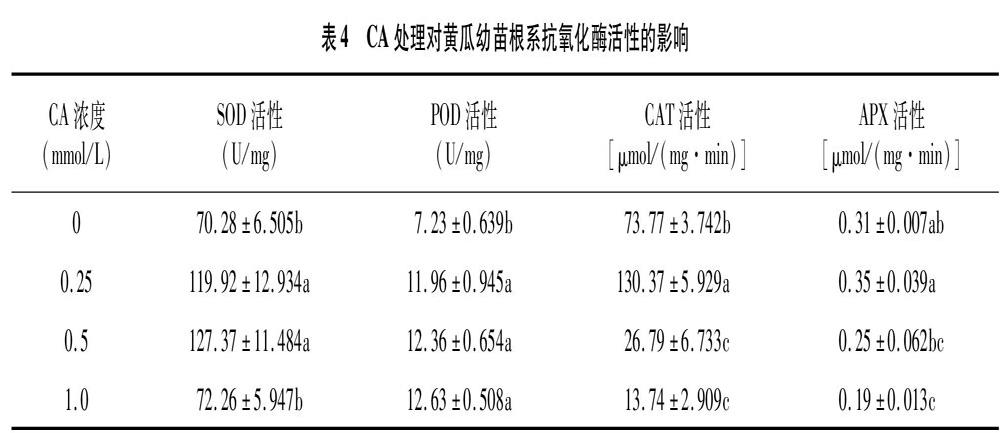
2.5 CA处理对黄瓜幼苗根系抗氧化酶活性的影响
由表4可知,在CA胁迫下,SOD、POD、CAT、APX活性大多较对照变化显著,其中,POD活性随着CA浓度的增加而增强,在CA浓度为 1.00 mmol/L 时,较对照增强74.7%。SOD、CAT、APX活性随着CA浓度的增加呈先升高后降低的趋势,当CA浓度为0.25 mmol/L时,CAT活性比对照组增强 76.7%,但随着CA浓度的增加,其活性急剧减弱,当浓度为1.00 mmol/L时,其活性强度仅为对照的18.6%;APX活性在CA浓度为0.25 mmol/L时较对照增加12.9%,而浓度为1.00 mmol/L时,其活性仅为对照的61.3%;SOD活性在CA浓度为 0.50 mmol/L 时达到最大值,其活性较对照组增强81.2%。
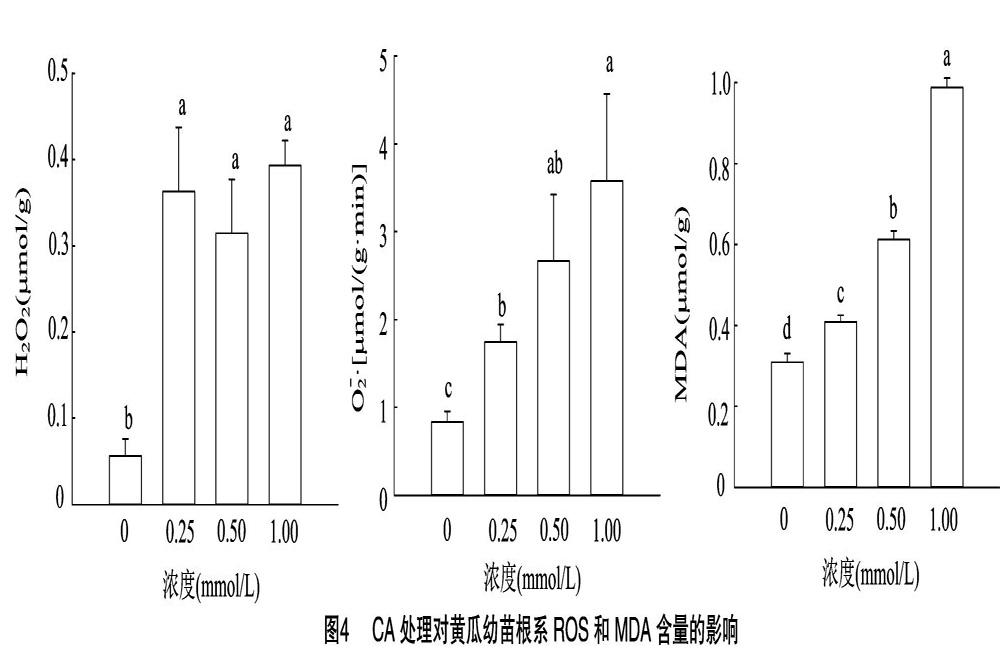
2.6 CA处理对黄瓜幼苗根系ROS和MDA含量的影响
由图4可知,在CA胁迫下,黄瓜幼苗根系的H2O2含量显著高于对照,CA浓度为0.50 mmol/L时黄瓜幼苗根系H2O2含量为对照的3.41倍,浓度为1.00 mmol/L时其H2O2含量是对照的4.13倍。根系中MDA含量同样随着CA浓度的升高而不断积累,当浓度为1.00 mmol/L时其含量为对照的 3.19 倍。随着CA浓度的增加,黄瓜幼苗根系的O-2·产生速率逐渐增加,0.25、0.50、1.00 mmol/L CA处理的O-2·产生速率分别是对照的2.10、3.20、4.30 倍。
3 讨论
光合速率是光合作用的重要指标,也是影响植物生物量积累的重要因素[20]。导致光合作用下降的原因既有气孔因素也有非气孔因素[21]。如果气孔限制占主导地位,则在Pn和Gs下降的同时,Ci也相应下降;如果非气孔限制占主导地位,则Pn和Gs下降的同时,Ci却上升[22]。本试验中,在不同浓度CA处理6 d后,黄瓜幼苗叶片Pn、Tr和Gs显著降低,而Ci却上升,推测是由于非气孔因素阻碍了CO2的利用,从而导致胞间CO2含量增加,表明植株受到CA胁迫后,光合作用减弱主要是由于受到了非气孔限制,与前人研究结果[23]一致。叶绿素荧光技术是快速无损伤研究逆境光合生理的理想方法[24],逆境胁迫通过影响植物叶绿素荧光特性,影响光合能力。许多逆境胁迫(如病毒、NaCl和低温胁迫等)[25-27]都会降低Fv/Fm,抑制PSⅡ活性,使植物叶片qP下降,降低其光能利用率,使光能以热能的形式耗散,促进qN上升,降低实际光化学量子产量。在本研究中,CA处理后黄瓜幼苗的Fv/Fm、YNPQ和qP均呈现下降趋势,而YNO和qN呈上升趋势,说明CA胁迫导致黄瓜幼苗接受光的能力减弱,过剩的光能以热的形式散失,光合活性下降,甚至遭受光损伤,与前人研究结果[28]相同。ΦPSⅡ代表的是实际量子产量,反映吸收的光量子供给PSⅡ反应中心的效率及开放反应中心的比例,即实际光合效率[29]。研究发现,高温胁迫可引起葡萄叶片ФPSⅡ的下降[30]。中度及重度干旱胁迫可显著降低油桐的ФPSⅡ[31]。本研究表明,CA处理可显著降低黄瓜幼苗的ФPSⅡ,且浓度为1.00 mmol/L时,黄瓜幼苗的ФPSⅡ较对照下降43.5%,与前人研究结果一致。
当保护酶活性显著降低时,保护酶将不能有效清除黄瓜幼苗在自毒胁迫下生成的氧自由基,使其内部O-2·的产生速率大于保护性酶清除O-2·的速率;同时,随着O-2·在体内的累积,植物受害程度逐渐加重,使各种保护性酶随之失活,从而出现一系列的连锁效应[32]。Roshchina等通过对高等作物(如大豆、小麦、生菜、莴苣等)的化感作用进行研究指出,化感物质抑制受体植物保护酶活性,导致体内ROS增多,造成膜脂过氧化[33]。本试验中,较低浓度的CA使保护性活性显著升高(P<0.05),与前人研究结果[34]相同,这可能是因为低浓度CA启动了植株体内保护机制,使酶活性提高,以便进行自我保护。许多逆境胁迫(如重金属、盐、干旱胁迫等)都会引起植物体内ROS的积累,导致MDA增加,引起膜系统的氧化损伤[35-37]。本研究结果表明,CA处理会造成黄瓜幼苗根系ROS积累,MDA含量增加。
4 结论
不同浓度的CA对黄瓜幼苗的生长可产生显著的抑制作用,且随着浓度的增大,抑制作用增强,甚至造成部分植株死亡。
黄瓜根系中CAT、APX、SOD活性随CA浓度的增大呈先增强后减弱的趋势,这可能是因为CA胁迫激发了植株体内防御系统,使酶活性提高进行自我保护。当CA浓度超过临界点后,由于植株体内H2O2和O-2·产生过快,导致其产生与清除平衡被打破,MDA产生量增加,造成膜质过氧化伤害,最终抑制植株生长。
CA处理会造成植株Pn、Gs和Tr下降,而Ci却上升,说明CA胁迫主要通过非气孔因素限制植株光合作用。
参考文献:
[1]杨建霞. 日光温室黄瓜连作障碍研究及防治对策[J]. 甘肃农业,2005(11):209.
[2]孙光闻,陈日远,刘厚诚. 设施蔬菜连作障碍原因及防治措施[J]. 农业工程学报,2005,21(增刊2):184-188.
[3]王延平,王华田. 植物根分泌的化感物质及其在土壤中的环境行为[J]. 土壤通报,2010,41(2):501-507.
[4]Yu J Q,Matsui Y. Phytotoxic substances in root exudates of cucumber(Cucumis sativus L.)[J]. Journal of Chemical Ecology,1994,20(1):21-31.
[5]吴凤芝. 外源酚酸对黄瓜自毒作用的生理生化机制研究[D]. 哈尔滨:东北农业大学,2002.
[6]高 旭,张古文,胡齐赞,等. 自毒物质肉桂酸对豌豆幼苗生长及叶绿素荧光特性的影响[J]. 中国蔬菜,2013(8):44-49.
[7]陈绍莉,周宝利,王茹华,等. 嫁接对茄子根系分泌物中肉桂酸和香草醛的调节效应[J]. 应用生态学报,2008,19(11):2394-2399.
[8]王茹华,曲光峰,张启发,等. 肉桂酸对番茄的化感效应研究[J]. 中国蔬菜,2014(3):29-32.
[9]Ding J,Sun Y,Xiao C L,et al. Physiological basis of different allelopathic reactions of cucumber and figleaf gourd plants to cinnamic acid[J]. Journal of Experimental Botany,2007,58(13):3765-3773.
[10]郭世榮. 无土栽培学[M]. 北京:中国农业出版社,2003:111-116.
[11]Yu J Q,Shou S Y,Qian Y R. Autotoxic potential of cucurbit crops[J]. Plant and Soil,2000,223:149-153.
[12]沈文飚,徐朗莱,叶茂炳,等. 抗坏血酸过氧化物酶活性测定的探讨[J]. 植物生理学通讯,1996,32(3):203-205.
[13]裴孝伯,李世诚,张福墁,等. 温室黄瓜叶面积计算及其与株高的相关性研究[J]. 中国农学通报,2005,21(8):80-82.
[14]黎瑞珍,杨庆建,陈贻锐. 超氧化物歧化酶(SOD)活性测定及其应用研究[J]. 琼州大学学报,2004,11(5):34-36.
[15]朱展才. 过氧化物酶活性的测定[J]. 粮食储藏,1985(3):29-31.
[16]李仕飞,刘世同,周建平,等. 分光光度法测定植物过氧化氢酶活性的研究[J]. 安徽农学通报,2007,13(2):72-73.
[17]王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006:280-281.
[18]刘 俊,吕 波,徐朗莱. 植物叶片中过氧化氢含量测定方法的改进[J]. 生物化学与生物物理进展,2000,27(5):548-551.
[19]Doke N. Involvement of superoxide anion generation in the hypersensitive response of potato tuber tissues to infection with an incompatible race of Phytophthora infestans and to the hyphal wall components[J]. Physiol Plant Pathology,1983,23(3):345-357.
[20]方 晶. 光强对温室黄瓜植株形态和光合特性的影响[J]. 安徽农业科学,2011,39(9):5047-5048.
[21]Farquhar G D,Sharky T D. Stomatal conductance andphotosynthesis[J]. Annual Review of Plant Physiology,1982,33:317-345.
[22]刘俊祥,孙振元,巨关升,等. 重金属Cd2+对结缕草叶片光合特性的影响[J]. 核农学报,2009,23(6):1050-1053.
[23]Allen D J,Ort D R. Impacts of chilling temperatures on photosynthesis in warm climate plants[J]. Trends in Plant Science,2001,6(1):36-42.
[24]吳 顺,张雪芹,蔡 燕. 干旱胁迫对黄瓜幼苗叶绿素含量和光合特性的影响[J]. 中国农学通报,2014,30(1):133-137.
[25]王春梅,施定基,朱水芳,等. 黄瓜花叶病毒对烟草叶片和叶绿体光合活性的影响[J]. 植物学报,2000,42(4):388-392.
[26]李汉美,何 勇. NaCl胁迫对番茄嫁接苗光合作用和叶绿素荧光特性的影响[J]. 西北农业学报,2013,22(3):131-134.
[27]高秀瑞,李 冰,高洪波,等. 低温胁迫对茄子幼苗光合特性和叶绿素荧光参数的影响[J]. 河北农业科学,2012,16(10):40-43.
[28]黄兴学. 豇豆连作土壤中自毒物质鉴定及肉桂酸对豇豆光合作用的影响[D]. 武汉:华中农业大学,2010.
[29]Krall J P,Edward G E. Relationship between photosystem Ⅱactivity and CO2 fixation in leaves[J]. Physiologia Plantarum,1992,86:180-187.
[30]卞凤娥,孙永江,牛彦杰. 高温胁迫下根施褪黑素对葡萄叶片叶绿素荧光特性的影响[J]. 植物生理学报,2017,53(2):257-263.
[31]李 泽,谭晓风,卢 锟,等. 干旱胁迫对两种油桐幼苗生长,气体交换及叶绿素荧光参数的影响[J]. 生态学报,2017,37(5):1515-1524.
[32]Politycka B. Peroxidase activity and lipid peroxidation in Roots of cucumber seedlings influenced by derivatives of cinnamic and benzoic acids[J]. Acta Physiol Plantarum,1996,18:365-370.
[33]Roshchina V V,Roshchina V D. The excretory function of higher plant[M]. New York:Springer,1993:213-215.
[34]乔永旭,张永平,高丽红. 根系边缘细胞对肉桂酸胁迫下黄瓜和黑籽南瓜活性氧代谢与根系活力的影响[J]. 中国农业科学,2015,48(8):1579-1587.
[35]张玉秀,柴团耀,Gerard B. 植物耐重金属机理研究进展[J]. 植物学报,1999,41(5):453-457.
[36]Ahmad P,Hashem A,Abd-Allah E F,et al. Role of Trichoderma harzianum in mitigating NaCl stress in Indian mustard(Brassica juncea L)through antioxidative defense system[J]. Frontiers in Plant Science,2015,6:868.
[37]牟雪姣,张 强,吴 燕,等. 外源CO对干旱胁迫下黄瓜种子萌发生长的缓解效应[J]. 华北农学报,2018,33(5):168-173.麻 浩,程志义,钱 芳,等. 竹柳种植新技术及其在荒漠和盐碱地中的应用[J]. 江苏农业科学,2020,48(12):119-122.

