一株猪圆环病毒3型的全基因序列测定及遗传进化分析
王雪涛 ,林艳,蔡雨涵,骆辉,阴文奇,李盛辟,周远成*
(1.畜科生物工程有限公司,畜禽生物制品四川省重点实验室,四川省动物生物制品工程技术研究中心,四川 成都 610200;2.四川省崇州市动物疫病预防控制中心,四川 崇州 611200)
猪圆环病毒(PCV)是一种小型单股环状无囊膜的DNA病毒,根据基因及抗原的差异性将其分为3种血清型:猪圆环病毒1型(PCV1)、猪圆环病毒2 型(PCV2)以及新出现的猪圆环病毒3 型(PCV3)[1]。PCV1于1974年被Tischer I 等[2]在猪传代细胞中发现,被认为是一种细胞污染物,直到1982年通过离心后电镜观察才首次确认命名[3],该病毒对猪只没有致病性。PCV2与猪圆环病毒病(PCVAD)相关,能导致断奶仔猪多系统衰竭综合征(PMWS)、猪皮炎和肾病综合征(PDNS)、繁殖障碍等疾病,给养猪业带来极大的威协[4]。PCV3 是一种与猪皮炎和肾病综合征、生殖功能衰竭和多系统炎症相关的新型猪圆环病毒[1]。PCV3基因组全长为2 000 bp,GC含量50%,PCV3主要包括ORF1、ORF2、ORF3 三个开放阅读框(ORFs),其中ORF1 与ORF2 分别编码复制酶蛋白Rep 和抗原结构蛋白Cap,且两个ORF 呈反向排列,ORF3 编码231 个氨基酸蛋白,起始密码子不清楚。基因分析发现PCV3 与PCV2、PCV1 基因组之间的同源性较低,并且抗原蛋白Cap 之间不具有交叉保护性[5-6]。
2016 年,PCV3 首先在美国报道发现[7],以后陆续在亚洲、欧洲、美洲的许多国家发现和流行。自2016 年以来,PCV3 已经在我国出现并流行[8-9]。PCV3 常与免疫抑制性病毒(PCV2 和PRRSV)以多重感染的形式被检出[10],在我国也通常以混合感染的形式出现[11]。本试验通过对实验室保存送检的病料进行PCV3 阳性筛选、送检测序,以及相关基因分析,为当前PCV3分子流行病学研究提供一定的参考。
1 材料
1.1 主要试剂 2×Taq MasterMix、DL2000 DNA Marker,均购自宝日医生物技术(北京)有限公司;病毒基因组DNA 提取试剂盒购自康宁生命科学(吴江)有限公司。
1.2 相关引物 PCV3的检测采用常规PCR方法,参考GenBank 上PCV3 的基因序列,利用BioEdit软件设计PCV3 的检测引物(PCV3-Cap-F/R)和全基因引物(PCV3-全-F/R)。引物序列由生工生物工程(上海)股份有限公司合成,引物信息详见表1。

表1 引物信息表
2 方法
2.1 样品收集 将2019年四川各规模养殖场送检的50 份病料,包括腹泻仔猪的肠内容物、保育猪腹泻粪样、流产胎儿组织、木乃伊胎组织、繁殖障碍母猪血液、呼吸系统障碍和运动障碍育肥猪组织、腹泻母猪粪样等,前期已按照送检要求对送检样品进行过其他病原(如CSFV、PRRSV、PRV、JEV、PPV、PCV2、TGEV、PEDV 等)的检测,样品放于-80 ℃保存备用。
2.2 PCV3 检测 将收集的50 份病料研磨破碎后,用核酸提取试剂盒提取DNA,以样品中提取的DNA为模板,以设计好的检测引物PCV3-Cap-F/R进行PCV3 PCR检测。反应体系为20 μL:2×Taq MasterMix 10 μL,模板DNA 1.0 μL,PCV3-Cap-F 1.0 μL,PCV3-Cap-R 1.0 μL,ddH2O 7 μL。反应程序为:95 ℃2 min;95 ℃30 s,58 ℃45 s,72 ℃30 s,35个循环;72 ℃延伸5 min。用1.5%琼脂糖凝胶电泳,观察结果。
2.3 PCV3全基因组扩增 以检测出的阳性核酸为模板,用全基因引物(PCV3-全-F/R)对阳性核酸进行PCV3全基因扩增,PCR反应体系为50 μL:2×Taq MasterMix 25 μL,模 板DNA 2.0 μL,PCV3-Cap-F 2.0 μL,PCV3-Cap-R 2.0 μL,ddH2O 19 μL。反应程序为:95 ℃ 3 min;95 ℃30 s,58 ℃30 s,72 ℃2 min,40个循环;72 ℃延伸10 min。取5 μL 用1%琼脂糖凝胶电泳,观察结果。然后将剩余的45 μL送生工生物工程(上海)股份有限公司测序。
2.4 PCV3 基因组分析 将所得的PCV3 序列与NCBI 中的参考序列进行比对。从GenBank中挑选下载18 株PCV3 参考毒株,分别是9 株国外毒株和9株国内毒株(表2)。利用MAGA7.0软件绘制Cap 蛋白基因序列的遗传进化树,并利用MegAlign 软件对Cap 蛋白基因同源性和全基因同源性进行分析。

表2 18株PCV3参考毒株
3 结果
通过对实验室保存病料的筛选、全基因组扩增和送检测序,获得了一株病毒全基因序列,经GenBank 的BLAST 比对,确定该序列为PCV3 全基因序列,基因组长度为2 000 bp,将其命名为PCV3/CN/Sichuan/2019。
为了分析PCV3/CN/Sichuan/2019与其他PCV3毒株的遗传关系,基于抗原结构蛋白Cap基因序列,构建进化树(图1),结果显示:本次获得的毒株PCV3/CN/Sichuan/2019与国内河南毒株HeNYS-2(2017)的遗传关系最近;从整个遗传进化距离看,与国外毒株的遗传关系较远,与国内毒株(包括亚洲毒株PCV3-RU/TY17)的遗传关系较近。Cap 蛋白基因序列同源性分析结果(图2)表明,PCV3/CN/Sichuan/2019 与河南毒株HeNYS-2(2017)的同源性最高,为99.8%。与其余8 株国内毒株的同源性在99.1%~99.2%之间,与国外9株毒株的同源性在99.1%~99.3%之间。全基因序列同源性分析结果(图3)表明,PCV3/CN/Sichuan/2019与河南毒株HeNYS-2(2017)的同源性为100%,与其余8 株国内毒株的同源性在98.1%~98.8%之间,与国外9 株毒株的同源性在98.0%~98.6%之间。
4 讨论
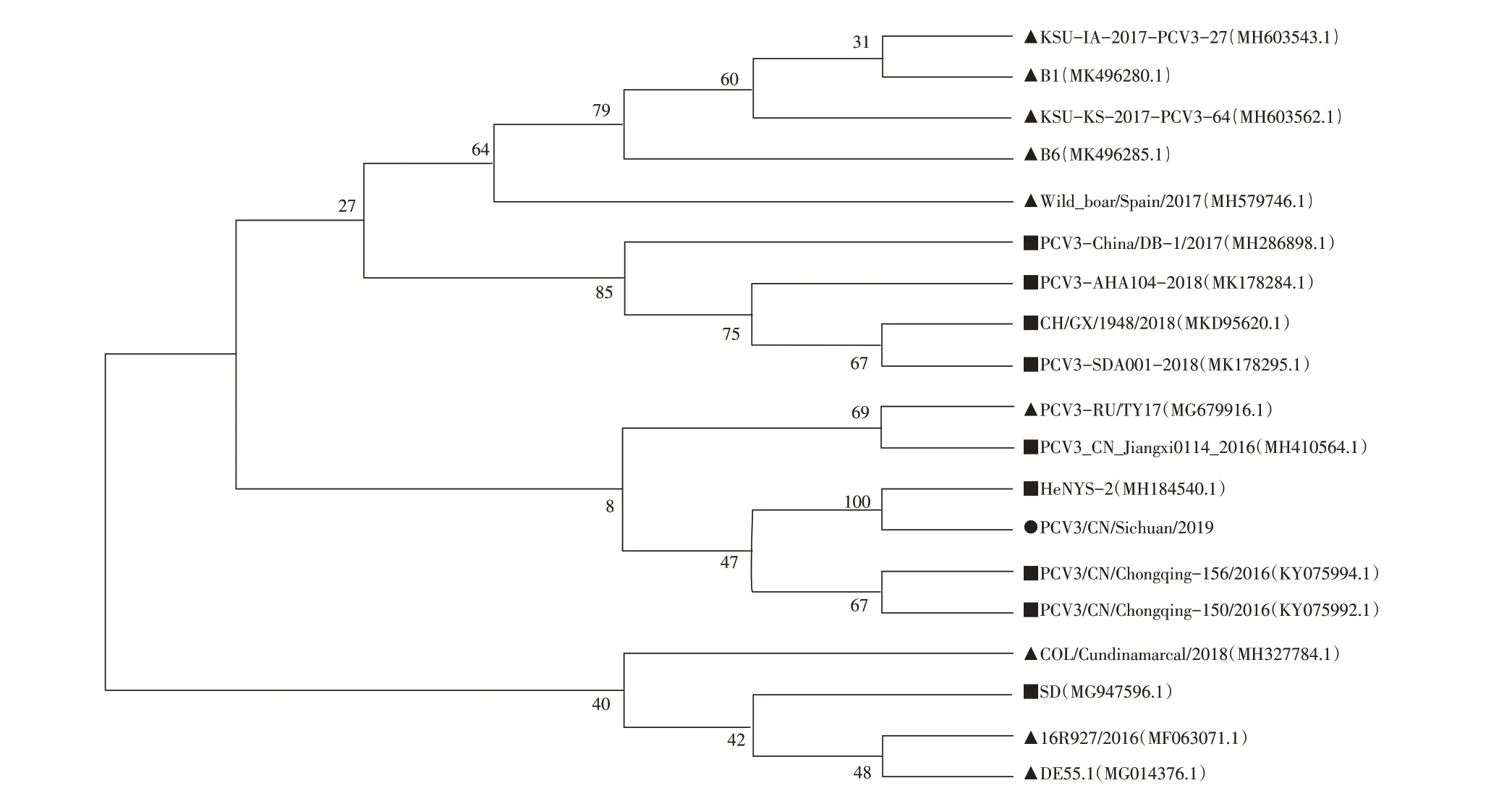
图1 PCV3/CN/Sichuan/2019与国内外毒株Cap基因序列的遗传进化分析

图2 PCV3/CN/Sichuan/2019与国内外毒株Cap基因序列的同源性比较

图3 PCV3/CN/Sichuan/2019与国内外毒株全基因序列的同源性比较
PCV3 是近几年才在猪群中发现的圆环病毒,目前尚未见报道分离到PCV3 活毒株。其相关研究还处于前期阶段,致病性尚不清楚,临床上常以混合感染的形式出现,这加大了疾病的诊断与防控,对养殖业带来的危害亟待评估。虽然目前的研究显示PCV3与猪呼吸道疾病和腹泻有潜在的关联,但其感染机制、发病机理和生物学特性还需进一步研究,以确定PCV3 在健康猪中的影响[12-13]。
本试验获得的PCV3/CN/Sichuan/2019毒株的全基因序列与国内8株参考毒株全基因序列的同源性(98.1%~98.8%)高于与国外毒株全基因序列的同源性(98.0%~98.6%),Cap蛋白基因序列的同源性与国内外毒株基本相同(99.1%~99.3%)。从进化距离上看,与国内毒株的进化距离最近,与国外毒株的进化距离较远,且该毒株与河南毒株HeNYS-2(2017)的进化距离最近,其全基因序列的同源性高达100%,Cap蛋白基因序列的同源性高达99.8%。说明从四川某猪场分离的PCV3毒株与河南毒株相同,该毒株的Cap 蛋白基因和其他基因都发生了一点突变;与其余国内外毒株的基因序列相比,Cap 基因序列的同源性高于全基因序列的同源性,说明Cap 基因发生的碱基突变率高于其他基因,但整体上看PCV3 毒株的变异小,基因遗传进化特性稳定。
本试验从编码Cap 蛋白的ORF2 基因和全基因序列角度对PCV3 进行了遗传进化分析,希望可以为四川省PCV3的遗传变异和流行病学研究提供理论依据。

