血浆外泌体miRNA诊断早期肺腺癌的临床价值
马云帆,苏晓桉,周银曦,张慧鑫
肺癌是全球癌症相关死亡的主要原因。肺癌高死亡率的主要原因是就诊时,80%的患者已处于晚期,预后普遍较差,5年生存率约为15%[1]。非小细胞肺癌(NSCLC)约占肺癌的80%以上,其中肺腺癌所占比例已超越肺鳞癌,成为发病率最高的NSCLC[2]。因此,肺腺癌的早期诊断和早期治疗对改善肺癌患者的预后极其重要。目前除了低剂量螺旋CT扫描之外,还没有更为有效的方法能够早期发现肺癌,但LDCT有辐射、假阳性率高等不足之处[3]。因此,临床中迫切需要无创性生物标志物检测可以补充,甚至取代LDCT进行肺癌的筛查和早期诊断。液态活检属于新型无创性分子病理检测方式,循环miRNA检测是其中一种具有应用前景的方法[4]。但外周血中的miRNA,易受RNA酶的降解,而外泌体的膜结构可增强循环miRNA分子的稳定性,具有作为疾病生物标志物的潜力[5]。本研究根据既往研究报道,筛选miR-17-5p、miR-100-3p和miR-30a-3p三个肺腺癌血浆外泌体中表达明显变化的miRNA作为标志物[6-7],在54例I期肺腺癌患者和45例健康个体中进行外泌体miRNA验证分析,判断这三个miRNA诊断早期肺腺癌的准确性,以期为肺癌的早期无创筛查提供新的依据。
1 资料与方法
1.1 一般资料
1.1.1 研究对象:选择宁夏医科大学总医院普胸外科2017年10月-2019年10月54例I期肺腺癌手术患者(术后病理确认)和45例健康志愿者(性别与年龄匹配),采集其外周血,提取血浆外泌体,以验证所选择的miRNA诊断模板的准确性。具体临床资料见表1。本研究严格按照《涉及人体的生物医学研究国际伦理指南》(CIOMS)进行,研究方案经过宁夏医科大学总医院医学科研伦理审查委员会的批准(2018-283)。所有志愿者均书面同意其血浆样本、基本信息及病理信息用于本研究。
1.1.2 主要试剂与仪器:Trizol试剂(Invitrogen公司 美国),miRNA cDNA第一链合成试剂盒、miRNA 荧光定量试剂盒、hsa-miR-17-5p 、hsa-miR-30a-3p、hsa-miR-100-3p和内参U6(天根生化科技有限公司 北京),SDS-PAGE凝胶配制试剂盒、BCA 蛋白测定试剂盒(凯基生物有限公司 南京),β-actin抗体、CD9、CD63抗体(博奥森生物技术有限公司 北京);H7650透射电子显微镜(Hitachi公司 日本),荧光定量 PCR 仪(ABI 公司 美国),超速冷冻离心机(Thermo Scientific公司 美国),电泳仪和电泳槽、转膜槽、Western blot曝光仪(Bio-Rad公司 美国)。
1.2 方法
1.2.1 血浆采集:肺腺癌患者于术前1 h 内用真空抽血管采集全血2 mL,健康志愿者采集方法相同,加入枸橼酸钠抗凝血剂,静置30 min后,在离体3 h 内完成血浆分离,保存于-80 ℃冰箱。
1.2.2 血浆外泌体提取:1 mL血浆4 ℃溶解后,用磷酸盐缓冲盐水(PBS)1∶10稀释后离心,在4 ℃,10 000 g下离心30 min;收集上清液,转移至超速离心管,在超速离心机4 ℃,100 000 g离心2 h;弃去上清液,并将沉淀重悬于适量的PBS中。取少量样品行外泌体鉴定,其余样品于-80 ℃保存。
1.2.3 外泌体鉴定:透射电子显微镜鉴定外泌体的形态,即取制备好的外泌体样品,滴于铜网上并静置10 min后,以2%磷钨酸染色10 min;在80 kV的加速电压下用H7650透射电子显微镜观察样品的形态,AMT数码相机拍摄透射电子显微镜观察到的图像。Western blot检测外泌体样本中的特异性蛋白CD9(24 kD)和CD63(53 kD):转膜后,取出PVDF膜,加入配置好的荧光发光剂溶液,在Western blot曝光仪中进行曝光,采集图像。
1.2.4 外泌体中RNA提取:将提取的外泌体沉淀重悬于适量的PBS中,再向EP管中加入200 μl氯仿,颠倒混匀数次后于室温静置3 min,离心。将EP管上层RNA水相转移至新的无RNA酶EP管中,加入500 μl异丙醇,混匀后于室温静置10 min,离心;弃去上清液,加入1 mL DEPC水配制的75%无水乙醇,涡旋振荡冲洗沉淀,离心;弃去上清液,干燥5 min。根据RNA沉淀大小加入50~100 μl DEPC水,吹打混匀沉淀,置于水浴锅中55 ℃水浴10~15 min;取1 μl 制备好的RNA 进行核酸超微量测定RNA纯度和浓度,其余RNA于-80 ℃保存。
1.2.5 miR-17-5p、miR-100-3p和miR-30a-3p的qPCR引物制备:在miRBase数据库中获得miR-17-5p、miR-100-3p和miR-30a-3p的成熟序列,qPCR引物由北京天根生化科技有限公司制备提供。miR-17-5p:5-GTCAGAATAATGTCAAAGTGCTTACAGTGCAGGTAGTGATATGTGCATCTACTGCAGTGAAGGCACTTGTAGCATTATGGTGAC-3’;miR-100-3p:5-CCTGTTGCCACAAACCCGTAGATCCGAACTTGTGGTATTAGTCCGCACAAGCTTGTATCTATAGGTATGGTCTGTTAGG-3’;miR-30a-3p:5-GCGACTGTAAACATCCTCGACTGGAAGCTGTGAAGCCACAGATGGGCTTTCAGTCGGATGTTTGCAGCTGC-3’。
1.2.6 qPCR检测miRNA的相对表达量:采用miRcute增强型miRNA cDNA第一链合成试剂盒操作合成cDNA,完成RNA反转录。采用miRcute增强型miRNA荧光定量检测试剂盒进行qPCR,检测外泌体样品中miR-17-5p、miR-100-3p和miR-30a-3p的相对表达量。检测重复三次,取CT值的均值进行最终计算。使用内参U6进行校准,2-△CT法分析数据结果。根据相对定量公式计算检测结果,最终计算公式:改变的倍数(fold change)= 2-△CT;△△CT =(CT靶基因-CT内参)处理组-(CT靶基因-CT内参)未处理组。

2 结果
2.1 早期肺腺癌组和健康对照组临床资料比较:早期肺腺癌组患者54例,平均年龄(59.22±7.81)岁,其中原位癌11例、Stage IA 19例、Stage IB 24例;健康志愿者组48例,平均年龄(53.93±8.96)。2组间年龄、性别和吸烟史比较差异无统计学意义 (P>0.05),见表1。
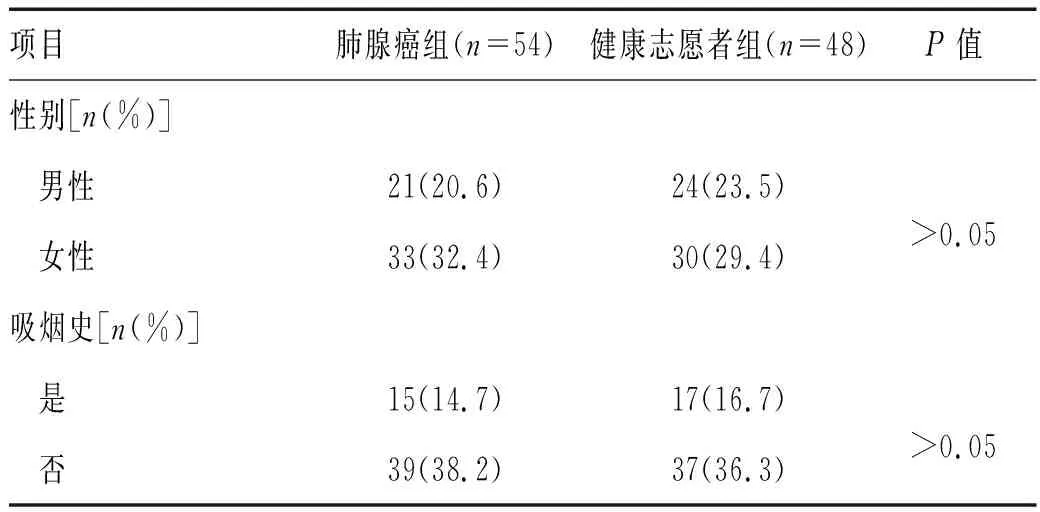
表1 肺腺癌患者和健康个体的临床特征
2.2 血浆外泌体特征:根据MISEV 2018[8],使用Western blot检测了肺腺癌患者与健康志愿者血浆外泌体样本中的2个标志物:CD9和CD63。WB结果均可见到明显的CD63和CD9条带,见图1a(目录后)。透射电镜结果表明,肺腺癌患者与健康志愿者血浆中分离出的囊泡大部分在100 nm左右,均有一个杯状双层膜结构,为典型的外泌体图像,见图1b(目录后)。
2.3 qPCR验证miR-17、miR-100和miR-30a-3p相对表达水平:肺腺癌组与健康志愿者组中miR-17-5p、miR-100-3p和miR-30a-3p的相对表达水平,见表2。分析结果显示,肺腺癌患者组血浆外泌体中的miR-17-5p较健康志愿者组相对表达水平高,差异有统计学意义(P<0.05);肺腺癌患者组血浆外泌体中的miR-100-3p较健康志愿者组相对表达水平低,差异有统计学意义(P<0.05);肺腺癌患者血浆外泌体中miR-30a-3p较健康志愿者的相对表达水平升高,但差异无统计学意义(P>0.05)。

表2 2组miR-17-5p、miR-100-3p和miR-30a-3p相对表达水平比较
2.4 血浆外泌体miR-17-5p和miR-100-3p诊断早期肺腺癌的ROC曲线分析:ROC曲线分析评价血浆外泌体miR-17-5p、miR-100-3p及其二者联合诊断早期肺腺癌的准确性。miR-17-5p的AUC值为0.870,差异有统计学意义(P<0.05),诊断灵敏度和特异度分别为88.9%和71.1%;miR-100-5p的AUC值为0.777,差异有统计学意义(P<0.05),诊断灵敏度和特异度分别为70.4%和77.8%;使用miR-17-5p/miR-100-3p联合诊断早期肺腺癌(通过miR-17-5p/miR-100-3p△Ct的差值来计算),AUC值为0.905,诊断灵敏度和特异度分别为83.3%和88.9%,见表3。
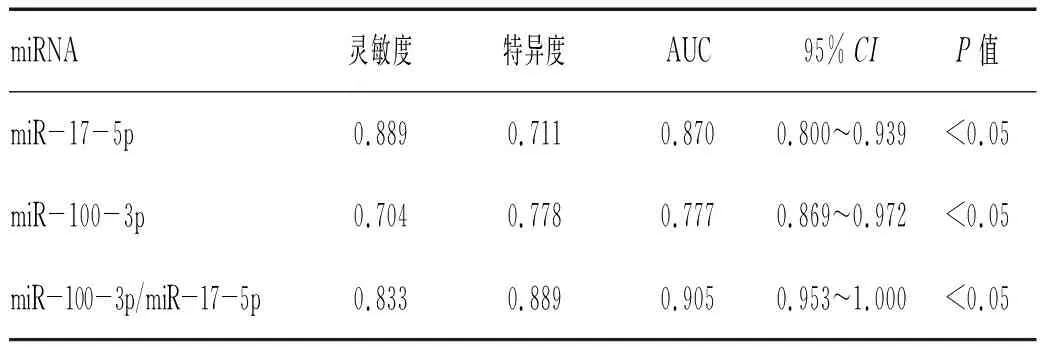
表3 血浆外泌体miRNA诊断早期肺腺癌的ROC曲线分析
3 讨论
本研究通过提取血浆外泌体miRNA并经qPCR检测,验证了早期肺腺癌患者与健康个体相比,血浆外泌体中miR-17-5p相对表达升高,miR-100-3p相对表达下降,而miR-30a-3p虽然较健康志愿者的相对表达水平升高,但差异无统计学意义(P>0.05)。此外,ROC曲线分析显示,血浆外泌体miR-17-5p诊断早期肺腺癌的灵敏度和特异度分别为88.9%和71.1%,miR-100-5p诊断灵敏度和特异度分别为70.4%和77.8%,miR-17-5p/miR-100-3p联合诊断的灵敏度和特异度分别为83.3%和88.9%。以上结果表明miR-17-5p和miR-100-3p这两种血浆外泌体miRNA可能在肺腺癌的早期筛查中发挥作用,而且二者联合应用诊断的准确性更优。
外泌体是一种双层膜结构的囊性小泡,直径30~100 nm[9],广泛存在于人体体液中,包括血液、唾液、尿液等[10]。外泌体中含有蛋白质、细胞因子、转录因子受体、mRNA和miRNA等多种生物活性物质。外泌体携带和传递重要的信号分子,形成了一种全新的细胞间信息传递系统,影响细胞的生理状态并与多种疾病的发生与进程密切相关。相比正常细胞,肿瘤细胞会分泌更多的外泌体,并且含有与肿瘤相关的遗传信息。血液中含有丰富的RNA酶,循环miRNA在血液中可能被降解,影响其检测的稳定性。有研究发现外周血中存在的外泌体因其特有的膜状结构,可以保护其内部的循环miRNA,使其免受RNA酶的降解[11]。由于外泌体miRNA的稳定性和miRNA的富集,可能更适合开发诊断性生物标志物。
miR-17-5p和miR-100-3p在肿瘤发生的相关机制中,发挥着不同的作用。miR-17-92簇是由多顺反子RNA编码的6种不同的miRNA组成,它们异常表达与多种癌症的病理过程相关,可以通过多种分子机制来调节其靶基因[12-13]。miR-17-5p是miR-17-92簇的一员,有研究报道非小细胞肺癌患者血外泌体源性miR-17-5p 表达较健康个体明显升高[14]。既往研究发现,肺癌中miR-100的表达下调,表明其可能发挥了肿瘤抑制功能[15]。另有研究报道,在非小细胞肺癌细胞中过表达miR-100可通过FGFR3抑制肿瘤的生长、迁移和化疗敏感性[16]。
尽管miR-30a-3p在本研究中是非特异性增高的指标,但仍有研究显示肺腺癌患者与健康个体相比,血浆外泌体中此miRNA表达量较高,且差异有统计学意义[7]。这可能是因为所研究的人群差异,或是本研究样本量较小导致结果不符,因此,对于miR-30a-3p仍需要进行大样本验证,来判定此miRNA是否可作为检测早期肺腺癌的合适的生物标志物。在有关疾病特异的循环外泌体miRNA种类及表达水平的研究中,结果往往并不一致,肺癌的研究同样如此[6-7,17-18],究其原因与检测方法和检测人群的差异等多种因素有关。因此外泌体miRNA作为诊断标志物的应用可能会受到一定限制,改进外泌体miRNA检测方法和寻找表达更为稳定、特异的miRNA指标是今后研究的一个方向。

