白桦脂醇对Aβ25-35诱导的PC12细胞氧化应激和凋亡的影响
傅增辉姜 岩刘 晶林再红杜 姝张广萍陈团团
(齐齐哈尔医学院附属第三医院神经内科,黑龙江齐齐哈尔 161002)
阿尔兹海默病(Alzheimer disease,AD),又被称为老年性痴呆,是老年期痴呆的最常见类型,是中枢神经系统退行性病变中常见的,表现为进行性认知功能障碍等的临床综合征[1]。AD发病机制尚不清楚,迄今暂无特效的治疗方式。白桦脂醇(Betulin)为桦木皮提取物的主要活性成分,具有一定的生物活性潜能,且动物实验中表现低毒性,其本身及衍生物的研究成为近年的热点[2]。研究证实,白桦脂醇在抗炎症、癌症以及延缓衰老等治疗等方面表现出一定生物学活性[3],特别是在β淀粉样蛋白(βamyloid protein,Aβ)诱导的痴呆小鼠模型上显示出显著改善认知功能的作用[4]。本研究中,将对Aβ25-35诱导的PC12细胞提前进行白桦脂醇药物干预,观察白桦脂醇对该模型的保护作用,寻找其可能的作用机制,为AD的治疗提供新的可能。
1 材料和方法
1.1 实验材料
高分化肾上腺嗜铬细胞瘤细胞株(PC12),购自中科院上海生化所。将PC12细胞置于含100 mg/L链霉素、100 U/mL青霉素和10%胎牛血清的DMEM培养基(Hyclone公司生产)的培养瓶中,37℃,5%CO2条件的培养箱内孵育。
1.2 主要试剂与仪器
白桦脂醇(购自大兴安岭林格贝寒带生物科技股份有限公司,纯度>96.9%,货号:2813820)分子式C30H50O2,相对分子质量442.72,为白色粉末,无菌条件下,用二甲基亚砜(DMSO,Sigma公司生产)溶解至浓度1000μmol/L的母液,使用时稀释成浓度为5、10、20 μmol/L 的工作液;Aβ25-35冻干粉(Alfa Aesar公司生产,40331),无菌条件下,DMSO溶解至浓度40μmol/L配制成40μmol/L溶液,-20℃保存;N-乙酰半胱氨酸(N-acetyl-L-cysteine,NAC)(YOYOBIO公司生产,Js20137-10 g);MDA测试盒(Zcibio公司生产,ZC-S0651);超氧化物歧化酶(Superoxide dismutase,SOD)测试盒(Sinobestbio公司生产,Yx-C-A600);MTT细胞增殖检测试剂盒试剂(Sigma公司生产,M2128-1G);乳酸脱氢酶(LDH)活性检测试剂盒(IC/IBL公司生产,货号ICLDH-Hu);JC-1检测试剂盒(Adooq Bioscience公司,A15135);caspase3、caspase8和caspase9酶活力试剂盒(百奥莱博公司生产,SNM513-IPX、SNM511-NAV、SNM510-DCX);细胞色素C(Cytochrome c,Cyt c)酶活力试剂盒(雅吉公司生产,A090);ECL试剂盒(YOYOBIO公司生产,J-SW2010);一抗兔抗大鼠Bcl2、Bax、 caspase3、 caspase8、 caspase9、 Cyt c 和GAPDH多克隆抗体(BD公司生产,DXT-610538、DXT-610981、 DXT-610322、 DXT-559932、 DXT-536731、DXT-523011、DXT-560792);二抗羊抗兔IgG-HRP(YOYOBIO公司生产,J-SE134)。
HER Acell 240i CO2培养箱(Thermofisher Scientific公司生产,51020241);GS15R低温高速离心机(Beckman Coulter公司生产,338475);RT6100酶标仪(Rayto公司生产,345678);PowerPac HV电泳仪(Bio Rad公司生产,164-5056);FACScan流式细胞仪(BD公司生产,AMG0002073);成像分析仪(Syngene公司生产,GBOXChemi-XT4)。
1.3 实验方法
1.3.1 实验分组
细胞分为:对照组、Aβ25-35组、NAC组和不同剂量白桦脂醇组。MTT法测定细胞存活率时接种细胞于96孔板内,将Western blot实验的细胞接种于25 cm2培养瓶中。 Aβ25-35组加入 40 μmol/L Aβ25-35进行诱导24 h。NAC组用0.5μmol/L NAC进行预保护24 h,再加入造模浓度的Aβ25-35。白桦脂醇组用不同浓度的白桦脂醇进行预保护24 h,再加入造模浓度的Aβ25-35,通过检测细胞存活率,确定最佳白桦脂醇的浓度。
1.3.2 MTT实验检测细胞活力
在96孔板内,按照1×105/mL密度接种细胞,无血清培养24 h使细胞同步化后,选用终浓度分别为5、10、20μmol/L的白桦脂醇进行预处理24 h后,加入 40μmol/L Aβ25-35诱导 20 h。 96孔板各孔中加入20μL MTT试剂,37℃培养箱培养4 h。吸出各孔液体加入200μL DMSO,摇床震荡10 min,于490 nm刻度测定其吸光度,最后计算细胞存活率。
1.3.3 LDH释放实验
各组细胞培养结束后,吸取培养中上清液,加入10μL细胞裂解液,LDH活性检测采用LDH检测试剂盒。根据标准曲线算出酶活力单位,细胞LDH释放率(%)=培养基中酶活力单位/(裂解液酶活力单位+培养基酶活力单位)×100%。
1.3.4 SOD活性和MDA含量测定
白桦脂醇预处理和Aβ25-35诱导后,4℃条件下进行离心(4 000 r/min)10 min,弃细胞培养上清,每孔加入70μL裂解液,上摇床,于冰上裂解细胞3 h,4℃条件下进行离心(4 000 r/min)10 min,小心吸取上清,BCA法测定各孔细胞蛋白的浓度,严格按照试剂盒要求检测SOD和MDA含量。
1.3.5 细胞凋亡的检测
Annexin V-FITC/PI双染流式细胞术分析细胞凋亡。PC12细胞以每孔2×105个细胞接种于6孔板中,给药和Aβ25-35诱导后使用不含EDTA的胰酶消化并收集细胞,使用1×的Binding Buffer重悬细胞,于室温下避光加入Annexin V-FITC,染色10 min后,同样避光加入PI染色5 min,最后采用流式细胞仪检测细胞凋亡率。
1.3.6 线粒体膜电位的检测
使用JC-1检测试剂盒检测。将细胞用胰蛋白酶处理,室温下在悬浮在JC-1 buffe中15 min。然后通过流式细胞仪分析染色的样品。JC-1在线粒体中表现出电位依赖性积累,并且红色/绿色荧光强度比降低。线粒体膜电位为JC-1绿色荧光/红色荧光比的比值。将JC-1绿色荧光设为横轴,将JC-1红色荧光设为纵轴。
1.3.7 酶活性的检测
采用 caspase3、caspase8、caspase9和 Cyt c活性测定试剂盒,按照说明书进行操作,以酶标仪于波长405 nm处的吸光度(A)表示活性变化。取每份样品检测6次的平均值。
1.3.8 Western blot检测
用含1%PMSF的蛋白裂解液提取蛋白,并按BCA蛋白试剂盒要求对各组蛋白含量进行检测,冰上行转膜反应,添加一抗(兔抗大鼠Bcl2、Bax、caspase3、caspase8、caspase9 和 Cyt c多克隆抗体1∶100,兔抗大鼠GAPDH多克隆抗体1∶100)室温下孵浴2 h并洗涤,将膜浸入以1∶1 000体积比用封闭液稀释的二抗稀释液,室温孵浴2 h洗涤,将ECL试剂盒内的detection reagent 1与detection reagent 2等体积混合后,室温下孵育2 h,ECL发光显影后置于凝胶成像仪中,以β-actin为内参照,采用Image-Pro Plus软件对蛋白表达进行定量分析。
1.4 统计学方法
用SPSS 17.0软件进行数据处理和统计分析。计量数据用平均数±标准差(±s)表示,采用单因素方差分析处理多组间均数比较,用SNK-q检验处理组间两两比较,以P<0.05表示差异有统计学意义。
2 结果
2.1 白桦脂醇对Aβ25-35诱导的PC12细胞存活率的影响
与对照组比,Aβ25-35诱导的PC12细胞存活率明显降低,差异显著(P<0.01);与Aβ25-35组比,预先加入0.5μmol/L NAC 及5、10、20μmol/L白桦脂醇可显著提高细胞存活率,差异具有统计学意义(均P<0.01),见图 1。
2.2 白桦脂醇对Aβ25-35诱导的PC12细胞LDH释放率的影响
与对照组比较,Aβ25-35诱导的PC12细胞LDH释放率显著升高,差异显著(P<0.01);与Aβ25-35组比,预先加入 0.5μmol/L NAC 及 5、10、20 μmol/L白桦脂醇可明显降低LDH释放率,差异具有统计学意义(均P<0.01),见图2。
2.3 白桦脂醇对Aβ25-35诱导的PC12细胞SOD活性、MDA含量和线粒体膜电位的影响
与对照组比较,Aβ25-35诱导的 PC12细胞内MDA含量均明显上升,而胞内SOD活力和线粒体膜电位水平均显著下降(均P<0.01);与 Aβ25-35组比,预先加入 0.5 μmol/L NAC 及 5、10、20μmol/L白桦脂醇MDA含量均显著下降,而胞内SOD活力和线粒体膜电位水平均明显上升(均P<0.01),见图3A、3B。线粒体膜电位的损失是细胞凋亡的标志,如图3C、3D、3E、3F、3G、3H、3I所示,通过观察红绿荧光,Aβ25-35诱导减少了细胞的线粒体膜电位水平(P<0.01),而不同浓度白桦脂醇和NAC均减轻 Aβ25-35诱导的改变(P<0.01)。
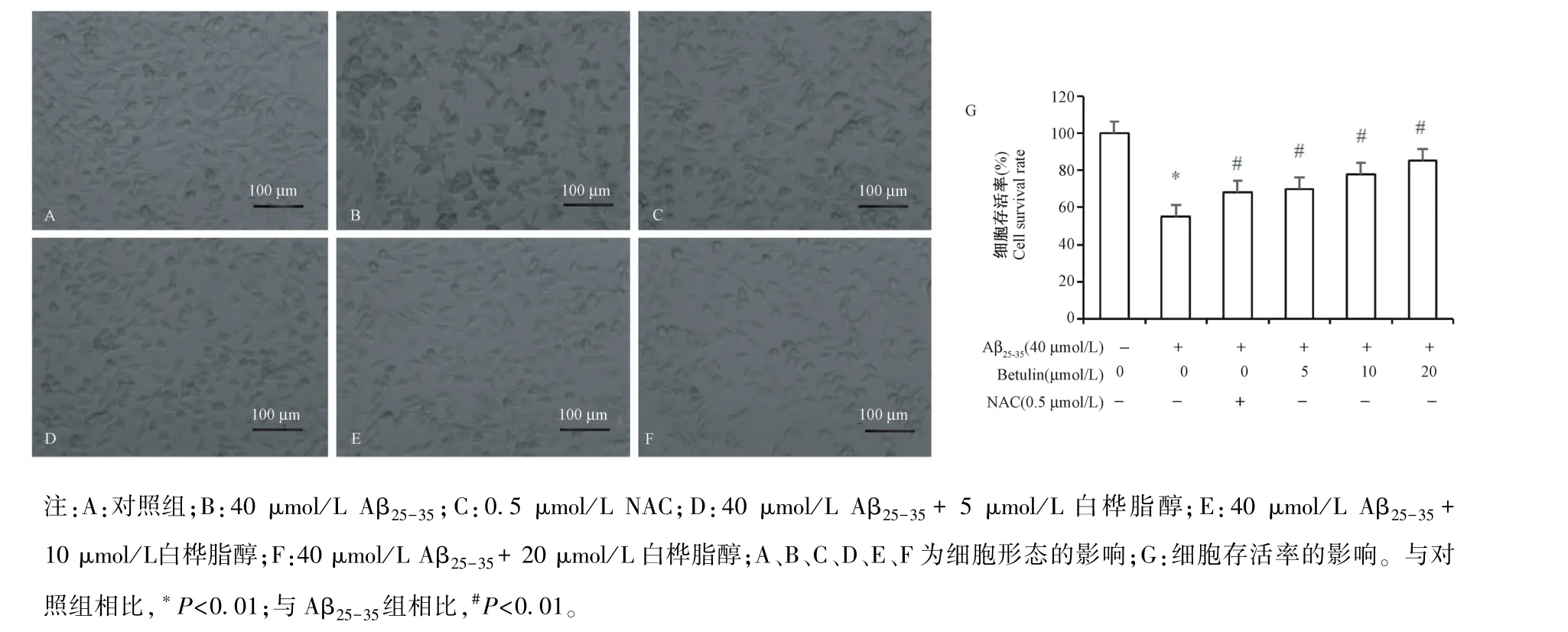
图1 白桦脂醇对Aβ25-35诱导的PC12细胞存活率的影响(n=4,±s)Note.A,Comtrol group.B,40μmol/L Aβ25-35.C,0.5μmol/L NAC.D,40μmol/L Aβ25-35+5μmol/L betulin.E,40μmol/L Aβ25-35+10μmol/L betulin.F,40μmol/L Aβ25-35+20μmol/L betulin.A,B,C,D,E,F is the effect of cell morphology.G,cell survival rate.Compared with the normal group,*P<0.01.Compared with the Aβ25-35 group,#P<0.01.The same as below.Figure 1 Effects of Betulin on the survival rate of PC12 cells induced by Aβ25-35

图2 白桦脂醇对Aβ25-35诱导的PC12细胞LDH释放率的影响(n=4,±s)Figure 2 Effect of Betulin on LDH release rate of PC12 cells induced by Aβ25-35
2.4 白桦脂醇对Aβ25-35诱导的PC12细胞凋亡的影响
与对照组比,Aβ25-35诱导的PC12细胞凋亡率明显升高,差异显著(P<0.01);与Aβ25-35组比较,预先加入0.5μmol/L NAC 及5、10、20μmol/L白桦脂醇的细胞凋亡率明显降低,差异显著(均P<0.01),见图4。
2.5 白桦脂醇对Aβ25-35诱导的PC12细胞凋亡相关酶活性的影响
与对照组比,Aβ25-35诱导的 PC12细胞caspase3、caspase8、caspase9 和 Cyt c的酶活性明显升高(均P<0.01);与 Aβ25-35组比较,经 NAC和 5、10、20μmol/L白桦脂醇预处理细胞的 caspase3、caspase8、caspase9和 Cyt c的酶活性显著降低,见图5。
2.6 白桦脂醇对Aβ25-35诱导的PC12细胞凋亡相关蛋白相对表达的影响
与对照组比,Aβ25-35诱导的 PC12细胞 Bax、caspase3、caspase8、caspase9 和 Cyt c蛋白相对表达水平显著升高,而抗凋亡蛋白Bcl2显著降低,差异显著(P<0.01);与 Aβ25-35组比较,给予 NAC和 5、10、20μmol/L白桦脂醇预处理细胞的 Bax、caspase3、caspase8、caspase9 和 Cyt c蛋白相对表达水平显著降低,而抗凋亡蛋白Bcl2显著升高,差异具显著(P<0.01),见图6。
3 讨论
白桦脂醇是一种天然五环三萜,据报道,该化合物具有各种生物学特性,其抗炎作用在几种不同的模型中得到了证实[5],而神经系统的炎症反应与AD发病中Aβ沉积密切相关。首先,BA可抑制LPS刺激的RAW 264.7巨噬细胞中炎性细胞因子的释放,并在LPS/多微生物诱导的败血症期间防止动物死亡和组织损伤[6]。NAC为谷胱甘肽的前体,具有清除氧自由基、抗细胞凋亡、调节免疫等作用,研究表明[7],NAC可以降低细胞氧化应激水平,减少细胞凋亡。
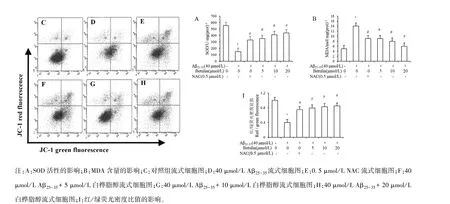
图3 白桦脂醇对Aβ25-35诱导的PC12细胞SOD活性和MDA含量的影响(n=4,±s)Note.A,Influence of SOD activity.B,Influence of MDA content.C,Flow cytometry of control group.D,Flow cytometry of(40 μmol/L Aβ25-35).E,Flow cytometry of(0.5μmol/L NAC).F,Flow cytometry of(40 μmol/L Aβ25-35+5 μmol/L betulin).G,Flow cytometry of(40 μmol/L Aβ25-35+10μmol/L betulin).H,Flow cytometry of(40μmol/L Aβ25-35+20μmol/L betulin).I,Effect of red/green fluorescence density ratio.Figure 3 Effects of Betulin on SOD activity and MDA content in PC12 cells induced by Aβ25-35
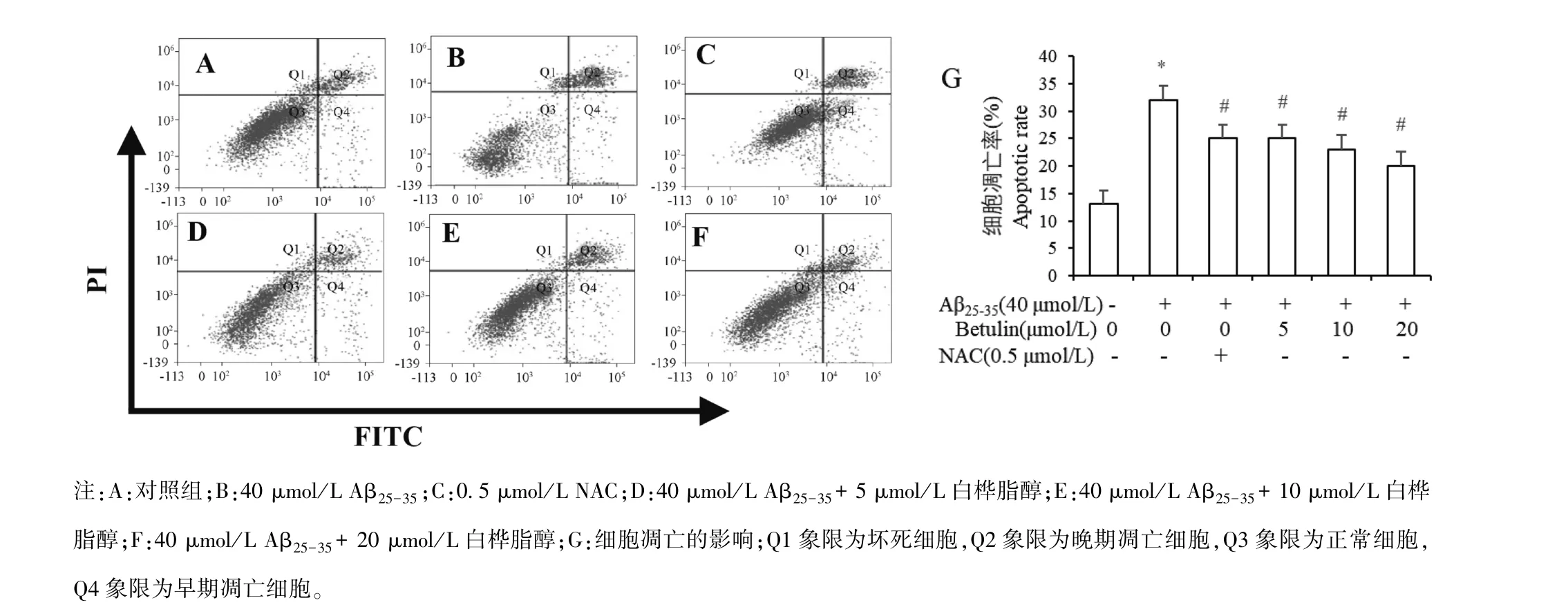
图4 白桦脂醇对Aβ25-35诱导的PC12细胞凋亡的影响(n=4,±s)Note.A,Control group.B,40μmol/L Aβ25-35.C,0.5 μmol/L NAC.D,40 μmol/L Aβ25-35+5 μmol/L betulin.E,40 μmol/L Aβ25-35+10 μmol/L betulin.F,40 μmol/L Aβ25-35+20 μmol/L betulin.G,Result of apoptotic rate.Q1 area represents necrotic cells,Q2 area represents advanced apoptotic cells,Q3 area represents normal cells and Q4 area represents early apoptotic cells.Figure 4 Effects of Betulin on apoptosis of PC12 cells induced by Aβ25-35

图5 白桦脂醇对Aβ25-35诱导的PC12细胞凋亡相关酶活性的影响(n=4,±s)Note.A,Effect of caspase3 activity.B,Effect of caspase8 activity.C,Effect of caspase9 activity.D,Effect of Cyt c activity.Figure 5 Effects of Betulin on apoptosis related enzyme activity of PC12 cells induced by Aβ25-35

图6 白桦脂醇对Aβ25-35诱导的PC12细胞凋亡相关蛋白相对表达的影响(n=4,±s)Note.A,Effect of Bcl2 expression.B,Effect of Bax expression.C,Effect of Caspase3 expression.D,Effect of Caspase8 expression.E,Effect of Caspase9 expression.F,Effect of Cyt c expression.G,Result of Western blot.Figure 6 Effects of Betulin on relative expression of apoptosis related proteins of PC12 cells induced by Aβ25-35
Aβ在神经元的沉积异常产生的老年斑,一般被认为是是AD的主要病理特征,与AD的发生发展变化关系密切[8]。Aβ级联假说依然占据着学术界的重要地位,Aβ沉积异常引发的最显著的特征之一就是神经元凋亡,进而引起认知功能障碍发生。在本研究中,采用MTT法检测Aβ25-35对PC 12细胞的细胞活性影响,结果显示Aβ25-35诱导的PC12细胞的细胞存活率降低、凋亡水平上升,但NAC和白桦脂醇干预均可以提高细胞生存率并降低凋亡水平。
氧化应激在神经退行性疾病的发生发展中起着重要作用,大脑 Aβ异常沉积可触发氧化应激[9-10],细胞中抗氧化和氧化平衡失调导致ROS的累积高于内环境代谢是氧化应激的基础,触发线粒体功能异常,进而细胞凋亡[11-12]。研究表明,异常沉积的Aβ可介导与线粒体内的乙醇脱氢酶(Aβbinding alcohol dehydrogenase,ABAD)异常结合,引发呼吸链功能异常,并产生ROS水平上升,出现氧化和抗氧化机制异常。并且,ROS的累积会损伤染色体及生物膜系统,出现线粒体呼吸链紊乱、ROS产生增加等表现,加剧氧化和抗氧化失衡过程,最终出现正反馈样的氧化应激—线粒体异常的循环[13-15]。但白桦脂醇抑制凋亡是否与改善细胞内氧化应激水平有关尚不明确,本研究进一步探讨其影响。SOD和MDA水平是促进细胞程序性死亡的重要因素,作为检测氧化应激的主要指标,内源性抗氧化酶SOD可清除体内自由基。研究表明,AD患者ROS水平升高,随着SOD活性降低和MDA含量升高,中枢神经氧化应激水平升高,且Aβ诱导的离体实验和载体实验中有氧化损伤的报道[16-18]。根据本实验,Aβ25-35诱导PC12细胞SOD活性降低,MDA含量升高,而NAC和白桦脂醇处理使SOD活性升高,MDA含量降低。推测白桦脂醇可以发挥与NAC同样的作用,对Aβ25-35诱导的PC12细胞的抗氧化应激能发挥保护作用。
Aβ增多对神经元的毒性作用是AD发病的重要途径,将Aβ注射入大鼠海马,可模拟AD脑内Aβ形成以后的毒性作用过程,特别是氧化应激过程,Aβ介导凋亡的靶点存在于神经元内[19-20]。线粒体引导的凋亡通路是关键的内源性凋亡信号转导途径,并且有体外实验报道Aβ能够激活线粒体介导的凋亡途径[21-22]。线粒体介导的凋亡途径是受Bc12家族蛋白调节的细胞内部信号触发的凋亡方式[23-24]。本研究中,Aβ25-35诱导的PC12细胞的凋亡蛋白表达上调而抗凋亡蛋白则相反,通过提前给予NAC和白桦脂醇可使凋亡蛋白表达下调而抗凋亡蛋白表达上调。提示Aβ25-35能够激活线粒体介导的凋亡途径,而预防给药白桦脂醇能够有效的抑制线粒体凋亡通路的激活。同时,为了确定线粒体膜通透性引起的凋亡因子外放是否激活了下游的凋亡蛋白,本研究检测了caspase3和caspase8的活性和表达情况,Aβ25-35诱导的PC12细胞的caspase3和caspase8水平上升,而通过提前给予白桦脂醇可降低细胞内caspase3和caspase8水平。Bcl2和Bax表达的失调,使细胞线粒体膜电位发生相应变化,从而导致Cyt c成功穿透线粒体膜最终渗透到胞浆中,激活 caspase9,活化的 caspase9进一步激活caspase3,从而提高caspase3活性,最终促进细胞凋亡[25-26]。本研究中,Aβ25-35诱导的 PC12细胞的caspase3、caspase8、caspase9 和 Cyt c上调,且线粒体膜电位下降,通过提前给予NAC和白桦脂醇可使其表达下调,并保护线粒体膜电位。因此,NAC和白桦脂醇可能对Aβ25-35诱导的PC12细胞凋亡和线粒体损伤具有一定的保护作用。
本研究发现,有效剂量的白桦脂醇预处理,可以明显抑制Aβ25-35诱导引起的细胞凋亡。考虑机制可能与通过减少ROS的生成而降低氧化应激水平,并抑制细胞凋亡途径有关,本实验为白桦脂醇延缓AD的发展提供了一定的药理学依据,但也为白桦脂醇延缓了AD的发展提供了基础的药理学依据,但是,需通过进一步的分子生物学研究来明确其机制。

