一种改良的大鼠颈静脉自主给药插管及其应用
李贝贝张 欢陆思远刘小珍王舒哲刘永涛邱云良*
(1.中国医药工业研究总院上海益诺思生物技术股份有限公司,上海 201203;2.上海工程技术大学化学化工学院,上海 201620;3.复旦大学药学院,上海 201203;4.上海健康医学院药学院,上海 201318)
大鼠自主给药实验(rat self-administration)是建立大鼠成瘾模型最常用的一种方法[1],也是临床前依赖性评价中检测新药是否具有依赖性潜力的金标准[2-3]。大鼠自主给药实验通过颈静脉插管手术,建立了将可获得的药物直接与颈静脉相连通的静脉注射模型,动物通过主动按压踏板或者鼻触,获得从颈静脉输入的药物,如若该药物具有成瘾性,则动物就会维持其踏板或者鼻触行为,从而形成稳定的自主给药行为,反映药物的强化作用[4-5]。
自主给药实验时长都会长达几周甚至数月之久,如若插管不在静脉内或者发生堵管、漏液等问题,就导致药物无法正常输入静脉,进而造成实验的终止,所以颈静脉插管手术是该实验最基本也是最关键的技术,而插管设计的合理性直接决定了插管鼠的可用寿命。现有用于自主给药的插管产品主要分为两种:一种为马甲束缚式插管[6],另一种为无束缚式插管[7]。束缚式插管通过给大鼠穿戴马甲的办法固定体内插管,操作较为简单,但插管破坏率较高,实验成本也较高。无束缚式插管通过巧妙的多材料组合设计[8],将插管组件埋入动物背部皮下,解决了马甲束缚式插管的缺点,但现有产品仍然存在着如下缺点[8-9]:生物相容性较差,容易造成伤口感染,且埋入动物皮下部分不能与皮下组织良好嵌合,对动物产生较大的异物感,影响动物情绪,进而影响自主给药行为等缺点。
针对以上现有产品的特点,本文将提供一种改良的用于大鼠颈静脉自主给药实验的插管设计,包括插管组件及其匹配的弹簧保护套管,本文将介绍其制作方法,并介绍利用此插管组件如何进行颈静脉插管手术以及术后维护方法,并分析了本次实验动物出现濒死的原因及预防办法,以期为利用自主给药实验进行各项科学研究的工作者提供一种更佳的颈静脉插管方法。
1 材料和方法
1.1 实验动物
食物训练成功的SPF级SD雄性大鼠29只,8~10周龄,体重251~296 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2019-0001]。动物单笼饲养于通风良好的SPF级动物实验室[SYXK(沪)2019-0009],每12 h明暗交替(暗周期为7:00~19:00),饲养环境温度控制在20℃~26℃,湿度控制在40%~70%。本实验方案已经过上海益诺思生物技术股份有限公司实验动物管理和使用伦理委员会(IACUC)批准(IACUC-2019-R-078),并按照3R原则给予动物人道关怀。
1.2 主要试剂与仪器
丙泊酚:四川国瑞药业有限责任公司,批号:1607292、1811161、1812202、1811153;可卡因:青海制药厂有限公司,批号:20160401;肝素:江苏万邦生化医药集团有限责任公司,批号:51711111。MED大鼠自主给药系统:购自美国Med Associates公司,型号MED-008-CT-01;全自动血液分析仪:购自美国西门子公司,型号ADVIA 2120;全自动生化分析仪:购自日本HITACHI,型号7180。
1.3 实验方法
1.3.1 插管组件制作
(1)制作材料
如图1所示a图,制作材料有:硅胶管(内径0.5 mm,外径0.9 mm)、23G不锈钢导管(长度24 mm)、M4螺纹尼龙固定底座(包含一个垂直的螺柱和一个水平的具有侧方开口的圆形底座)、圆形聚丙烯垫片(直径25 mm)、一端封闭的硅胶帽(长约5 mm,内径0.5 mm,外径2 mm)、M4螺纹尼龙帽(内螺纹与M4螺纹尼龙固定底座匹配)、二甲苯、生物相容性良好的瞬干胶Apollo 2240及其催化剂。
(2)制作流程
1)将不锈钢导管小心套入长硅胶管(长约13 cm)中,大约套至不锈钢导管的一半处,然后将两个长约2 mm硅胶结点用镊子辅助套入长硅胶管远离不锈钢导管端的3.5 cm处和5.5 cm处,分别称作第一结点和第二结点;然后用二甲苯将短硅胶管(长约3 cm)浸泡几分钟,待管子膨胀后将其套入不锈钢导管,将不锈钢导管上的长硅胶管覆盖,起到了保护和加固长硅胶管的作用;待二甲苯挥发完全后,用镊子将不锈钢导管一端0.5 mm处弯折90°弯折的时候一定要轻柔,防止导管损坏。将该组合称为组合A。
2)将组合A的不锈钢导管插入固定底座中,不锈钢导管弯折端位于其侧方开口处,而露出螺柱的不锈钢导管约为5 mm。将该组合称为组合B。
3)将组合B的水平底座部分与聚丙烯垫片的中央位置用瞬干胶粘合,同时涂布少量瞬干胶于将要埋植于皮下的部分(因该固定底座无生物相容性,故用胶水覆盖降低动物不适度),并用瞬干胶催化剂加速固化,放置至少24 h后,套上具有保护作用的硅胶帽和尼龙帽,紫外消毒后,便得到了插管组件,如图1所示b图。
1.3.2 弹簧保护套管制作流程
(1)材料准备
保护弹簧:长305 mm,外径3 mm,内径2 mm,用以保护内部输液导管不被动物破坏;可拆卸的双通道轴承接口;输液导管:长350 mm,内径0.35 mm,外径0.8 mm的硅胶管;M4螺纹尼龙帽(与插管组件中的尼龙帽规格一致);热熔胶。如图1所示c图。
(2)制作流程
将保护弹簧一端的外围涂布少量热熔胶,然后将尼龙帽的一端套在热熔胶上,使尼龙帽与保护弹簧重叠长度约5 mm,待其固化后,将轴承接口的其中一个孔道与保护弹簧的另一端(远离尼龙帽端)对接固定,然后将输液导管穿引到保护弹簧中即得弹簧保护套管,将该弹簧保护套管与自主给药实验箱的平衡臂连接即得输液系统,如图1所示d图,输液系统与注射泵连接。当给药时,将插管组件的尼龙帽和硅胶帽去除,与弹簧保护套管上的输液导管和尼龙帽连接即可给药。
1.3.3 颈静脉插管手术
(1)术前准备
无菌手术器械包括但不限于止血钳、持针钳、眼科镊、大剪刀、眼科剪、显微剪、显微镊、垫片,上述制作好的插管组件(于庆大霉素稀释液中浸泡至少10 min)、不可吸收无菌缝合线和缝合针、25 IU/mL浓度的肝素钠、生理盐水、75%酒精、平头注射器、麻醉药(如3%戊巴比妥钠)、镇痛药(如痛立定)、抗生素(如青霉素)、润眼剂(如金霉素眼膏)等。
(2)手术步骤
采用合适镇痛药和麻醉药对动物进行麻醉后涂抹润眼剂,剔除动物背部和右侧颈部被毛背卧位固定(见图2a);切口部位消毒后,于大鼠右侧颈部剪一约1 cm纵口(末端靠近锁骨中线),用止血钳钝性分离皮下组织暴露颈静脉,用缝合线结扎远心端(见图2b);在肩胛骨中心横向切一小切口约0.5 cm,再在远离肩胛骨中心2 cm处纵向下行切一大切口约2 cm,插管组件的底座部分将固定于肩胛骨中心部位,故将肩胛骨皮下部位分离出足够的空间;将插管组件的导管从大切口导出到颈部切口后,将插管组件的底座部分从大切口移至小切口,固定底座的螺柱从皮下小切口拉出,垫片则平整植于皮下(见图2c);在不锈钢导管端外接一段无菌硅胶管,然后再连接含有生理盐水的平头注射器,使整个插管组件的硅胶管都注满生理盐水,并排除气泡;用显微剪在分离的颈静脉上横向切一个小口,在显微镊辅助下将导管插入颈静脉血管至第一结点处后,用缝合线将第一结点前后两边各与血管结扎,而第二结点前后两边各与皮下肌肉进行结扎,每次结扎后用平头注射器回抽血液,以检查插管成功与否(见图2d);确定插管成功后,用庆大霉素稀释液将所有切口冲洗后缝合(见图2e),通过插管给予约4万单位的青霉素预防感染,再给予约0.2 mL肝素钠后盖上硅胶帽和尼龙帽(见图2f)。
(3)术后护理
术后大鼠单笼饲养,密切观察动物身体状况,至少连续3 d通过插管给予青霉素预防感染。手术后第2天开始到整个实验结束,每天用肝素钠(推荐浓度25 IU/mL)进行插管维护。手术后到整个实验结束期间,用合适的麻醉药进行插管性能测试,本实验所用的麻醉药为丙泊酚(测试剂量为3 mg/kg),每周测试1次,若给予适量麻醉药后动物能迅速出现麻醉症状,表明插管状态良好,否则表明插管可能不在静脉内或有漏液可能。
1.3.4 自主给药模型建立
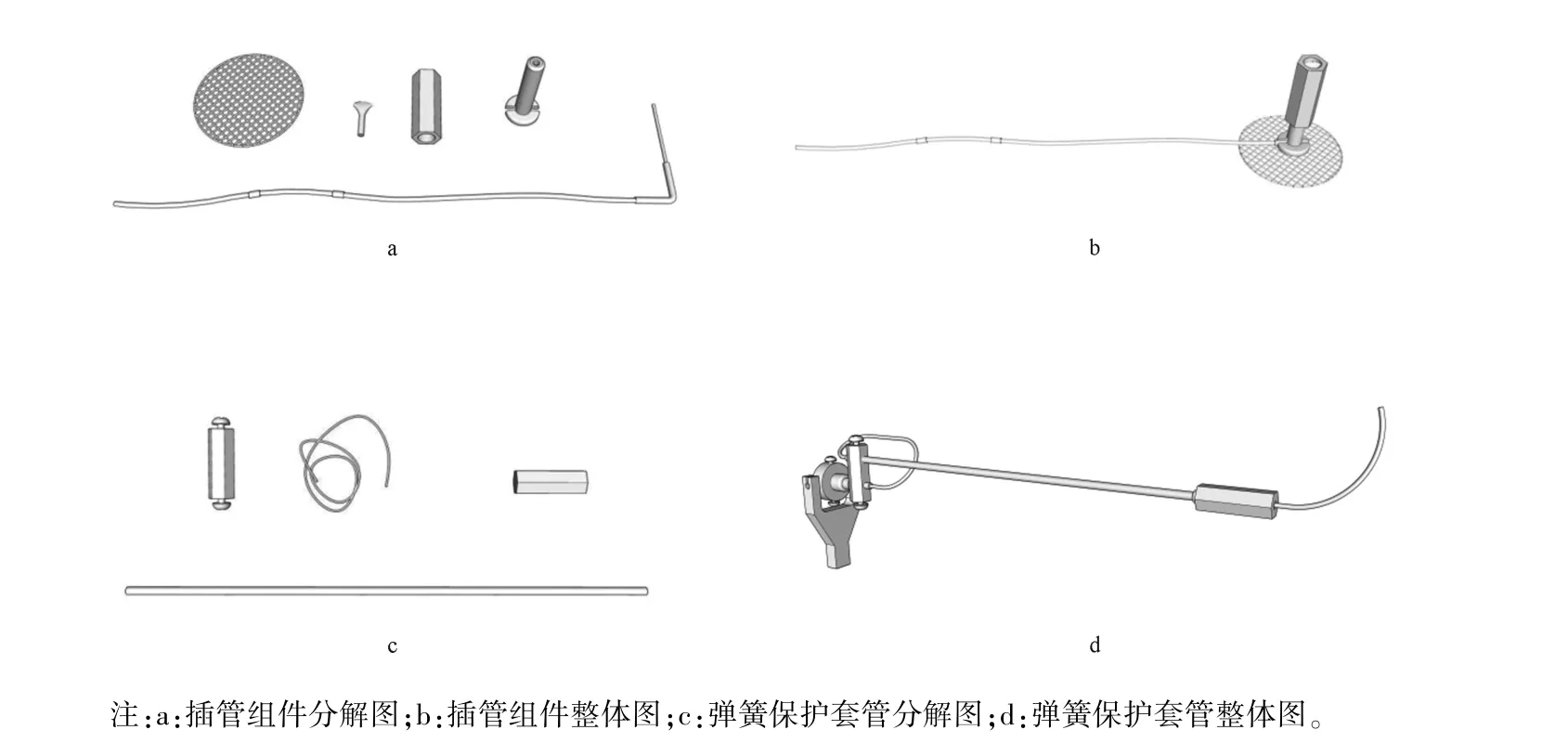
图1 插管组件及其的弹簧保护套管分解图和整体图Note.A,Exploded view of intubation combination.b,Overall view of intubation combination.c,Exploded view of spring protection sleeve.d,Overall view of spring protection sleeve.Figure 1 Exploded view and overall view of intubation combination and its spring protection sleeve
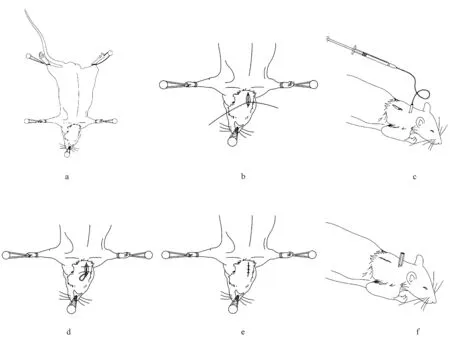
图2 颈静脉插管手术步骤图示Figure 2 Illustration of jugular vein intubation surgery
术后恢复至少7 d,采用MED大鼠自主给药实验箱建立自主给药模型,首先建立维持剂量下固定比率(fixed ratio,FR)为3的丙泊酚自主给药模型,参考相关文献[10-12],丙泊酚维持剂量选择为1.7 mg/(kg·injection),表示每次注射剂量为1.7 mg/kg,每天2 h,确认建模成功后(连续3 d注射次数变异率不超过20%),替换剂量分别为0(生理盐水)、0.1、0.5、1.0、1.7、3.0 mg/(kg·injection)的丙泊酚,每个剂量连续替换3 d,测试自身给予丙泊酚的剂量-注射次数关系。而后继续用该批动物建立可卡因维持剂量下FR为10的可卡因自主给药模型,参考相关文献[13-15],可卡因维持剂量选择为0.56 mg/(kg·injection),每天1 h,确认建模成功后(连续3 h注射次数变异率不超过20%),替换剂量分别为0(生理盐水)、0.05、0.1、0.18、0.32、0.56、1.0 mg/(kg·injection)的可卡因,每个剂量连续替换3 d,测试自身给予可卡因的剂量-注射次数关系。除给药期间动物置于实验箱外,其余时间动物于饲养笼中饲养,分析术后5个月的动物淘汰情况。自主给药实验方法详细内容可参见Markgraf等[16]的文献报道,本文不做赘述。
1.3.5 动物濒死探究
术后第36天由于两只动物濒死,分别称为1号濒死动物和2号濒死动物,对两只濒死动物进行大体解剖、血液学检测和血清生化检测,以探究动物濒死原因;为探究动物濒死率降低方法,于术后第43天、第50天、第57天分别对所有存活动物进行血液学检测并进行及时的抗生素治疗。
2 结果
2.1 自主给药模型建立结果
分别有9只动物和8只动物成功完成了所有测试剂量下的丙泊酚自主给药模型和可卡因自主给药模型的建立,如图3和图4所示,横坐标代表丙泊酚或可卡因给药剂量,纵坐标代表平均注射次数,每个剂量下的3个条形图代表连续替换3 d的平均注射次数(平均数±标准差),可以看出在各自维持剂量下均形成了稳定的自主给药行为,并得到了比较经典的“倒U”型剂量-注射次数关系。两个阳性药自主给药模型建立的成功说明本文所设计的插管组件应用于自主给药模型建立效果良好,能够满足自主给药实验的基本需求,适用于大鼠自主给药相关研究。
2.2 术后动物淘汰数量情况
由表1可知,术后动物淘汰原因主要有濒死、堵管、漏液及其他。术后第1个月,2只动物漏液,药液未能完全打入颈静脉,从背部伤口溢出,可能是导管脱落,也可能是导管接口处破损导致的漏液;术后第2个月,2只动物堵管,4只动物因细菌感染濒死;术后第3个月,1只动物漏液,1只动物堵管,3只动物系因自主给药实验进度需要予以淘汰,与插管无关;术后第4个月,2只动物因细菌感染濒死,5只动物堵管;术后第5个月,1只动物因细菌感染濒死。
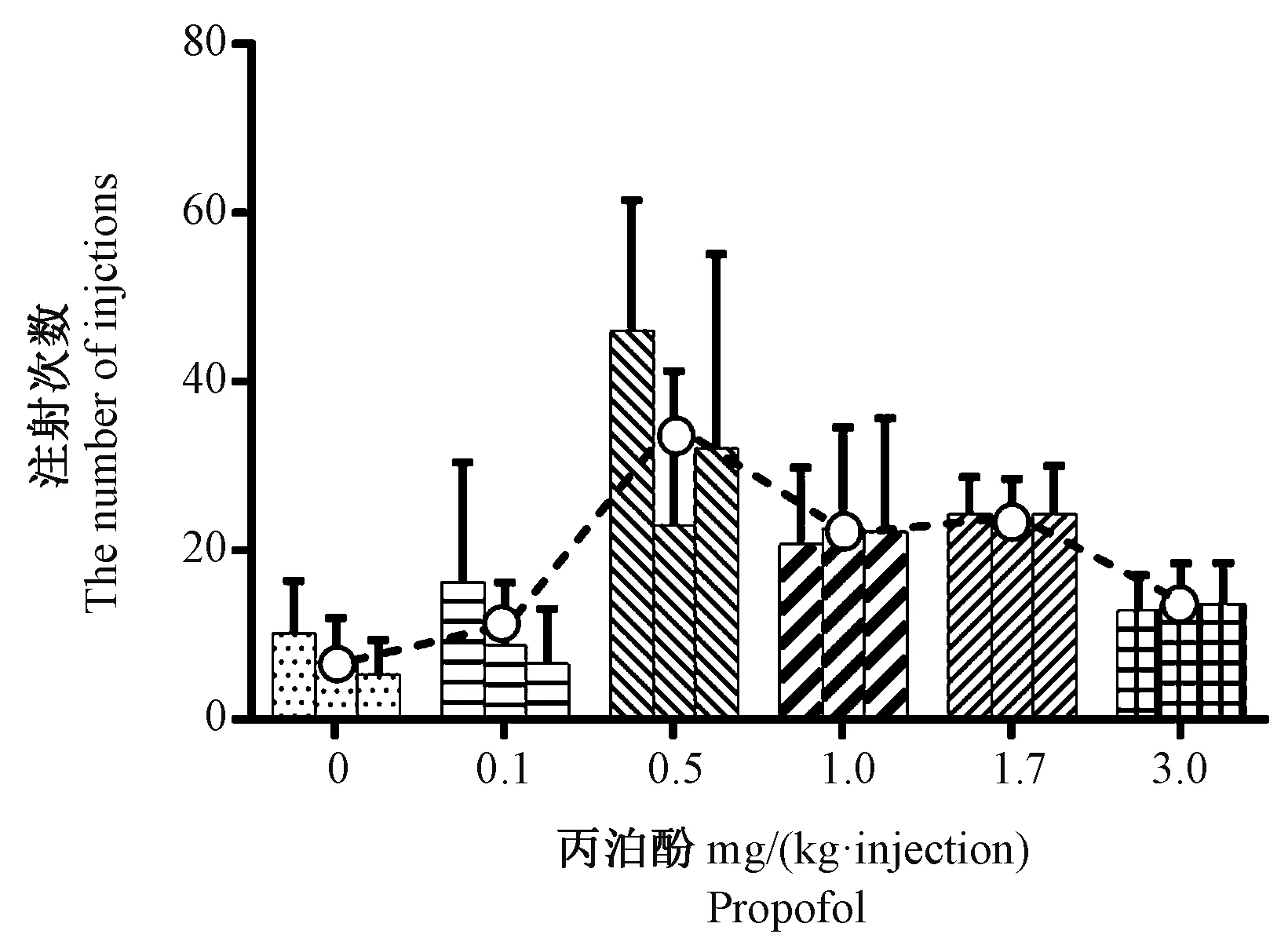
图3 丙泊酚剂量-注射次数关系图(±s,n=9)Figure 3 Diagram of propofol dose-injection relationship
与插管相关的直接淘汰原因为堵管和漏液,术后第1至5个月每个月与插管直接相关的淘汰率分别为7%、7%、10%、31%和11%,术后第4个月,动物发生堵管的数量相对较多,达到5/16例。如图5术后堵管/漏液时间线,可以看出从术后第4个月开始淘汰集中,在月淘汰率在10%以内尚能接受的情况下,该插管组件的使用寿命预计至少3个月,部分插管使用寿命能够长达5个月甚至可能5个月以上。
2.3 动物濒死原因分析
2.3.1 濒死原因分析
术后第36天日,两只动物濒死,分别称为1号濒死动物和2号濒死动物,濒死症状均表现为呼吸急促、活动减少、摄食减少,其中1号比2号濒死症状严重,于发现当天进行了大体解剖、血液学检测和血清生化检测,结果如下:
1号濒死动物:大体解剖结果显示为动物脾略大、胸腺胶冻样、肝见多个淡黄色斑点、回肠散见出血点、膀胱见红色液体、胸腔严重积液。血液学检测结果显示白细胞总数(37.86×109/L)显著增多,以中性粒细胞(21.46×109/L)增多为主,表明1号濒死动物体内有严重炎症反应,进而造成胸腔积液,血小板(199×109/L)减少,进而造成了回肠和膀胱的出血。血清生化检测结果显示丙氨酸氨基转移酶(1494 U/L)活性增高、天门冬氨酸氨基转移酶(1074 U/L)活性增高、碱性磷酸酶(539 U/L)活性增高、总蛋白(46 g/L)减少、白蛋白(22 g/L)减少,表明肝严重损伤;尿素氮浓度(36.30 mmol/L)升高、肌酐浓度(82 mmol/L)升高,表明肾严重损伤;钠浓度(134.1 mmol/L)降低、钾浓度(7.76 mmol/L)升高、氯浓度(90.4 mmol/L)降低,表明电解质紊乱。综上表明1号濒死动物由于体内严重的炎症反应进而造成了肝肾的严重损伤及电解质紊乱。
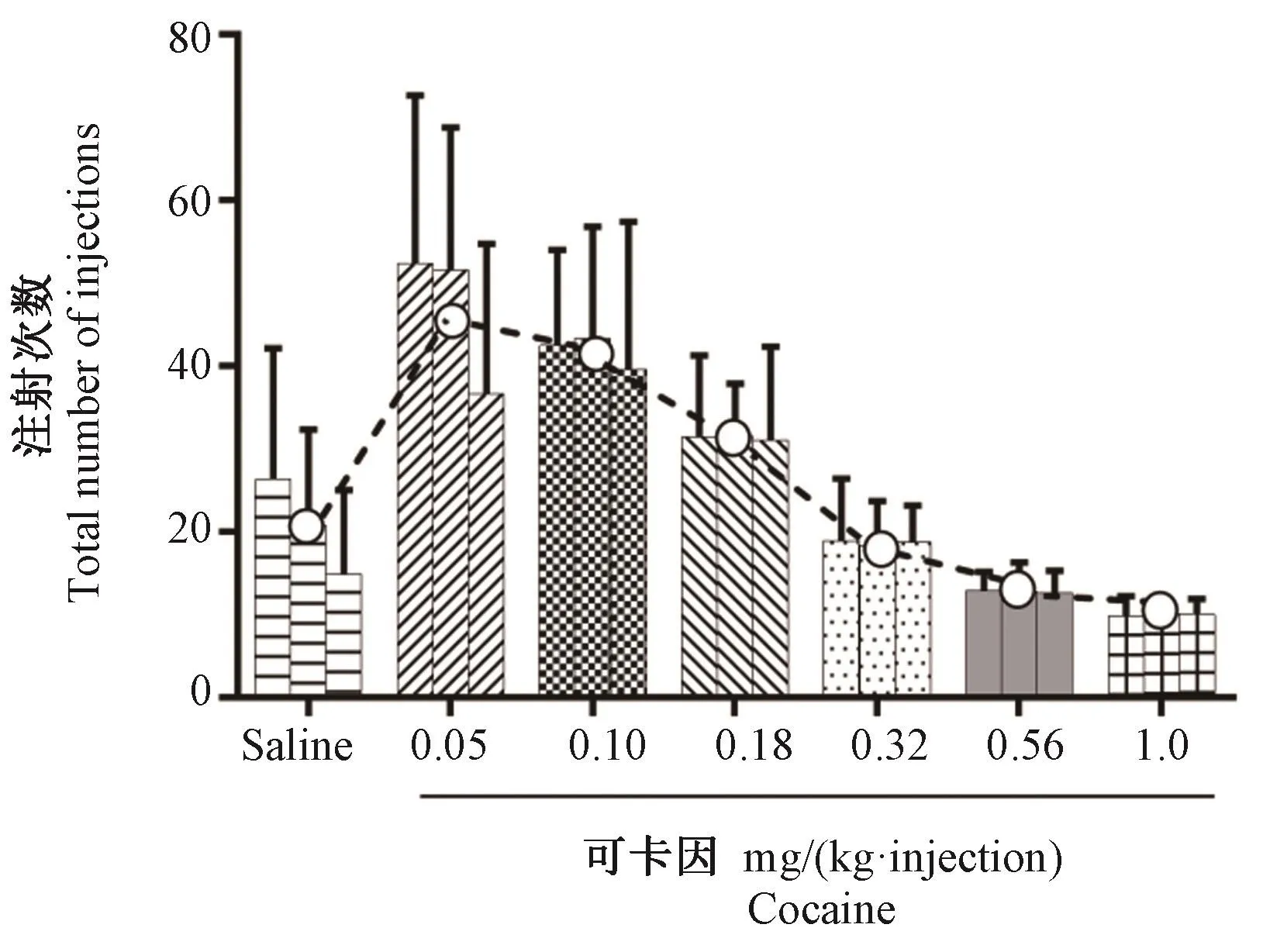
图4 可卡因剂量-注射次数关系图(±s,n=8)Figure 4 Diagram of cocaine dose-injection relationship
2号濒死动物:大体解剖结果显示为动物脾略大、胸腺胶冻样、肝见一尺寸为0.5 cm×0.5 cm的暗红色斑块,胸腔严重积液。血液学检测结果显示白细胞总数(15.82×109/L)也显著增多,以中性粒细胞(8.44×109/L)增多为主,表明2号濒死动物体内也有炎症反应,进而造成胸腔积液,血小板(217×109/L)减少,进而可能造成了肝出现暗红色斑块。血清生化检测结果显示2号濒死动物血清生化指标未见明显异常。综上表明2号濒死动物的濒死症状是由于体内的炎症反应造成的,还暂未造成肝肾严重损伤和电解质紊乱。
以上结果表明,该两只动物濒死的原因与肝肾严重损伤、电解质紊乱和体内炎症有关,推测是细菌感染造成的炎症,后续动物出现濒死的症状与该两只动物濒死症状相同,推测与自主给药实验长期颈静脉置管本身存在的缺点有关,实验箱中的输液系统、每日通管所用材料、所给药液、饲养笼中的粪便尿液、暴露于外部的不锈钢导管等,均不可避免带有致病菌,逐渐地,便会导致个体免疫能力较弱的动物免疫系统的崩溃,影响动物的身体状况,进而影响实验结果。
2.3.2 降低动物濒死率分析
术后第36天两只动物因细菌感染出现濒死后,表明此时大部分动物处于高危感染状态,为降低动物濒死率,及时于第38天开始予以所有动物青霉素抗感染治疗(剂量每只约4万单位,每天1次)。于术后第43天进行血液学检测,此时已进行了连续6 d的青霉素治疗,大部分动物虽无明显感染症状,但血液学显示大部分动物白细胞显著增多,表明致病菌对青霉素不敏感,故于第44天开始更换为头孢曲松抗感染治疗(剂量约每只0.05 g,每天两次)。为检测抗感染效果,于第50天、第57天分别进行血液学检测,三次检测结果见表2。
表2仅列出了最能代表动物细菌感染状况的两个指标,即白细胞总数(WBC)和中性粒细胞百分数(%NEUT),结果表明更换为头孢曲松后,WBC和%NEUT逐渐降低且接近参考值,术后第57天血液学检测表明大部分动物指标都恢复正常,个别指标偏高动物继续予以头孢曲松治疗,为了降低后续实验进程中濒死概率,约每两周进行1次连续3~5 d疗程的头孢曲松预防治疗。图6术后濒死时间线可以看出后续实验过程中动物出现濒死概率降低,表明头孢曲松抗感染卓有成效。
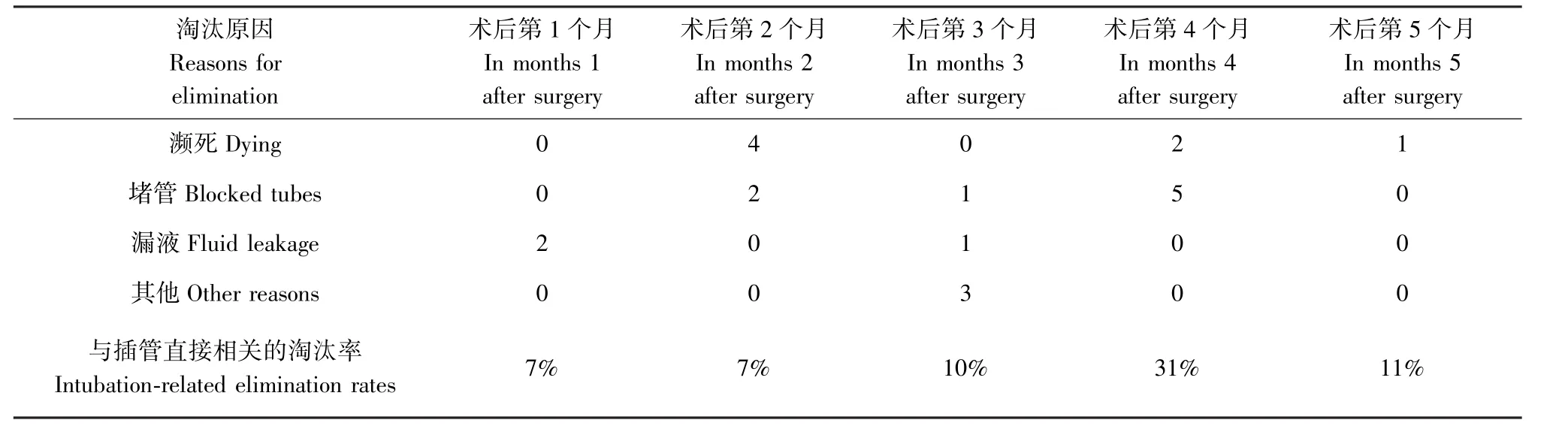
表1 术后动物淘汰数量情况Table 1 Number of animals eliminated after surgery

图5 术后堵管/漏液时间线Note.D,The day after surgery.Figure 5 Timeline of occlusion/leakage after surgery
表2 血液学检测结果(±s,n=21)Table 2 Results of hematology test

表2 血液学检测结果(±s,n=21)Table 2 Results of hematology test
注:D:术后第几天。Note.D,The day after surgery.
检测阶段D e t e c t i o n p h a s e W B C(1 0 3 c e l l s/μ L) %N E U T(%)术后 D 4 3 P o s t o p e r a t i v e D 4 3 1 7.0 6±5.7 0 3 3.0 2±1 6.9 8术后 D 5 0 P o s t o p e r a t i v e D 5 0 1 2.8 4±2.9 7 2 5.6 6±1 0.0 1术后 D 5 7 P o s t o p e r a t i v e D 5 7 1 0.3 2±3.5 5 2 0.4 0±7.7 9

图6 术后濒死时间线Note.D,The day after surgery.Figure 6 Dying timeline after surgery
3 讨论
本文插管组件和弹簧保护套管设计改良点及优点如下:1)现有技术中采用的粘合材料为牙托材料,本设计采用了符合生物相容性标准的医疗级瞬干胶Apollo 2240配合催化剂作为粘合材料,10 s内即可固化,制作速度快,仅涂布底座面积大小便可得到极佳的固定效果,更无刺鼻气味产生,极大程度上降低了动物所感受到的异物感,缩短了手术恢复期,缓解了动物情绪,降低了实验影响因素。2)现有技术中的垫片为涤纶材料,本设计采用的是聚丙烯材料的疝修补补片,是目前临床上首选的腹壁缺损的修补材料,这种材料经研究证实其具有优良的生物相容性[17],能够刺激纤维组织增生进而快速与组织嵌合[18],加快了伤口恢复,并起到了加固作用,降低了插管脱落的可能性,其次由于其网孔较大,不易隐藏细菌,有抗菌功能,更耐受感染[19]。3)现有技术中插管上为两个不可移动的硅胶球,而本设计为两个可移动的硅胶结点,可以根据动物大小调节结点位置,其中第一结点定位在颈静脉切口处,在第一结点左右两边各与血管结扎,而第二结点左右两边各与皮下肌肉进行结扎,能有效防止导管脱落。4)现有技术仅采用单通螺纹尼龙帽,本设计采用硅胶帽和M4螺纹尼龙帽,比现有技术更能保证插管的清洁[8],降低全身感染率。每日进行肝素通管维护时,只需将尼龙帽和硅胶帽卸下,通管完毕放回饲养笼时再将其装上即可。5)与现有技术相比,本设计通过尼龙帽巧妙地将插管组件与弹簧保护套管相匹配,将输液导管套在插管组件外露的不锈钢导管上,然后将弹簧保护套管的尼龙帽拧接在插管组件上即可给药,由于是螺纹设计,连接非常牢固,且不易被动物破坏,降低了输液导管的破坏率。
在本次实验中,术后第36天开始出现濒死现象,提示我们在长期颈静脉置管给药难以保证完全无菌的情况下,除了使体外各管道通路采取有效办法灭菌外[20],还可采用定期给予抗生素预防的办法以降低濒死率,并同时需要考虑细菌耐药性的产生,更换不同的抗生素。根据本次实验的结果,提示我们如果自主给药周期超过约1个月,就需要密切关注动物的身体状况,在不影响实验目的的情况下,可以采用定期进行血液学检测以及定期进行抗生素预防治疗的办法,以防止由于动物身体状况不佳而造成实验终止的发生。
本文所设计插管组件的插管鼠最佳使用寿命可长达3个月,能够满足自主给药实验的基本需求,应用效果良好,可以推广使用。该插管组件设计除了可以应用于大鼠自主给药成瘾性研究和非临床新药依赖性评价外,还可以应用于需要长期采血的大鼠药物代谢研究,也可应用于静脉途径给药周期较长的长期毒性试验。

