玄驹提取物抗良性前列腺增生作用研究
王勤泉 周超烽 萧云备 武志刚 魏文扬 蔡 健
1. 温州医科大学附属第一医院(浙江温州 325000);2. 杭州施强药业有限公司学术部(浙江杭州 310053)
前 言
良性前列腺增生(benign prostate hyperplasia,BPH)是中老年男性常见疾病,严重影响患者的生活质量。研究显示,40 岁以前BPH 发病率较低,50 岁以后发病率占40%,80 岁以后发病率接近90%,而至90 岁时几乎100%的中老年男性被发现存在前列腺增生[1]。但是,关于BPH 的发病机制目前争议颇多,尚无一个理论或假说能完全解释其发生与发展过程。近年来,有关炎症导致前列腺组织内环境改变及免疫机制紊乱可能与BPH发生发展有关的理论逐渐成为大家关注的一个研究热点[2-4]。并且,随着越来越多的人关注到前列腺炎症与前列腺增生的关系,既往用来治疗前列腺炎的一些药物逐渐被试用于前列腺增生的治疗[5-8]。
复方玄驹胶囊为一种男科常用中成药,具有温肾、壮阳、益精、祛风湿的功效,因其组方中的君药玄驹、臣药淫羊藿、 佐药蛇床子以及使药枸杞子四味药材均具有很好的抗炎作用,而多用于慢性前列腺炎的治疗[9-12]。另外,本实验室前期临床研究结果显示,复方玄驹胶囊对于BPH 也具有一定疗效[13],并且联用5a- 还原酶抑制剂和a- 受体阻滞剂后能更好地改善BPH 患者下尿路症状[14]。因此,本研究旨在从动物水平观察其君药玄驹对于BPH 的影响并探究其中可能的治疗机制,为复方玄驹胶囊治疗BPH 提供一定的理论依据。
材料与方法
一、实验动物
SPF 级健康成年雄性SD 大鼠40 只,体重约200~220g,由温州医科大学动物实验中心提供,均精心饲养在恒温(21-23℃)、日夜12 小时循环交替、饲料和自来水充足的环境中。所有的动物饲养和实验操作符合《温州医科大学动物实验中心规章》,动物饲养及使用均由温州医科大学动物实验伦理委员会批准。
二、主要仪器与试剂
ABI Prism 7500HT 型实时定量PCR 仪(美国ABI公司),MICROM HM340E 石蜡切片机(德国MICROM公司),PowerPac HC 高电流电源电泳仪和ChemiDoc XRS 凝胶成像分析系统(美国Bio-Rad 公司),OLYMPUS BX60 型荧光显微镜(日本OLYMPUS 公司)。Trizol 试剂(北京天根生化科技有限公司,批号:DP405-02),荧光定量PCR 试剂盒 (日本TaKaRa 公司,批号:RR047B),Bcl-2 特异性单克隆抗体(TDY 公司,批号:TDY061),Bax 特异性单克隆抗体 (CST 公司,批号:2772S),HRP 标记山羊抗兔二抗 (TDY 公司,批号:S004),HRP 标记山羊抗鼠二抗(TDY 公司,批号:S001)。
三、实验药品
玄驹提取物(悬浮液;批号:150801)由浙江施强制药有限公司研发部提供,密闭储藏于4℃的冰箱里直至使用。丙酸睾酮 (TP) 注射液 (规格:25mg/mL,批号:130614),购自上海通用药业股份有限公司。非那雄胺片(规格:5mg,批号:130614)购自杭州默沙东制药有限公司。
四、实验方法
(一)实验分组与动物模型的建立
将40 只大鼠在动物实验室适应饲养一周后,随机分为5组,分别为对照组(Control)、模型组(Model)、非那雄胺组 (Finasteride)、 玄驹组 (XJ) 以及联用组(XJ&F),每组8 只。除了对照组大鼠(仅打开阴囊后再缝合)之外,其余大鼠均在完全麻醉下行双侧睾丸切除术。手术一周后,所有的去势大鼠均皮下统一注射丙酸睾酮(按5mg/kg/天),而对照组则皮下注射等量的橄榄油作为对照,并根据所对应的分组,所有大鼠每天被予以特定药物或者生理盐水灌胃,持续灌胃4 周。其中,对照组与模型组均灌生理盐水(10mL/kg),非那雄胺组灌非那雄胺(5mg/kg),玄驹组灌玄驹提取物(80mg/kg),联用组灌玄驹提取物和非那雄胺 (玄驹提取物80mg/kg,非那雄胺5 mg/kg)。
(二)取材
于末次灌胃24h 之后,将所有的大鼠称重,然后在完全麻醉状态下取其前列腺,去除附带组织,用滤纸吸除前列腺组织表面液体后称重; 取每只大鼠一半的前列腺腹叶组织保存在4%多聚甲醛里,并且以石蜡包埋用于组织学检测,而另一半的前列腺腹叶组织则被保存在-80℃,用于开展定量聚合酶链反应(qPCR)及蛋白印迹(WB)实验。
(三)前列腺指数测定
各组大鼠前列腺组织称重,记录数值,计算前列腺指数(PI)。PI=前列腺重量/大鼠体重(mg/g)。
(四)前列腺组织病理形态观察
将固定于4%多聚甲醛的前列腺腹叶组织,经梯度洗脱处理后包埋于石蜡中,常规切片(厚度5μm),苏木精和伊红染色(HE)后在光学显微镜下观察前列腺组织病变情况,并拍照分析结果。
(五)qPCR 法检测前列腺组织中Bax 及Bcl-2 基因mRNA 的表达
设计Bax 和Bcl-2 基因引物序列,见表1。引物合成均由上海生工生物工程有限公司完成。取保存于-80℃的前列腺腹叶组织,采用Trizol 法提取大鼠前列腺组织中的总RNA,逆转录后利用上述引物进行qPCR 扩增反应,以GAPDH 作为内参。反应体系为20μL:各0.5μL 上、下游引物,10μL SYBRPremix Ex TaqTMII,7.0μL 双蒸水,2.0μL 的cDNA 样本。反应条件:95℃预变性30s,(95℃5s,60℃40s)×45 个循环。扩增结束后分析熔解曲线,以鉴定PCR 产物的特异性。采集各个样本量的Ct 值,用GAPDH 作对照,以相对定量ΔΔCt 为方法,按2-ΔΔCt公式计算目的基因mRNA 的相对表达量。


表1 各基因引物序列及产物片段
(六)Western blotting 法检测前列腺组织中Bax 及Bcl-2 基因蛋白的表达
取出前列腺组织,用磷酸盐缓冲液(PBS) 清洗后吸入EP 管中,加入含有终浓度为1 mM 蛋白酶抑制剂的放射免疫沉淀法缓冲液(RIPA)提取总蛋白,采用BCA试剂盒测定上清中蛋白浓度;按20ug/孔加入待测样品进行电泳,采用湿法转膜2h,整个操作过程中勿产生气泡;完成后裁剪聚偏二氟乙烯(PVDF)膜,先用3% 脱脂奶封闭2h,再用洗膜缓冲液(TBST)洗涤5 次(5min/次)后,加入待测蛋白一抗,4℃孵育过夜。TBST 洗膜后再加荧光二抗,室温下避光孵育1.5h,用TBST 洗涤5次(5min/ 次),最后采用ChemiDoc XRS 凝胶成像分析系统扫描,以β-actin 蛋白作为内参照,蛋白水平结果以相对灰度值表示,即目的基因与内参灰度测量的比值。
(七)统计学分析
采用SPSS 20.0 软件进行统计分析,数据均以平均值±标准差(±s)表示。各组数据呈方差齐性时,采用单因素方差分析,方差不齐时,采用独立样本方差分析。以P<0.05 为差异有显著性,P<0.01 为差异有极显著性,有统计学意义。
结 果
一、玄驹提取物对模型大鼠PI 的影响
如图1 所示,相比于对照组,模型组的PI 值显著增加(P<0.01),提示前列腺增生大鼠模型造模成功;与模型组比较,非那雄胺组(P<0.01)、玄驹组(P<0.05)以及联用组(P<0.01)大鼠的PI 值均明显降低,且具有统计学意义,提示各组治疗均有效果。
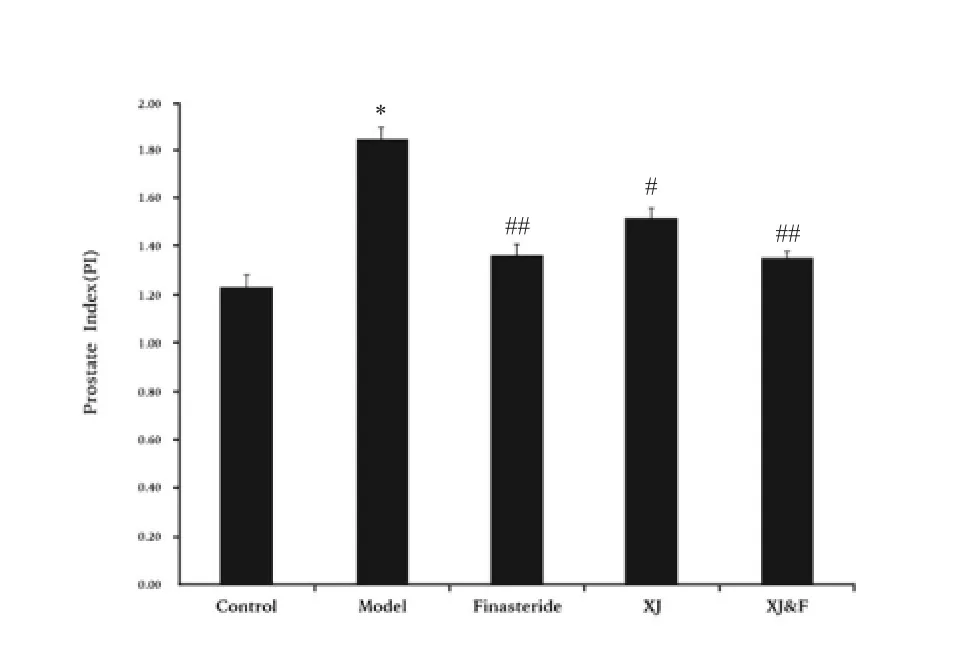
注:n=8/组;Control 为 对 照组,Model 为 模 型组,Finasteride 为非那雄胺组,XJ 为玄驹组,XJ&F 为联用组;与对照组比较:*P<0.01,与模型组比较:#P<0.05,##P<0.01
二、 玄驹提取物对模型大鼠前列腺病理形态的影响
图2 HE 染色结果显示,光镜下对照组大鼠的前列腺腺体大小基本一致,由单层柱状上皮细胞组成的分泌腔有少量嗜酸性分泌物; 而模型组大鼠可见腺体增多且密集,由高柱状、复层上皮细胞组成的分泌腔有大量嗜酸性分泌物; 非那雄胺组在光镜下可见腺体较多且稍密集,但与模型组相比腺体明显减少,且上皮细胞单层柱状与高柱状都有; 玄驹组亦可见腺体较多且稍密集,但与模型组比较明显减少,且上皮细胞单层柱状与高柱状也均有;而联用组的情况接近于对照组,腺体上皮细胞多为单层柱状,有少量复层,分泌物较少,前列腺增生大幅度缓解。
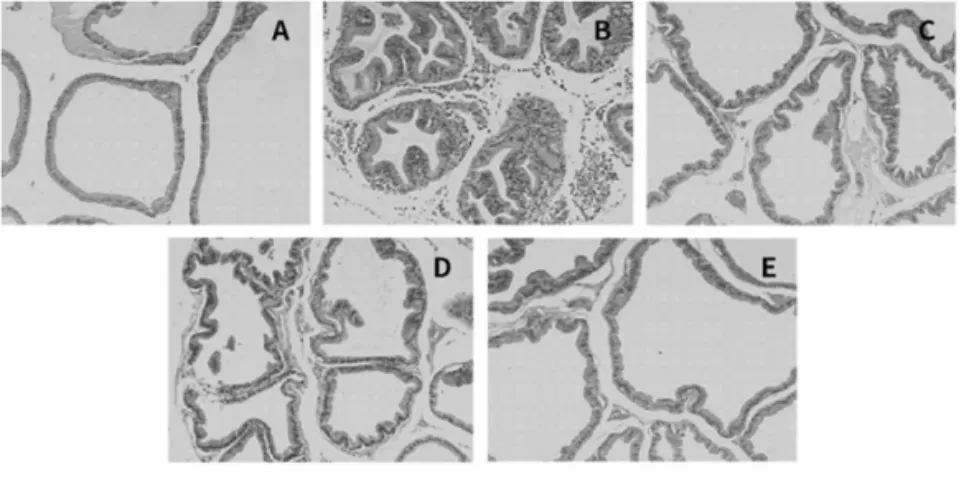
图2 玄驹提取物对前列腺增生大鼠病理形态的影响(HE 染色,×100)
三、玄驹提取物对模型大鼠前列腺组织内Bax/Bcl-2比值的影响
各实验组前列腺组织中Bax 及Bcl-2 基因的mRNA 及蛋白表达检测结果如图3、图4 所示。图3 qPCR实验结果显示,与对照组比较,模型组Bax/Bcl-2 mRNA比值显著降低(P<0.01),治疗4 周后,非那雄胺组、玄驹组以及联用组的Bax/Bcl-2 mRNA 比值被显著升高(P<0.01 或P<0.05),且联用组改善最明显(P<0.01);由图4 WB 实验结果可见,相比于正常组,模型组大鼠前列腺组织内Bax 基因蛋白表达量被显著抑制,而Bcl-2基因的蛋白表达量被显著升高(4A),因此模型组大鼠Bax/Bcl-2 蛋白比值显著降低(4B,P<0.01);经过治疗后发现,相比于模型组,非那雄胺组、玄驹组以及联用组大鼠Bax 基因的蛋白表达量得到不同程度的上调,而Bcl-2 基因的蛋白表达量被不同程度地抑制(4A),进而各组大鼠Bax/Bcl-2 蛋白比值得到显著上调(4B,P<0.01 或P<0.05),其中联用组上调最明显(P<0.01)。
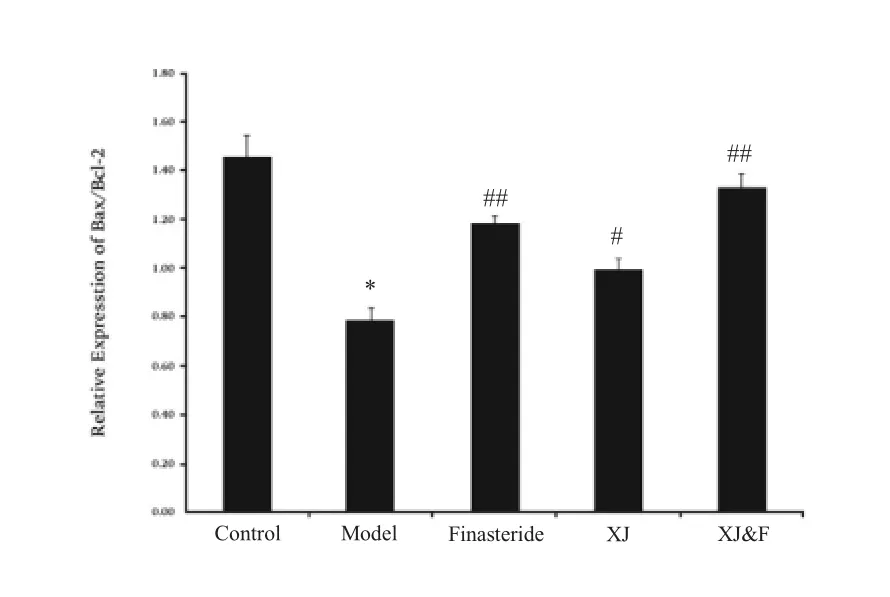
图3 各实验组大鼠前列腺组织中Bax 及Bcl-2 基因的mRNA 相对表达比值
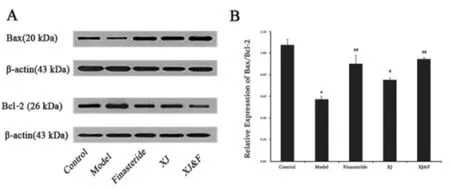
图4 各实验组大鼠前列腺组织中Bax 及Bcl-2 基因的蛋白相对表达及比值
讨 论
关于BPH 的确切发病机制目前仍不是很清楚,但一些临床与实验观察表明,前列腺炎症与前列腺增生的发展密切相关。Nielsen 等通过病理切片研究发现,大部分前列腺增生的组织中均有炎性细胞浸润[15]。此外,一项前列腺药物治疗研究3000 余例的结果也显示,前列腺组织中有炎症改变的患者其前列腺体积较无炎症者显著增大,在其随访过程中合并炎症者发生尿潴留的风险明显高于无炎症改变者[16]。因此,花青素[7]、番茄红素[8]等具有抑制炎性改变作用的植物制剂,在欧美等国家被逐渐应用于BPH 的治疗。在中医学中,专家认为BPH 应归属于“癃闭”范畴,它的主要病机为“肾气亏虚、瘀血阻滞”,故在治疗上以补肾益气、活血祛瘀为主[17]。
复方玄驹胶囊是治疗肾阳虚常用的中成药,几十年来在临床上一直用于治疗阳痿、 男性不育以及慢性前列腺炎等疾病[18-20]。并且,本课题组前期的临床研究结果表明,复方玄驹胶囊对于BPH 也具有一定疗效[13]。玄驹,即拟黑多刺蚁,为复方玄驹胶囊的君药,在组方中发挥着重要作用,可扶正固本、补肾壮阳、养血荣筋、祛瘀通络[21]。现代药理学研究也显示玄驹具有提高性能力、抗炎、调节免疫、调节内分泌等作用[22]。基于此,我们推测玄驹可能在复方玄驹胶囊治疗BPH 中发挥了主要作用,因而本研究的目的为从动物水平上观察玄驹对于前列腺增生的影响并探究其中可能的治疗机制。
本研究采用去势术联合丙酸睾酮注射建立前列腺增生模型,发现模型组大鼠的前列腺组织异常增大,PI也显著升高。HE 染色结果可见模型组大鼠腺体增多且密集,由高柱状、复层上皮细胞组成的分泌腔出现大量嗜酸性分泌物。经玄驹提取物及非那雄胺治疗后,模型大鼠的PI 显著降低,显微镜下观察前列腺腺体明显减少,前列增生情况得到改善,并且玄驹提取物与非那雄胺联用后,对于PI 以及前列增生的改善更加显著,与模型组比较具有显著性差异,这一结果进一步解释了本实验室前期复方玄驹胶囊治疗BPH 的研究结果,表明玄驹可能是复方玄驹胶囊治疗BPH 的主要有效成分,具有明显抑制前列腺增生的作用。研究表明,天然植物锯棕榈浆果提取物可能通过减少相关炎性因子IL-12等的分泌,从而抑制前列腺增生[5,6]。那么,或许玄驹对于前列腺体增生的抑制作用也与其可以明显抑制炎症反应有关[23]。
BPH 的发病机制复杂,目前尚未清楚,前列腺上皮和间质中的细胞增殖和细胞凋亡失衡是其中一个重要机制[24,25]。研究表明,前列腺组织中细胞增殖的增加和细胞凋亡的减少均参与了BPH 的形成过程,因此二者之间的平衡失调是引起BPH 发生的基础[26]。进一步研究前列腺细胞增殖与凋亡后,发现前列腺增生标本的增殖活性与正常前列腺相比明显升高,而细胞凋亡相比于正常前列腺则明显减少,以上结果说明细胞增殖和凋亡共同参与了BPH 的发生[27]。另有研究表明,细胞凋亡是一种选择性的生理死亡,在正常组织中,细胞增殖和细胞凋亡速率是处于平衡状态的,如若发生失衡情况,那么无论是出现细胞复制速率增加还是细胞死亡速率减少,均会造成前列腺细胞的大量堆积以及前列腺增生[28]。Bax 和Bcl-2 是调控细胞凋亡的两个重要基因,其中,Bcl-2 为凋亡抑制基因,抑制细胞的凋亡进程,研究发现,人BPH 的组织标本中Bcl-2 蛋白的表达明显增加,对前列腺增生有明显的促进作用[29],而Bax为凋亡促进基因,与Bcl-2 凋亡抑制功能相反,二者相互结合又彼此抑制,因此,Bax/Bcl-2 之间的比例是决定细胞凋亡强弱的重要环节,与前列腺增生的发生、发展有密切联系[30]。本研究qPCR 及WB 实验结果表明,玄驹提取物能够同时增加在mRNA 及蛋白水平Bax/Bcl-2 的比值,提示玄驹抑制前列腺增生可能是通过调节Bax/Bcl-2 比值,进而促进细胞凋亡来实现的。并且,玄驹联用非那雄胺后对于Bax/Bcl-2 比值的上调作用更加明显。
综上所述,本研究首次验证了玄驹提取物具有明显的抑制前列增生作用,可显著降低前列腺指数,抑制前列腺腺体增生,其机制可能是通过调节凋亡基因Bax/Bcl-2 比例平衡,来促进细胞凋亡从而抑制前列腺增生,这为以玄驹为君药的中成药复方玄驹胶囊临床治疗BPH 提供了一定理论依据。并且,本研究还发现玄驹在联用非那雄胺后对于BPH 的治疗效果更加明显,表明二者联用在BPH 的治疗中发挥了协同增效作用。但是,该研究仍存在一些不足,例如实验样本量过小,并且采用大鼠建立良性前列增生模型是一个比较快速的过程(4 周),而人的良性前列增生形成较缓慢,因此实验结果可能会存在一定误差。另外,关于炎症与BPH 发生发展的机制以及玄驹提取物中发挥主要作用的具体有效成分确定,我们也将会在未来的研究中进一步去深入探讨。

