关于热力学中热力学能和热力学焓的讨论
舒宝生,万 勇,汪晓红
(1.黄冈中学 湖北 黄冈 438000,2.团风中学,湖北 团风 438800,3.黄州区一中,湖北 黄冈 438000)
热力学是从宏观角度研究物质的热运动性质及其规律的科学,以研究能量相互转换规律为基础,在研究化学过程及与化学过程密切相关的物理过程中的能量效应时,必然涉及到反应热力学能(内能,U)和热力学焓(H)两个重要的热力学状态函数[1-3]。为更好地理解这两个状态函数,本文试图从概念、实验测定方法和计算公式三个方面来阐述它们的区别与联系,从分析过程与状态、体系与环境的变化来全面掌握概念,避免死记硬背公式,从而在具体案例中能更好地灵活应用。
1 从概念上理解
热力学能是系统内部的能量,包括了系统中一切形式的能量,如分子的行动移动能、转动能、振动能、电子运动能及原子核内的能等,但系统整体的动能和位能不包括在内[4]。热力学焓的物理意义是体系中热力学能再附加上pV这部分能量的一种能量,即H=U+pV。因二者是状态函数,研究中只需考虑始终态,即ΔU=U终态-U始态和ΔH=ΔU+Δ(pV)。化学反应的热效应等于反应前后体系的热力学能的变化量。对于封闭系统,在定容过程中,不做其它功:Qv=ΔrU;对于封闭体系,恒压,不做其它功时等压热效应:Qp=ΔrH;在等温等压条件下,体系只做体积功时,化学反应的热效应等于体系热力学能的变化与体系所做体积功之和。前者不做其它功,后者只做体积功,两者之间的差异在于体系与环境之间因做体积功而导致能量的差异。差异的大小取决与化学反应发生过程中是体系对环境做功,还是环境对体系做功,即过程决定状态。
2 从实验测定方法上理解
ΔU的实验测定是通过氧弹式量热计测定的,其测量装置如图1所示,其工作方式属于温差式的环境恒温式,氧弹作为发生热化学反应的容器,即定容反应室,绝热外套是一个充满水的双层容器,形成一个恒温环境,盛水容器充当热量传导介质,化学反应热效应通过容器水温变化间接测得定容热效应[5],即Qv=ΔrU。
而ΔH是通过杯式量热计测定的,其测量装置如图2所示,测得的是定压热效应。其中保温杯保证反应体系在一个绝热环境下进行,温度计记录反应体系温度的变化,搅拌器确保反应体系温度均匀,电加热器用于标定热量计的热容。整个过程与大气压相通,因而是等压反应,所得结果Qp=ΔrH。
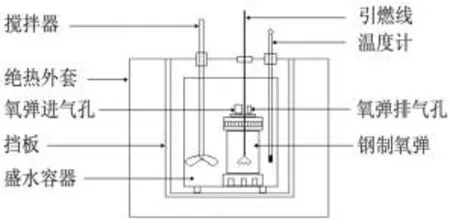

图1 氧弹式量热计Fig. 1 Oxygen bomb calorimeter
ΔU与ΔH二者也相互联系,如果一个化学反应,反应前后气体分子数没有变化,ΔU等于ΔH;如果一个化学反应,反应前后气体分子数增大,要保持定压,则体系的体积会增大,体系对环境做功,ΔH应小于ΔU;如果一个化学反应,反应前后气体分子数减小,要保持定压,则体系的体积会减小,环境对体系做功,ΔH应大于ΔU。
3 从计算过程上理解
对于化学反应,能量关系为[6-9]:
Qp=Qv+RT∑υB(g),
进而得到ΔrH=ΔrU+RT∑υB(g)。
3.1 反应前后气体分子数不变
如图3所示,对于等压过程和等容过程而言,体积没有发生变化,体系与环境之间,都没有做功,∑υB(g)=0,ΔrH=ΔrU。
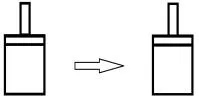
图3 反应前后气体分子数不变Fig. 3 The number of gaseous molecules remains unchanged before and after the reaction
3.2 反应后气体分子数增加
如图4所示,从等容过程到等压过程,反应体积增大,意味着随着反应的进行,体系要对环境做功,此时,ΔrU应比ΔrH减少RT∑υB(g)的能量,∑υB(g)>0。

图4 反应后气体分子数增加Fig. 4 The number of gaseous molecules adds after the reaction
3.3 反应后气体分子数减少
如图5所示,从等容过程到等压过程,反应体积减少,意味着随着反应的进行,环境要对体系做功,此时,ΔrU应比ΔrH增加RT∑υB(g)的能量,∑υB(g)<0。
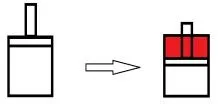
图5 反应后气体分子数减少Fig. 5 The number of gaseous molecules decreases after reaction
从上述过程分析,可以看出,学生对公式的理解上,只要分析反应的特点,进而分析反应过程,就能够比较ΔrH和ΔrU的大小,计算其结果。
4 实例分析
实例:在25 ℃时,将0.92 g甲苯置于一含有足够O2的绝热刚性密闭容器中燃烧,最终产物为25 ℃的CO2和液态水,过程放热39.43kJ。试求下列化学反应计量式的标准摩尔焓变。
2C6H6(l)+ 15O2(g)→12CO2(g)+ 6H2O
此例从无机化学中热力学的基础内容入手,求标准摩尔焓变。甲苯在绝热刚性密闭容器中燃烧,则该系统体积不发生变化,即为定容反应热,没有体积功,又因为绝热,系统与环境没有热交换,燃烧产生的热量全部转化为热力学能,因此
ΔU=Qv。
n甲苯=m甲苯/M甲苯
=0.92g/92g·mol-1
=0.010 mol
反应为燃烧反应,系统放热:
ΔrUm=-39.43kJ/0.010 mol
=-3943 kJ·mol-1
由化学方程式可知该反应前后气体分子总数减少,υB<0,即随着反应的进行,对于等压过程,系统体积不断缩小,直至反应完全,环境对系统做功,对比Qv或ΔU,系统能量增加,增加量为RT∑υB,这与RT∑υB<0,分析的结果一致。
ΔrHm=ΔrUm+RT∑υB
=-3943+ (7-9)×8.314×298.15×10-3kJ·mol-1
=-3948 kJ·mol-1
直接套用公式,无法确定RT∑υB的正负,也无法比较ΔrUm和ΔrHm的大小。了解系统所在状态和反应发生的过程,分清定容反应热和定压反应热。分析反应过程中系统与环境的做功情况。
本文针对化学反应过程中存在气体变化的情况,对三种可能出现情况作出了图示解释,有助于学生对化学反应中的系统与环境,过程与状态的理解。并通过例题的分析,系统地了解化学反应热的两种测定和计算方式,从而达到培养学生分析问题,解决问题能力的目的。
如果对所研究的系统和系统发生的过程不了解,则很难正确分析系统与环境的物质和能量交换,易混淆定容反应热和定压反应热,定容反应过程和定压反应过程的含义。
通过以上的归纳和总结,有助于学生对化学反应的热力学能和热力学焓的理解和掌握,有助于提高无机化学课程的教学质量。

