桦木酸对T-2毒素致小鼠肠道氧化损伤的保护作用
黄城龙,朱利娟,易想炼,黄 琳,欧朝萍,马玉容,邬 静,2,3,李荣芳,2,3,*,易金娥,2,3,*
(1.湖南农业大学动物医学院,湖南 长沙 410128;2.湖南畜禽安全生产协同创新中心,湖南 长沙 410128;3.畜禽保健湖南省工程研究中心,湖南 长沙 410128)
真菌毒素是由真菌产生的次生代谢产物,目前已确认的约有300多种霉菌代谢产物仅对人和动物有毒[1]。据估计,全球约25%的农产品在一定程度上受到霉菌毒素的污染[2],而单端孢霉烯族毒素是农业上对全球健康构成潜在危害的最重要的真菌毒素之一[1]。早在1973年联合国粮食及农业组织/世界卫生组织就将单端孢霉烯族毒素列为最危险的天然存在的食品污染毒物之一。单端孢霉烯族真菌毒素从结构上可分为A、B、C、D 4 种类型[3],B类最常见,且结构复杂,通常称为大环单族毒素。而A类结构比较简单,为非大环类,通常由镰孢菌产生。在动物体内,A类单端孢霉烯族真菌毒素的毒性为B类的10~100 倍,而T-2毒素属于A类单端孢霉烯族,是此类毒素中急性毒性最强的毒素[4]。T-2毒素广泛分布在小麦、大麦、燕麦、玉米、谷物以及动物饲料中,其性质稳定,难以清除,对机体免疫系统、消化系统、神经系统等都有较强的损害作用[5-6]。研究报道,T-2毒素能够降低肠上皮细胞的存活率[7],从而损害肠道屏障,造成动物和人类的肠道疾病[8]。近年来大量研究表明,机体产生氧化应激是T-2毒素毒性作用发挥的基本机制之一[9]。据报道,4.8 mg/kg mbT-2毒素能诱导虾明显的氧化损伤[10],4 mg/kg mbT-2毒素能广泛引起大鼠肝脏、脾脏、胸腺和胃组织氧化损伤[11]。
氧化损伤与许多人类疾病密切相关。事实上,许多疾病的病理基础都是氧化损伤[12]。在所有完全分化的器官中,由于肠细胞更新频繁,不断暴露于外源性物质中,肠组织比其他器官更容易受到氧化损伤[13]。越来越多的证据表明,各种肠道疾病,甚至它们的致病因素,都与氧化损伤有关。因此,寻找一种天然有效的抗氧化剂,对于维护肠道健康和预防疾病的发生具有重要意义。
桦木酸(betulinic acid,BA)是一种来源于羽扇豆的三萜化合物,广泛存在于食品、水果、蔬菜和植物中。BA是一种具有多种生物学活性的天然活性物质,如抗氧化应激、抗炎、提高机体免疫力、抗肿瘤、抗疟疾以及抗艾滋病毒等。本课题组对BA的免疫调控和抗氧化作用开展了大量的研究工作,发现BA能够缓解酒精性肝损伤[3],调控地塞米松诱导的淋巴细胞凋亡[14],减轻环磷酰胺造成的肠道氧化损伤[15],这些保护作用都与BA的抗氧化能力有关。那么,对于霉菌毒素造成的肠道氧化损伤,BA是否同样具有预防性保护作用?对此目前鲜有报道。因此,本实验通过给小鼠进行T-2毒素攻毒建立肠道氧化损伤模型,研究BA对机体的体液免疫、肠道黏膜屏障功能以及抗氧化能力的影响,为BA的抗氧化作用以及功能性食品开发提供理论依据。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性KM小鼠60 只,体质量(20±2)g,4~5 周,购于湖南斯莱克景达实验动物公司(生产许可证号SCXK(湘)2009-0004),使用M02小鼠普通饲料饲喂。
T-2毒素 新加坡Pribolab公司;BA 美国Sigma公司;苏木精-伊红(hematoxylin-eosin,H&E)染色液 武汉谷歌生物科技有限公司;免疫球蛋白(immunoglobulin,Ig)G、IgM、二胺氧化酶(diamine oxidase,DAO)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒武汉华美生物科技有限公司;BCA蛋白浓度测定试剂盒、过氧化氢酶(catalase,CAT)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒、谷胱甘肽(glutathione,GSH)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒 南京建成生物工程研究所。
1.2 仪器与设备
JXFSTPRP-24全自动样品快速研磨仪 上海净信实业发展有限公司;Infinite 200 PRO多功能酶标仪美国BioTek公司;AFX1-0501-P超纯水仪 台湾艾科浦公司;5404EQ220531高速冷冻离心机 德国Eppendorf公司;超薄切片机 德国Leica公司;U410-86 超低温冰箱 英国New Brunswick Scientific公司;AY220电子天平 日本岛津有限公司。
1.3 方法
1.3.1 小鼠分组与给药
BA和T-2毒素的剂量根据前期研究以及预实验来确定[3,14],VE作为阳性对照组[16]。将健康雄性KM小鼠置于室温(22~25 ℃)、相对湿度为50%~70%的动物饲养室中适应性饲养1 周后,随机分为6 组(n=10),分别为对照组,T-2毒素组,BA低、中、高剂量组(0.25、0.5、1 mg/kg mbBA+T-2毒素),VE组(100 mg/kg mbVE+T-2毒素)。将BA与VE混悬于质量分数1%的可溶性淀粉中进行灌胃,1 次/d,连续灌胃14 d,对照组和T-2毒素组灌服可溶性淀粉。最后一次灌胃10 h后,除空白对照组注射等量乙醇+磷酸盐缓冲液混合液外,其余各组将T-2毒素溶于磷酸盐缓冲液与乙醇溶液,腹腔注射4 mg/kg mbT-2毒素,建立肠道氧化损伤模型。
1.3.2 样本采集与相关指标检测
小鼠自由饮水,禁食15 h后,眼球采血,3 000 r/min离心15 min,收集血清,用ELISA法检测IgG、IgM、DAO水平;取小肠组织(十二指肠、空肠和回肠)于生理盐水中轻轻晃动除净肠道内容物,其中将一部分空肠固定于福尔马林中,用于H & E染色观察肠道形态结构的改变,剩余十二指肠、空肠和回肠部分制成10%组织匀浆液,3 000 r/min离心15 min,收集上清液,按照试剂盒说明书检测CAT、GSH-Px、MDA、GSH等氧化指标水平和各组织蛋白浓度。
1.4 数据分析与处理
所测数据采用SPSS 22.0软件进行统计分析,数据分析采用单因素方差法,两两比较采用q检验,结果以平均值±标准差表示,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 BA对T-2毒素致小鼠血清IgG和IgM水平的影响
机体的免疫系统对维持机体的健康至关重要。IgG是机体体液免疫的重要指标,具有抗菌和中和病毒的作用。在原发性免疫应答中,大多数Ig属于IgM类,在宿主对抗病原体的前线防御中起着至关重要的作用[17]。它们能引起可溶性抗原的沉积,从而提高免疫系统通过吞噬作用消除抗原的能力,保护机体免受感染和损伤。

图1 BA对T-2毒素致小鼠血清IgG(A)和IgM(B)水平的影响Fig. 1 Effect of BA on IgG (A) and IgM (B) levels in serum of mice treated with T-2 toxin
如图1所示,与对照组相比,T-2毒素降低了小鼠血清中IgM质量浓度(P>0.05);与T-2毒素组相比,中、高剂量的BA预处理显著升高了血清中IgG和IgM质量浓度(P<0.01,P<0.05);同样VE预处理显著升高血清中IgG和IgM质量浓度(P<0.05)。说明BA和VE都能够提高小鼠的机体免疫力。
2.2 BA对T-2毒素致小鼠血清DAO活力的影响

图2 BA对T-2毒素致小鼠血清DAO活力的影响Fig. 2 Effect of BA on DAO activity in serum of mice treated with T-2 toxin
DAO是由小肠上皮细胞产生的一种胞内酶,血清DAO的水平与肠屏障损伤和修复密切相关[18-20]。如图2所示,与对照组相比,T-2毒素升高了血清中DAO活力(P>0.05)。与T-2毒素组相比,各剂量组BA均降低了血清DAO的活力,其中高剂量组差异极显著(P<0.01);VE组预处理后极显著降低了血清中DAO的活力(P<0.01)。这说明了BA和VE都能够改善小鼠肠道的屏障功能。
2.3 BA对T-2毒素致小肠CAT活力的影响
CAT是机体抵抗氧化应激的第一道防线,能够催化无机过氧化物H2O2发生水解,从而保护机体不被自由基侵害。由图3可知,与对照组相比,T-2毒素组显著或极显著降低十二指肠、空肠和回肠CAT活性(P<0.01,P<0.05);与T-2毒素组相比,BA各剂量组均显著或极显著增强十二指肠、空肠和回肠CAT活性(P<0.01,P<0.05),VE组能显著增强十二指肠、空肠和回肠CAT活性(P<0.05)。


图3 BA对T-2毒素致小鼠十二指肠(A)、空肠(B)和回肠(C)CAT活力的影响Fig. 3 Effect of BA on CAT activity in duodenum (A), jejunum (B) and ileum (C) of mice treated with T-2 toxin
2.4 BA对T-2毒素致小鼠小肠GSH-Px活力的影响

图4 BA对T-2毒素致小鼠十二指肠(A)、空肠(B)和回肠(C)GSH-Px活力的影响Fig. 4 Effect of BA on GSH-Px activity in duodenum (A), jejunum (B)and ileum (C) of mice treated with T-2 toxin
GSH-Px是机体重要的抗氧化酶,能够保护细胞膜免受脂质过氧化。由图4可知,与对照组相比,T-2毒素组显著降低十二指肠和空肠GSH-Px活性(P<0.05);BA预处理后,极显著增强十二指肠和空肠GSH-Px活性(P<0.01),中剂量的BA极显著增强回肠GSH-Px活性(P<0.01),VE极显著升高十二指肠和空肠GSH-Px活性(P<0.01)。
2.5 BA对T-2毒素致小鼠小肠MDA含量的影响
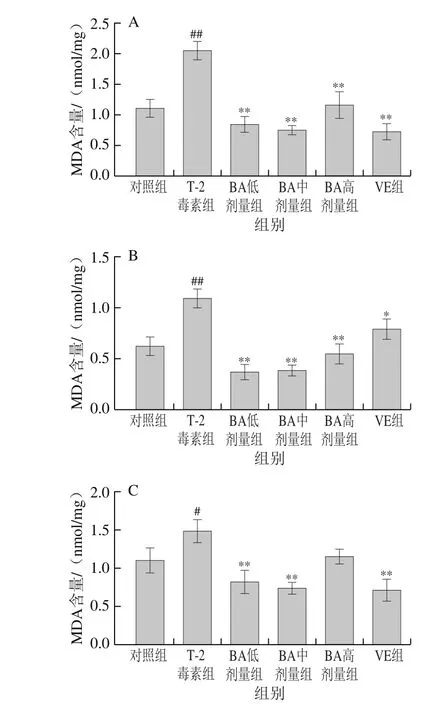
图5 BA对T-2毒素致小鼠十二指肠(A)、空肠(B)和回肠(C)MDA含量的影响Fig. 5 Effect of BA on MDA contents in duodenum (A), jejunum (B)and ileum (C) of mice treated with T-2 toxin
MDA是脂质过氧化的主要终产物,被认为是氧化损伤的生物标志物。由图5可知,T-2毒素显著或极显著升高了十二指肠、空肠和回肠MDA含量(P<0.01,P<0.05);与T-2毒素组相比,BA各剂量组极显著降低十二指肠和空肠MDA含量(P<0.01),低和中剂量的BA极显著降低回肠MDA含量(P<0.01),同样,VE显著或极显著降低各肠段MDA含量(P<0.01,P<0.05)。
2.6 BA对T-2毒素致小肠GSH含量的影响
GSH作为GSH-Px的辅助因子,在机体抗氧化防御系统中同样发挥着重要作用。由图6可知,与对照组相比,T-2毒素组极显著降低了空肠GSH含量(P<0.01);与T-2毒素组相比,BA各组能提高各肠段GSH水平,以空肠差异极显著(P<0.01),VE也能极显著提高空肠GSH含量(P<0.01)。

图6 BA对T-2毒素致小鼠十二指肠(A)、空肠(B)和回肠(C)GSH含量的影响Fig. 6 Effect of BA on GSH contents in duodenum (A), jejunum (B)and ileum (C) of mice treated with T-2 toxin
2.7 BA对T-2毒素致小鼠空肠形态的影响

图7 H & E染色观察BA对T-2毒素致小鼠空肠形态结构的影响(100×)Fig. 7 Effect of BA on intestinal morphological structure in mice treated with T-2 toxin evaluated by H & E staining (100 ×)
如图7所示,对照组小鼠肠绒毛形态结构正常(图7A);T-2毒素引起肠绒毛排列不整齐,肠绒毛变短,不同程度断裂或溶解,肠绒毛间松散,隐窝加深等现象(图7B);BA预处理后,能改善肠绒毛的形态结构,肠绒毛相对较长,排列较规则,绒毛间隙相对较紧凑(图7C~E),VE预处理同样改善肠绒毛形态结构(图7F)。
3 讨 论
肠道的健康对于机体的健康至关重要,食物的摄取和消化、营养物质的吸收都要通过肠道组织,又因为肠道使机体与外界直接相接触,极其容易受到微生物的侵染,所以肠道也是机体最易发生氧化损伤的场所之一。血清免疫球蛋白能通过与抗原结合达到清除病原体、中和毒素和增强超氧化物歧化酶(superoxide dismutase,SOD)活性而发挥抗衰老作用,是免疫系统的重要组成部分,其含量一定程度上反映了机体免疫功能的强弱[21]。血清中IgA、IgG和IgM是免疫反应中常见的免疫球蛋白,是机体体液免疫的分子基础,发挥着特异性免疫作用,起着免疫防护作用。IgG是人体内含量最多的免疫球蛋白,是免疫的主力军,IgM不能通过血管壁,多存在于血液中,是初次免疫应答反应中出现最早的抗体,被称为免疫反应的先头部队[22]。当机体受到外界抗原物质刺激时,机体会产生大量的免疫球蛋白,如IgG、IgM、IgA等,迅速招募具有吞噬功能的先天性免疫细胞(粒细胞、单核细胞),激活炎症反应,保护机体免受损伤[23-24]。大量研究证明,T-2毒素广泛分布于自然界中,与人类日常生活密切相关,对人类和动物健康有很大潜在危害性,特别是在消化系统、神经系统和生殖系统方面危害性极大[25]。在本研究中,T-2毒素处理后,小鼠血清中IgM水平下降;而BA预处理后,中、高剂量组均显著提高了血清IgG、IgM水平,这表明BA可能通过提高机体体液免疫能力来保护肠道的健康。DAO是一种细胞内酶,在小肠绒毛顶端的肠细胞中尤为丰富,故其在小肠中活性最高。而在正常机体血清中其活性都很低,当肠黏膜细胞坏死或肠黏膜屏障功能衰竭时,会造成肠绒毛损伤脱落,从而进入血液中,使其在血液中的活性升高。因此,血液中DAO的活性变化能够很好地反映肠道黏膜的损伤程度[26]。本实验中,T-2毒素组血清中DAO活性的变化差异不显著,但表现出升高的趋势。结合肠道组织病理学结构的结果发现,在T-2造模组引起肠绒毛排列不整齐,肠绒毛变短,不同程度断裂或溶解,肠绒毛间松散,隐窝加深等现象,这也进一步验证T-2毒素在一定程度上破坏了肠黏膜的完整性,造成肠道黏膜损伤,肠绒毛断裂,进而诱发肠道黏膜屏障功能障碍。而BA预处理后能改善肠绒毛的形态结构,缓解肠绒毛缩短,使其恢复规则的排列,同时BA还能提高T-2诱导小鼠血清中DAO的活性,其中BA高剂量组差异极显著。这说明BA可缓解T-2诱导肠黏膜结构的破坏,有效地降低肠黏膜的通透性,具有预防性保护肠道黏膜损伤,增强肠道屏障功能的作用。
在正常的生理状态下,动物体内的抗氧化防御和促氧化作用处于动态平衡状态。如果失衡会导致活性氧(reactive oxygen species,ROS)和自由基含量的升高,引起氧化应激[27-28]。当体内ROS和自由基的产生超过了肠道组织的抗氧化防御系统的能力就会造成肠道组织氧化损伤,导致蛋白质修饰和脂质过氧化,进而引起肠道组织功能障碍和疾病的产生[29]。因此,机体只有通过加强合成抗氧化酶和修复生理系统来应对氧化应激。正常肠黏膜具有高效的抗氧化防御系统,包括SOD、CAT和GSH-Px等酶,以及GSH和金属硫蛋白等非酶类小分子[30]。SOD通过催化超氧阴离子生成过氧化氢(H2O2);CAT和GSH-Px具有及时消除歧化反应产生的自由基,分解其他过氧化物的作用,能够将H2O2转化成水。GSH为衡量氧化应激标志性指标,对机体抗氧化能力同样发挥着重要作用[31]。当机体受到环境毒素的侵害,处于氧化应激状态时,CAT和GSH-Px的酶活性会降低,GSH含量会减少,MDA含量会升高[32-34]。Chaudhari等[10]报道T-2毒素可以刺激细胞产生大量的ROS,从而诱发氧化应激,造成细胞损伤。本研究结果与其一致,在T-2毒素作用下,小鼠小肠各肠段(十二指肠、空肠和回肠)的CAT、GSH-Px活性均下降,GSH含量均减少,MDA含量均升高,这说明T-2毒素诱发小鼠肠道发生脂质过氧化,产生了氧化应激反应,肠道氧化损伤模型构建成功。本实验用BA进行预处理,能够缓解T-2毒素引起的肠道CAT、GSH-Px等抗氧化酶活性的下降,提高肠道GSH水平,降低MDA含量,这说明BA通过提高肠道抗氧化能力对肠道氧化损伤起到预防性保护作用。这与前期研究结果一致,BA通过提高机体抗氧化能力减缓地塞米松或环磷酰胺致淋巴细胞氧化损伤[14-15,32-33]。本实验中还发现,BA对十二指肠、空肠和回肠3个肠段的氧化损伤具有保护作用,其中BA预处理恢复空肠抗氧化防御和促氧化作用系统的平衡较为明显,这可能与空肠的结构和功能有关,空肠是小肠中最长的一段,空肠各种消化酶活性均较高,是营养物质消化的主要部位,而影响消化酶活性的物质也影响抗氧化指标[35-36],所以BA可能有选择性地提高空肠抗氧化酶的活性,降低MDA的含量。具体机制需要进一步探究。
4 结 论
BA可以通过提高小鼠血清IgG、IgM水平,提高机体体液免疫功能,通过减少血清DAO活性,缓解肠道结构的破坏,从而增强肠黏膜屏障功能,同时通过提高小肠各肠段的CAT、GSH-Px、GSH水平、降低MDA含量来提高肠道抗氧化能力,对T-2毒素引起的小鼠肠黏膜氧化损伤起到预防性的保护作用。

