动态高压微射流处理对红芸豆多糖基本结构特征、流变性质和固体形貌的影响
李安琪,黄晓君,聂少平,殷军艺*
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
动态高压微射流(dynamic high pressure microfluidization,DHPM)是一种新兴的高压均质手段,广泛应用于蛋白质改性、微生物抑制、饮料均质、碳水化合物改性[1-3]等方面。该技术利用高压使物料在高速通过狭缝的过程中受到剧烈旋转、高速剪切、高频振荡等综合作用,实现物料的细化和均一化[4-5],从而达到增加物料稳定性的作用。已有研究表明,DHPM技术可有效提高大豆膳食纤维中可溶性膳食纤维的含量,降低不可溶性膳食纤维的含量,从而提高豆制品的稳定性[6-7]。同时,有研究报道,DHPM技术会引起致敏性免疫球蛋白的构象变化和促进免疫球蛋白与多糖发生糖基化反应,从而降低致敏性免疫球蛋白的抗原性,进而降低免疫球蛋白的致敏性[8-9]。
芸豆富含人体所需营养成分,如蛋白质、酚类、碳水化合物、矿物质、维生素等[10],其中淀粉和非淀粉多糖的含量较高[11]。目前有关芸豆化学成分的研究主要集中在淀粉、蛋白质、植物凝集素、酶抑制剂、抗氧化剂、黄酮等化合物的结构与生物活性功能方面[12-15];其中芸豆多糖具有较强的降低餐后血糖水平的功效,搭配日常主食食用可以达到预防糖尿病的目的[16-17]。现有的报道显示,在化学结构方面,芸豆中的非淀粉多糖主要为果胶成分,如Shiga等[18]从芸豆子叶提取出果胶水溶性多糖,发现主要重复片段是木糖半乳糖醛酸聚糖型果胶,分支主要是由寡聚阿拉伯糖和短链半乳聚糖构成。
现代豆制饮品在加工过程中常利用均质技术提高其稳定性,但是部分研究显示DHPM可以改变多糖的结构特性[19],从而改变多糖的理化性质。因此研究DHPM处理对芸豆多糖的影响,对于将芸豆应用于豆类饮料制品中具有潜在价值。本实验针对红芸豆多糖(red kidney bean polysaccharide,RKBP)进行DHPM处理,分析其均质前后的基本结构特征、流变性质和固体形貌等变化,以期为今后相关产品开发提供理论数据参考。
1 材料与方法
1.1 材料与试剂
红芸豆产地为山西省朔州市朔城区,清洗种子表面的杂质后自然干燥,密封保存。
单糖标准品(岩藻糖(fucose,Fuc)、鼠李糖(rhamnosus,Rha)、阿拉伯糖(arabinose,Ara)、半乳糖(galactose,Gal)、葡萄糖(glucose,Glc)、甘露糖(mannose,Man)、果糖(fructose,Fru)、半乳糖醛酸(galacturonic acid,GalA)、葡萄糖醛酸(glucuronic acid,GlcA)) 美国Sigma公司;木糖(xylose,Xyl) 北京百灵威公司;葡聚糖标准品(T-10、T-40、T-50、T-70、T-500、T-2000) 美国Pharmacia公司;牛血清白蛋白 美国Amersco公司;考马斯亮蓝G-250 上海阿拉丁生化科技股份公司;浓硫酸、苯酚、3-苯基酚、四硼酸钠等均为国产分析纯。
1.2 仪器与设备
M-7125-30型微射流均质机 美国Microfluidics公司;E2695高效液相色谱仪 美国Waters公司;Dionex ICS 5000离子交换色谱系统、Nicolet 5700傅里叶变换红外光谱仪 美国Thermo公司;Milli-Q超纯水仪 美国Millipore公司;12 L立式冷冻干燥机 美国LABCONCO公司;T-9双光束紫外-可见分光光度计 北京普析通用仪器公司;热重(thermal gravimetric,TG)分析仪美国PE公司;ARES-G2流变仪 美国TA公司;JSM 6701F场发射扫描电子显微镜(scanning electron microscope,SEM)(配有能谱仪) 日本电子株式会社;AVIII 400 MHz核磁共振(nuclear magnetic resonance,NMR)仪 德国Bruker公司。
1.3 方法
1.3.1 可溶性RKBP提取
红芸豆粉碎后过40 目筛,称取一定量的芸豆粉,以1∶5的料液比加入体积分数95%乙醇溶液浸泡24 h,挥干乙醇后,再以料液比1∶20加入蒸馏水,95 ℃搅拌4 h,过滤、去渣。提取液分别用α-淀粉酶(95 ℃、1 h)、蛋白酶(60 ℃、0.5 h)、糖化酶(60 ℃、0.5 h)酶解,100 ℃灭酶10 min,冰浴冷却,离心(5 000 r/min,10 min)收集上清液。上清液浓缩至原体积的1/3,加入乙醇沉淀。离心收集沉淀,蒸馏水复溶后透析48 h,浓缩,冷冻干燥,得到可溶性RKBP。
1.3.2 DHPM处理RKBP
RKBP配制成20 mg/mL的溶液,磁力搅拌至充分溶解,分别使用40、80、120 MPa的压力对多糖样品进行均质处理,每个压力下均循环处理3 次,然后通过离心(10 000 r/min、4 ℃、15 min)去除沉淀,透析48 h,浓缩,冷冻干燥,收集均质后多糖,不同压力(40、80、120 MPa)处理样品依次命名为:RKBP-40M、RKBP-80M、RKBP-120M。
1.3.3 基本理化性质分析
以Glc为标准品,采用苯酚-硫酸法[20]测定中性糖质量分数。以GlaA为标准品,采用间羟基联苯法[21]测定糖醛酸质量分数。采用考马斯亮蓝法测定多糖中的蛋白质量分数[22]。
1.3.4 相对分子质量测定
将多糖用流动相配制成质量浓度为1 mg/mL的溶液,用0.22 μm尼龙滤膜过滤进样,采用高效体积排阻色谱法(high performance size exclusion chromatography,HPSEC)-多角度激光光散射(multiangle laser light scattering,MALLS)系统分析检测。
HPSEC-MALLS系统参数:高效液相色谱泵(Model 1500)、保护柱P8514-000、串联SB-804HQ和SB-806HQ色谱柱、检测系统(MALLS检测器、示差检测器、黏度检测器)。流动相:0.1 mol/L NaNO3(含有质量分数0.02% NaN3),流速0.6 mL/min;进样量为100 μL。利用ASTRA 6.1软件采集和分析数据。
1.3.5 单糖组成分析
准确称取5 mg样品于厚壁耐压瓶中,加入0.5 mL 12 mol/L硫酸在冰浴条件下磁力搅拌30 min,然后加入2.5 mL超纯水,100 ℃条件下油浴搅拌反应2 h,充分冷却,将样品全部转移至50 mL容量瓶,定容并摇匀,再稀释5 倍体积后过0.22 μm水系滤膜,采用离子交换色谱仪进样分析[29]。
准确称取5 mg Fuc、Rha、Ara、Glc、Gla、Man、Xyl、Fru、GlaA、GlcA标准品于50 mL容量瓶中,加入超纯水溶解并定容摇匀,配制成单糖混标母液。将母液梯度稀释为不同质量浓度的混标溶液,过0.22 μm水系滤膜,采用离子交换色谱仪进样分析。
检测条件为保护柱:Dionex CarboPacTMPA20(30 mm×3 mm);色谱柱:Dionex CarboPacTMPA20(150 mm×3 mm);流动相:1 mol/L醋酸钠、250 mmol/L氢氧化钠、超纯水。柱温:30 ℃;进样量:10 μL。
单糖相对含量按下式计算。

1.3.6 傅里叶变换红外光谱分析
将样品真空干燥12 h,取适量样品和溴化钾充分混匀、研磨,压片,利用傅里叶变换红外光谱仪在4 000~400 cm-1区内对样品进行扫描分析。
1.3.7 热稳定性分析
称取适量样品放入TG分析仪,分析不同压力处理多糖的热稳定性。测试条件:扫描温度:30~700 ℃:升温速率:10 ℃/min;N2流速:20 mL/min。
1.3.8 表观黏度分析
将高压微射流处理前后RKBP样品配制成质量浓度为30 mg/mL的溶液,充分溶解,于25 ℃室温静置12 h,利用ARES-G2流变仪测定其表观黏度(夹具直径为40 mm,测定间隙为0.046 mm),测试温度为25.0 ℃,剪切速率0.01~1 000 s-1,采用TA Orchestrator-7软件采集数据。
1.3.9 SEM观察
将高压微射流处理前后RKBP样品配制成质量浓度为1 mg/mL的溶液,充分溶解,于液氮中固定10 min,冷冻干燥,采用Model IB-3离子镀膜机进行喷金处理,于SEM下观察,通过XT Microscope Control软件采集图谱。
1.3.10 NMR分析
称取高压微射流处理前后RKBP样品50 mg,溶于12 mL重水,冷冻干燥,重复3 次。经重水交换后的样品溶于0.55 mL重水,充分溶解,室温静置12 h后,进行NMR测试,得到1H NMR图谱,所有样品均在293 K条件下测定。
1.4 数据处理与分析
样品进行3 次平行实验,结果用平均值±标准偏差表示。采用SPSS软件进行统计,对不同均质压力处理的样本进行单因素方差分析,采用Tukey法进行两两比较,P<0.05认为差异具有统计学意义。
2 结果与分析
2.1 DHPM处理对RKBP基本理化性质的影响
表1为DHPM处理对RKBP基本理化性质影响的测定结果。经DHPM处理后的样品中性糖质量分数、糖醛酸质量分数显著提高,样品中的蛋白质量分数呈一定的下降趋势,由1.82%最低下降至1.03%,已有研究表明,蛋白质经过高压均质作用后,其分子粒径减小,暴露出更多的带电基团,分子间静电排斥力增强,进而导致其亲水性、流动性增加[23]。因此结合样品制备过程分析,可能是蛋白质经DHPM处理后粒径减小、溶解性增强,在样品制备后期的透析过程中流失;因此,样品中的蛋白质量分数有所降低。上述结果显示,经过高压微射流均质处理后,样品的糖含量有一定提升。在不同压力处理下,样品得率为68%~81%,这可能是样品进入均质机前的适当润洗、少量样品均质时在仪器中的残留,以及均质后样品离心时损失了少量不溶物造成的[24]。

表1 DHPM处理前后RKBP的基本理化性质Table 1 Physicochemical properties of RKBP before and after DHPM treatment
2.2 DHPM处理对RKBP表观黏度的影响
从图1可知,随着剪切速率的增加,样品的表观黏度呈下降趋势,说明样品属于典型的非牛顿流体。这可能是由于多糖在DHPM处理过程中,由于高剪切力和湍流力造成了有序或无序的构象转变以及多糖分子链的断裂,致使其黏度降低[25]。也有研究表明,微射流造成样品黏度下降可能是因为多糖这类聚合物在高剪切力和湍流力作用下相对分子质量被平均化[26]。剪切速率较低时,RKBP-40M、RKBP-80M的表观黏度和RKBP差异不明显,而RKBP-120M的黏度明显小于另外3 个样品。随剪切速率的增加,DHPM处理后的样品表观黏度下降趋势更大,剪切稀化的效果更加明显。综上可知,DHPM处理可以有效地降低RKBP的表观黏度,增加固形物的沉降率,离心处理后有利于除去固形物,从而增加溶液稳定性[27]。

图1 DHPM处理前后RKBP表观黏度随剪切速率变化情况Fig. 1 Changes in apparent viscosity of RKBP with high shearing rate before and after DHPM treatment
2.3 DHPM处理对RKBP相对分子质量、特性黏度等指标的影响

图2 DHPM处理前后RKBP的HPSEC示差检测色谱图Fig. 2 HPSEC chromatogram with differential detection of RKBPbefore and after DHPM treatment
图2 为RKBP的示差检测器信号,其相对分子质量分布较宽,主要含有峰1和峰3这两个组分,此外还含有少量的峰2组分。经过DHPM处理后,峰1组分对应的洗脱时间逐渐后移,表明多糖的相对分子质量下降,随着处理压力增加,峰1组分相对分子质量下降更加明显,但是对峰2和峰3组分的相对分子质量影响相对较小。
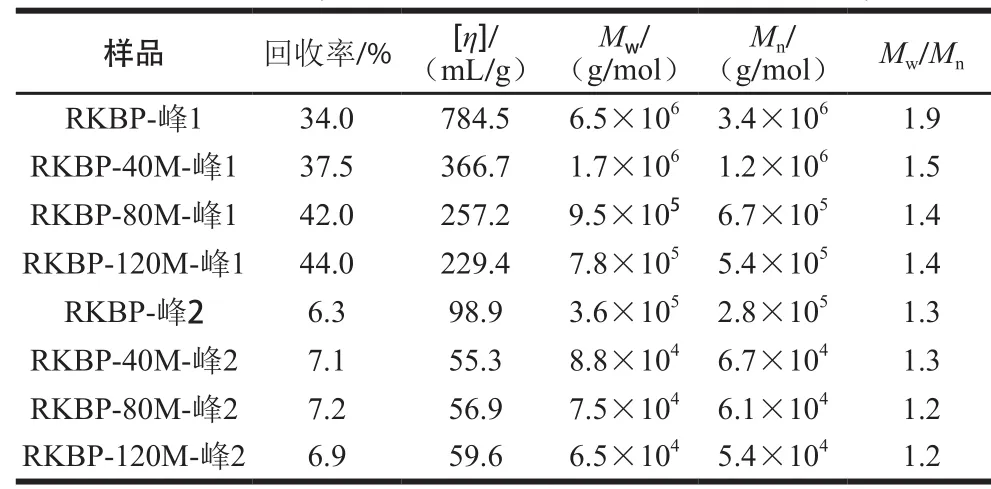
表2 HPSEC-MALLS测定DHPM处理前后RKBP的分子参数Table 2 Molecular parameters of RKBP before and after DHPM treatment estimated by high performance size exclusion chromatography-multiangle laser light scattering analysis
由于峰3组分相对分子质量较小,因此主要对峰1和峰2两个组分的相对分子质量等参数进行了分析。DHPM处理前后样品峰1的变化主要表现在两个方面:示差出峰信号变化和峰宽变化。峰1示差出峰信号明显向后推移,说明峰1相对分子质量显著下降,由表2可知,DHPM处理压力越大,DHPM的峰1相对分子质量越小,同时峰1的特性黏度也下降,这与样品的表观黏度下降现象相一致。峰2组分的相对分子质量等指标也有一定下降。综上表明,DHPM处理能降低RKBP的相对分子质量。
2.4 DHPM处理对RKBP单糖组成的影响
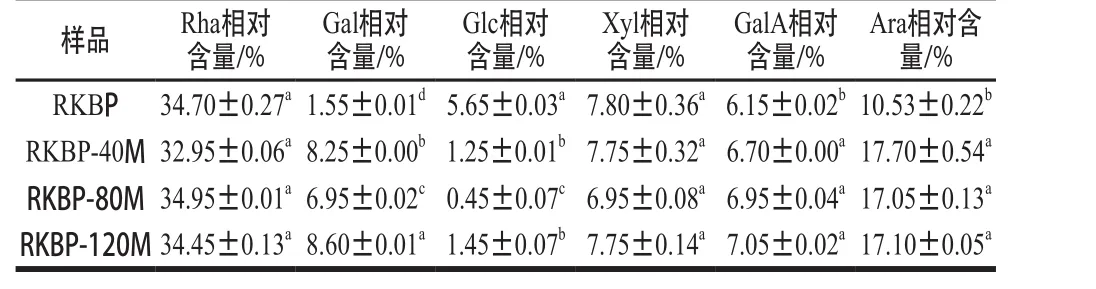
表3 DHPM处理前后RKBP的单糖组成及其相对含量变化Table 3 Monosaccharide composition of RKBP before and after DHPM treatment
由表3可知,RKBP主要含有Rha、Ara、Xyl、GalA和Gal,表明RKBP属于果胶类多糖[28]。原样的Gal相对含量与DHPM处理后的样品存在显著性差异,且不同压力处理的样品之间也差异显著,Gal相对含量由1.55%随处理压力增加依次上升至8.25%、6.95%、8.60%,变化幅度较大;Glc相对含量与DHPM处理后的样品也由5.65%显著下降至1.25%、0.45%、1.45%;此外,GalA、Ara的相对含量也均随DHPM压力的升高而显著增加,但不同压力处理的样品之间差异不显著。
结合文献分析造成单糖组成变化的原因,可能是由于:1)经DHPM处理后再离心可以除去少量沉淀物质,使得均质后的多糖纯度在一定程度上有所提升,导致一部分单糖含量有所提升;2)经DHPM处理后,多糖糖链上断裂的单糖(尤其是侧链和末端残基)在透析过程中流失,造成部分单糖测定结果下降[29]。此外,DHPM过程导致多糖大分子链断裂(相对分子质量降低),在相同水解条件下,经DHPM处理后得到的多糖水解效率更高,因此总糖含量也更高。
2.5 DHPM处理对RKBP傅里叶变换红外光谱的影响
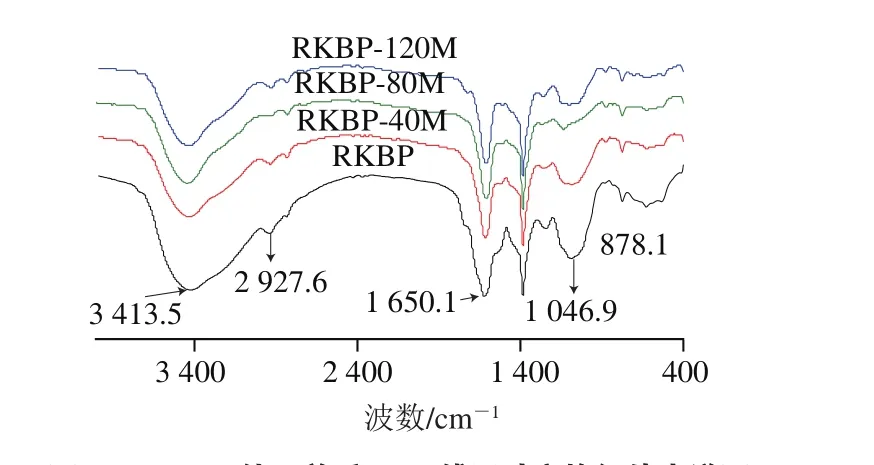
图3 DHPM处理前后RKBP傅里叶变换红外光谱图Fig. 3 Fourier transfer infrared spectra of RKBP before and after DHPM treatment
由图3可知,3 413.5 cm-1附近的吸收峰为O—H伸缩振动,2 927.6 cm-1附近的吸收峰为C—H伸缩振动,1 200~1 414 cm-1附近的吸收峰为C—H弯曲振动,这3 个峰是糖类特征吸收峰,由此推断RKBP是糖类化合物。1 650.1 cm-1附近的强吸收峰为羧基特征吸收峰,证明RKBP是酸性多糖,1 046.9 cm-1附近的吸收峰证明存在C—O—C[30]。DHPM处理前后多糖的傅里叶变换红外光谱差异不明显,说明DHPM对RKBP的官能团影响较小。
2.6 DHPM处理对RKBP固体形貌的影响
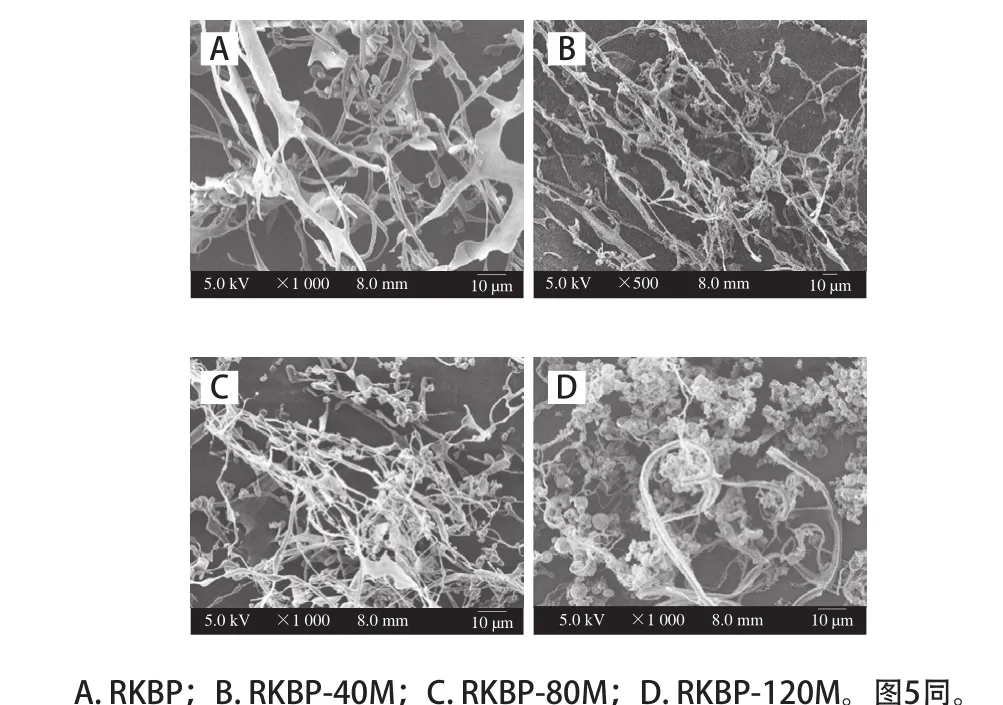
图4 DHPM处理前后RKBP的SEM图(1 000×)Fig. 4 Scanning electron microscopic images of RKBP before and after DHPM treatment (1 000 ×)
从图4可以看出,RKBP最显著的特征是表面形貌起伏不平,链结构边缘有球状物,无规则地卷曲排布,空间间隙较大。RKBP-40M的丝状结构比RKBP的丝状结构更细,高压下(80、120 MPa)处理得到的RKBP-80M和RKBP-120M,多糖链出现团聚现象,链边缘的球状结构数量增加,空间间隙变小,且RKBP-120M的团聚现象比RKBP更为严重。上述结果表明,DHPM处理对RKBP的固体形貌有一定影响。
2.7 DHPM处理对RKBP的1H NMR谱图特征的影响
由图5可知,虽然前期利用较多经典的多糖提取和分离纯化手段处理,但所得样品的结构仍比较复杂,在δ 0.96~2.73分布了较多非碳水化合物的信号峰,这些信号可能来自于氨基酸,这与理化性质分析中检测到的蛋白质结果相印证。在δ 3.75的一个非常强的信号峰代表羧基上的甲基,结合单糖组成分析证明GalA的存在[31]。在δ 2.06附近的一个较强的信号峰是GalA乙酰化的结果[32]。在δ 1.20、1.28的信号峰证明了Rha的存在[33],这与单糖组成的结果一致。对比高压微射流前后样品的异头氢区域(δ 4.5~5.5)信号峰,发现DHPM处理后RKBP的1H NMR谱峰型没有明显的变化。
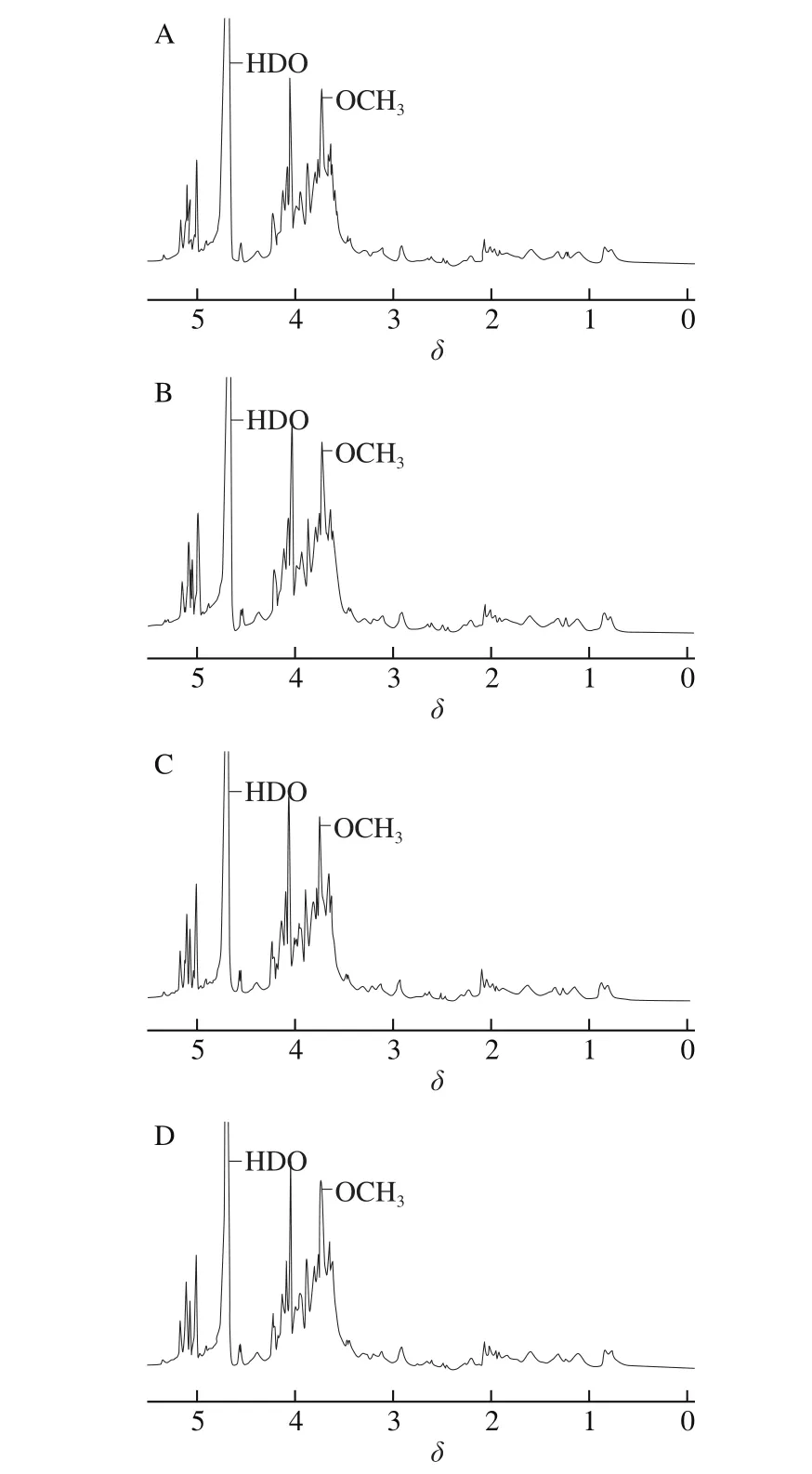
图5 DHPM前后RKBP的1H NMR谱图(293 K)Fig. 5 1H nuclear magnetic resonance spectra of RKBP before and after DHPM treatment (293 K)
2.8 DHPM处理对RKBP热稳定性的影响
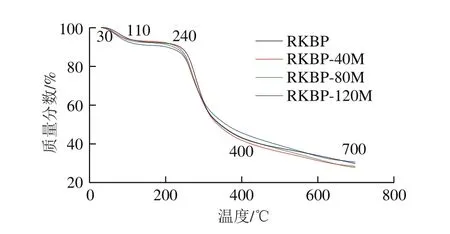
图6 DHPM处理前后RKBP的TG图Fig. 6 Thermogravimetric plots of RKBP before and after DHPM treatment
图6 是DHPM前后RKBP的TG曲线测定结果,对RKBP热降解而言,结合参考文献[34]分析,主要存在4 个阶段:第1阶段是失水阶段(30~110 ℃),该阶段主要是随温度升高,水分变为气态被保护气带走而造成的质量损失;第2阶段是热解准备阶段(110~240 ℃),该阶段质量几乎不变,主要发生多糖的解聚;第3阶段是热解质量损失阶段(240~400 ℃),在这个阶段多糖、淀粉、蛋白质等大分子物质发生软化和分解,大部分物质生成挥发性物质,导致质量大幅下降,部分物质炭化,质量损失约为50%;第4阶段为炭化阶段(400~700 ℃),该阶段主要是残留物的缓慢分解,质量损失速率较为平缓,质量损失约为13%,主要发生物质的炭化和聚合,最终生成焦炭被剩下,生成的气体被保护气带走。
经过DHPM处理后所得各种多糖的TG图与RKBP相似,表明DHPM处理对RKBP的热稳定性影响不明显。
3 结 论
以RKBP为研究对象,采用DHPM的不同压力对其进行加工处理,探究DHPM对RKBP基本结构特征、流变性质和固体形貌等指标的影响。RKBP经过DHPM处理后得率降低,总糖质量分数随压力的增加而升高,多糖质量分数有所提高,单糖组成出现差异;RKBP的表观黏度、相对分子质量(主要是影响高分子质量组分峰1)随处理压力的增大而减小;SEM观察结果说明随着压力升高,多糖固体形貌变化愈加明显。由傅里叶变换红外光谱结果可知,DHPM处理未对多糖官能团特征峰产生明显的影响;RKBP的TG分析结果显示均质前后样品无明显差异,说明化学成分没有明显变化。1H NMR谱图表明DHPM前后样品的总体峰型无明显区别。因此,结合DHPM技术将芸豆应用于饮料工业中可增加饮料稳定性且不破坏芸豆多糖的化学结构,可行性较高,具有一定的研究意义。

