海洋氨氧化古菌及其驱动的碳氮生物地球化学循环过程研究进展*
洪义国,何翔,吴佳鹏,刘晓晗,2
(1 广州大学大湾区环境研究院 珠江三角洲水质安全与保护教育部重点实验室, 广州 510006;2 广州大学环境科学与工程学院, 广州 510006)(2019年4月8日收稿; 2019年6月26日收修改稿)
氮是组成生命体的基本元素之一,同时氮循环也是自然界最基本的物质循环过程之一。早期地球上的氮循环由大气反应和缓慢的地质过程控制,在大约27亿年前,微生物代谢活动逐渐进化成为控制与调节地球氮循环的主要驱动力[1]。通过微生物的一系列作用,驱动氮在整个地球系统中循环,维持着整个生态系统中生命的延续和进化。通过长期的探索,科学家们初步建立了微生物氮循环途径,主要包括固氮过程、硝化过程、反硝化过程、氨同化过程以及氨化过程。近年来,由于分子微生物学技术的进步,预测和鉴定了许多参与氮循环过程的新微生物种类。新的微生物及其代谢方式的阐明,使得氮生物地球化学循环理论也在经历不断的修正和完善。细菌的厌氧氨氧化(anaerobic ammonia-oxidation, anammox)、古菌氨氧化(archaea ammonia-oxidation)、硝酸盐异化还原到铵(dissimilatory nitrate reduction to ammonium, DNRA)以及全程氨氧化(complete ammonia-oxidation, comammox)的发现,改变了人们对微生物氮循环过程的传统认知,构建了新的氮循环网络体系[2-5]。本文主要针对氨氧化古菌(ammonia-oxidizing archaea,AOA)在海洋环境中的分布、AOA的氨氧化代谢机制、自养固碳机制及其在海洋生物地球化学循环中的作用等方面的研究进展进行综述,以期对这个领域有更深刻更全面的认识。
1 海洋氨氧化过程概述
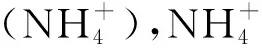
2 氨氧化古菌的发现
19世纪以前,人们把硝酸盐看作是空气中的氧和氨经土壤催化生成的,是化学作用的产物。直到1890年,Winogradsky[7]利用无机盐培养基成功分离纯化获得第一株具有氨氧化功能的细菌——欧洲亚硝化单胞菌(Nitrosomonaseuropaea),证实氨氧化过程是由氨氧化微生物催化完成的。在此后的一百多年里,AOB被认为是自然环境中唯一具有氨氧化功能的微生物,对于氨氧化过程的研究也都是围绕AOB开展的。Nitrosomonaseuropaea全基因组被测序之后,成为一种研究氨氧化微生物的生理生态、系统发育等方面的模式生物[8-10],而编码氨单加氧酶(ammonia mono-oxygenase, AMO)α亚基的amoA基因也从此作为分子标记物用于氨氧化细菌的分子生态学研究[11]。目前的研究结果表明,自然环境中发现的AOB均归属于β-和γ-变形菌纲(Proteobacteria)[12-17]。

3 氨氧化古菌的多样性及系统进化
基于16S rRNA同源性分析,DeLong[26]将从海水中获取的环境样品与可培养的古菌进行比对,并构建系统发育树,将海洋浮游古菌划分为4个分支:Marine Group I,属于泉古菌类群;Marine Group II,III,和IV,属于广古菌类群。进化关系如图1所示,其中Marine Group I被认为是海洋中分布最广、数量最多的浮游古菌类群,被命名为中温泉古菌(non-thermophilic Crenarchaeota)[27]。此后这类生活在中温环境的泉古菌在土壤、河口、沉积物、海湾等诸多生境中都被发现广泛存在。系统进化分析表明,氨氧化古菌也隶属于中温泉古菌。
但近来,随着更多新的古菌小亚基核糖体 RNA(SSU rRNA)和大亚基核糖体 RNA(LSU rRNA)序列的获得,研究者们对古菌的系统发育分析表明,中温泉古菌可能代表了一个新的独立的进化分支。Robertson等[28]利用从GenBank下载的712条古菌SSU rRNA基因序列构建的系统发育树,以及Brochier-Armanet等[29]收集的226 个古菌和细菌的 SSU rRNA和 LSU rRNA基因序列进行的同源性分析,都发现在古菌域中的中温泉古菌和嗜热泉古菌形成了2个不同的单系群。紧接着,Brochier-Armanet对包括真核生物、细菌、广古菌、嗜热泉古菌和中温泉古菌在内的53个具有全基因组的物种进行核糖体蛋白(r蛋白)的系统发育分析,并对Cenarchaeumsymbiosum进行比较基因组学分析,建议将中温泉古菌独立为古菌的一个门——奇古菌门(Thaumarchaeota)[29-30]。随后,这一新提出的古菌门迅速得到其他研究证据的支持和认可。目前,奇古菌作为古菌中的一个单独分支,包括属于氨氧化古菌的Group I.1a和I.1b、来自酸性土壤的Group I.1c、来自开放海域的ALOHA Group、来自热泉和热液口的pSL12 Group和HWCGIII (hot water Crenarchaeotic Group III)以及来自地下矿井的SAGMCG-1,它们的系统进化关系如图1所示。

图1 奇古菌和其他古菌的系统发育分析[32]Fig.1 Phylogeny of thaumarchaeota and other archaea[32]
依靠传统的微生物培养方法和现代的分子生物学手段,越来越多的氨氧化古菌被发现和鉴定(具体见附件表1)。针对目前这些已被分离或富集到的氨氧化古菌菌株,研究者们进行了基因组学和生理学等多方面研究,对这部分氨氧化古菌的基因组信息和生理学特性都有了一定的了解。但由于氨氧化古菌生长缓慢,代时长,目前来说仍有大部分的氨氧化古菌尚未被人们所认识和发现。Biller等[31]从GenBank中收集来自不同生境的8 296条AOA的amoA基因序列,当以90%的序列相似度作为界定新种的阈值时,得出自然环境中AOA的物种数为315个左右。这就意味着自然界中90%以上的AOA尚未被人类所认识。根据已知的氨氧化古菌16S rRNA和amoA基因的系统发育分析,目前已知的氨氧化古菌可分为4大簇:海洋中的Group I.1a、土壤中的Group I.1b、嗜热的ThAOA和嗜酸的 Group I.1a-associated 4个类群。2012年Pester等[32]对NCBI、IMG/M和Camera 3个数据库中收集的12 356条amoA基因序列进行系统发育分析,提出氨氧化古菌可分为5个大簇,利用每个簇中已被分离或富集的氨氧化古菌的名字对该簇命名,包括有:Nitrosopumiluscluster、Nitrososphaeracluster、Nitrosotaleacluster、Nitrosocalduscluster,以及在当时还未有已知序列的Nitrososphaerasister cluster。
4 AOA的氨氧化代谢途径及其在海洋中的生态分布
1992年,Fuhrman等[39]和DeLong[40]分别在不同海域水体中发现,古菌在海洋水体中大量存在,且分布广泛。此后的研究也表明海洋浮游古菌在海洋水体中占据着重要地位,尤其是在真光层以下的深层海水中数量更为丰富,在海洋中层及深层水体中,古菌占据海洋浮游微生物丰度的20%~40%[41-43]。而大部分的海洋浮游古菌都属于中温泉古菌(non-thermophilic Crenarchaeota),即现在的奇古菌门(Thaumarchaeota)。因此可以推断,相对于AOB,AOA在海洋水体中占据着优势地位。
Francis等[44]首先对海水和海洋底泥中AOA的多样性和分布的普遍性做了探索,利用AOA-amoA基因特异性的引物对海水透光层、次氧层、河口和近海底泥等多个地点样品中的AOA-amoA基因进行研究分析,发现在不同的海洋环境中存在不同的AOA群体,而且每个不同的取样点都存在与环境相适应的特异性的AOA,但也存在一部分AOA种类在海洋中具有普遍性的分布。荷兰皇家海洋研究所的Wuchter等[24]在针对北海及北大西洋的研究中,发现北海水体中AOA-amoA基因的丰度与海水中氨浓度的下降以及泉古菌的数量密切相关,而且古菌amoA的丰度比细菌的要高出1~2个数量级,对北大西洋水深1 000 m以上的水体中amoA基因丰度测定结果显示,AOA的丰度也比AOB高1~3个数量级,这表明AOA在海洋硝化作用中可能发挥着重要作用。而宏转录组的分析结果也表明,在不同的海洋环境中,AOA氨氧化代谢都非常活跃[45-47]。Martens-Habbena等[25]通过对比原位测定的海洋氨氧化半饱和常数与实验室测定NitrosopumilusmarinimusSCM1的氨氧化半饱和常数,发现二者在数值上相吻合,暗示AOA主导着海洋大部分的氨氧化反应。综合以上研究可以看出,在大洋及寡营养的开阔海域水体中AOA数量多、多样性高、分布广,是海洋环境中氨氧化作用的主导群体,在海洋氮循环过程中发挥着重要作用。
5 AOA自养固碳的分子机制及其在海洋生态系统中的功能

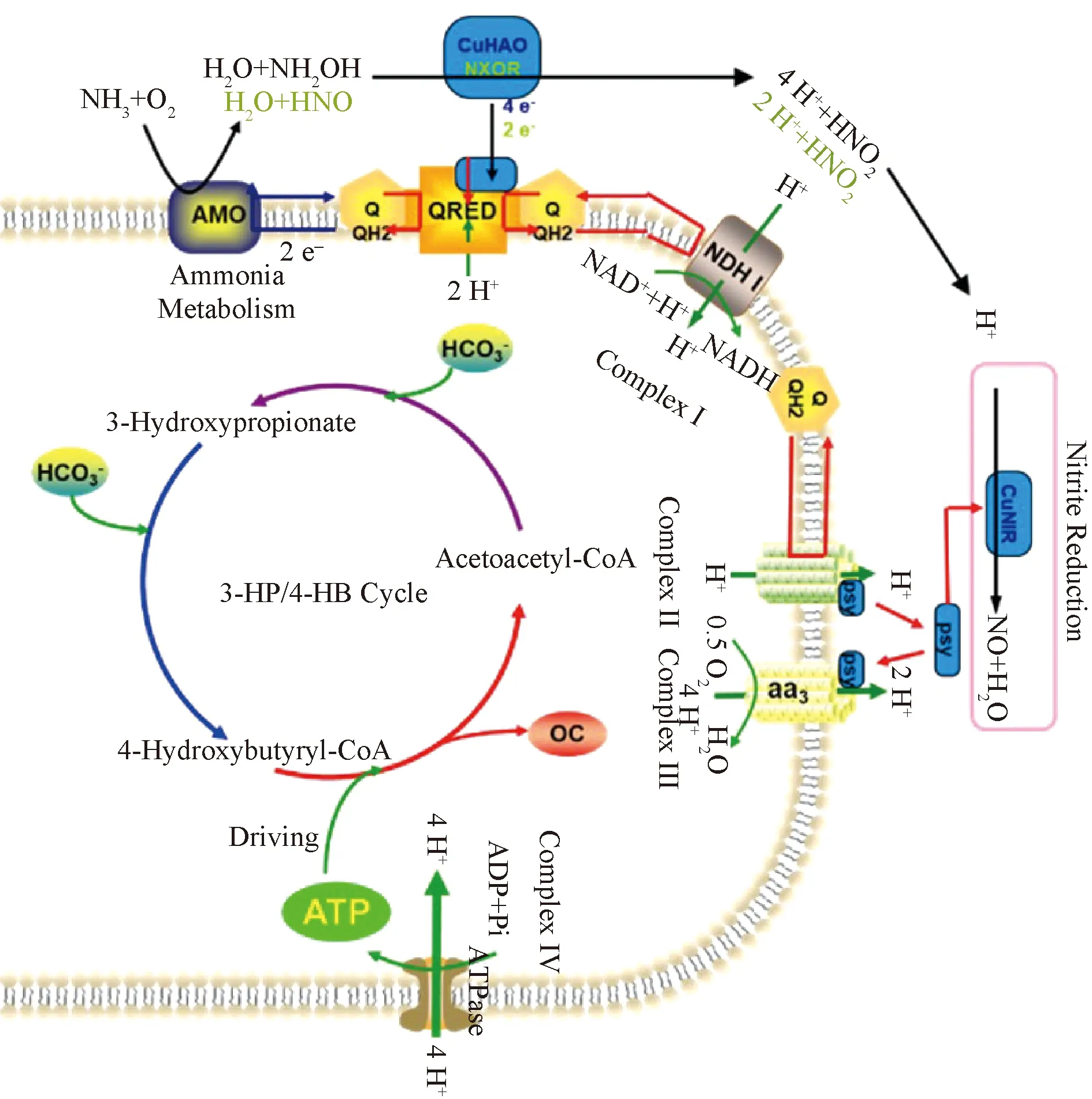
图2 氨氧化古菌的氨氧化途径驱动自养固碳[36, 50]Fig.2 Carbon fixing coupled with ammonia oxidation of ammonia oxidizing archaea[36, 50]

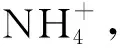
6 研究展望
近年来,分子生态学作为有力的工具促进了很多新的微生物生态学的认识。分子生态学的方法能够使我们从基因水平了解AOA的多样性及其参与的碳氮转化机制。纯培养AOA以及自然样品的氨氧化率的测定使我们知道不同的AOA有不同的最适生理条件,因此生存在不同的生境中(ecological niches)。多种生理类型的AOA在广泛不同的生态环境中是否都能以不同的菌群结构保证氨氧化活性?AOA的群体是以多大的时间尺度响应环境条件的改变?什么样的环境条件改变最可能会影响环境的AOA氨氧化率以及固碳速率?AOA自养固碳为深海生物圈提供多少能量?生物地球化学和分子生物学的综合方法将会为这些问题的解决提供思路。
- 中国科学院大学学报的其它文章
- 西北干旱半干旱区煤炭井工开采对土壤肥力质量的影响研究进展*
- 完全自旋极化电子器件TiCl3/RhCl3/TiCl3的量子输运性质的第一性原理研究*
- Determination of methylated arginines in serum by a dispersive solid-phase extraction coupled with capillary electrophoresis-laser induced fluorescence detection*
- 基于FD-RCF的高分辨率遥感影像耕地边缘检测*
- 基于面向对象技术的旅游用地遥感识别*
- 基于净空技术的ISM频段可靠无线通信系统*

