伊利石/纳米TiO2 光催化剂的制备及其降解染料综合实验设计
历新宇,任秀丽,孟 万a,,c,姜男哲a,,c
(延边大学a.理学院;b.工学院;c.伊利石黏土矿物应用研究所,吉林延吉133002)
0 引 言
环境污染治理一直是各国学者密切关注的焦点,能否解决因工业生产而导致的环境污染问题已经成为人类可持续发展的前提条件[1]。鉴于传统污染处理技术成本高、处理周期长、效果差。近年来,以绿色环保的光催化降解技术取代传统污染处理技术成为环境领域研究的热点之一。随着研究的持续深入,现已有ZnO、WO3、ZnS 和Fe2O3等光催化材料[2-4]。
与其他光催化材料相比,TiO2因有着较宽的禁带宽度、无毒害、物化性质稳定等优点在光催化降解领域备受关注[5]。然而,单独使用TiO2作为光催化剂也存在着催化剂易流失、回收效率差等问题。因此,TiO2催化剂的有效固定对其长时间循环使用的能力具有极其重要的意义[6]。大量的研究表明,负载型催化剂可以提高可见光的吸收,增大催化剂的比表面积,从而使光催化效率得以提升[7]。目前,TiO2催化剂常用的复合载体主要集中在碳纳米管、玻璃类(如空心玻璃)、玻璃纤维、沸石等材料中[8-9],而有关TiO2与天然矿物材料直接复合制备高性能光催化剂的报道相对较少。
伊利石是一种富钾的2∶1型层状硅酸盐云母类矿物,其化学式为KAl2[(SiAl)4O10](OH)2·nH2O[10]。作为地表储量最丰富的4 种黏土矿物之一,伊利石廉价易得且有较强的吸附能力和良好的热稳定性,是一种理想的吸附材料和光催化载体材料[11]。为了让学生们了解与掌握负载型光催化剂的制备和光催化降解技术,熟悉X-射线衍射、X 射线荧光衍射、扫描电镜等表征仪器的操作,设计了伊利石/纳米TiO2光催化剂制备及其光催化降解性能研究的综合实验。
1 实验设计
1.1 实验原料及试剂
伊利石取自吉林省安图县,实验所用试剂均为分析纯的TiO2(P25,天津市科密欧化学试剂有限公司),亚甲基蓝(Methylene Blue,天津市光复精细化工研究所),盐酸(HCl,天津市科密欧化学试剂有限公司),实验用水为去离子水。
1.2 实验方法
1.2.1 伊利石/纳米TiO2光催化剂的制备
伊利石矿石经破碎、球磨、烘干后筛取粒径小于10 μm的精粉用于实验。取不同质量的TiO2与将1 g伊利石粉末溶于20 mL 稀盐酸中(pH =4),待其混合均匀后,转移至100 mL聚四氟乙烯的反应釜中,放入烘箱,在一定温度下进行水热反应。实验结束后,取出釜内反应产物,用去离子水抽滤至中性,烘干,即可得到伊利石/纳米TiO2光催化剂。
1.2.2 伊利石/纳米TiO2 光催化剂的表征
分别以荷兰帕纳科公司的X-射线衍射仪(X-Ray Diffract meter,XRD)、X-荧光分析仪(X-Ray Fluorescence,XRF)、日本日立公司SU8010 型扫描电镜(SEM)、丹东百特仪器公司BT-1500 离心沉降式粒度分布仪,对样品进行物相、组分,形貌分析、粒径分布进行分析。采用上海岩征实验仪器有限公司的光化学反应器及上海精密仪器仪表公司的紫外-可见分光光度计测定样品的光催化性能。
1.2.3 伊利石/纳米TiO2光催化剂降解效果评价
采用浓度为20 mg/L亚甲基蓝溶液(MB)作为目标降解物,用于光催化降解实验,采用上海精密仪器仪表公司的紫外-可见分光光度计在最大吸收波长(460nm)下检测降解物溶液浓度的变化,以下式计算光催化降解率:

式中:D为光催化降解率;A0为溶液初始吸光度;A为催化反应后溶液的吸光度。
2 结果与讨论
2.1 伊利石原料特征分析
伊利石精粉粒径分布如图1 所示,粒径主要分布在0.5 ~4.0 μm 范围内,粒径中位值D50=2.2 μm,由此可知原料的尺寸分布较为理想,颗粒较为均匀。原料的组分由XRF 测定(以氧化物计),含量:52.27%SiO2,35.16%Al2O3,8.03%K2O,3.12%Fe2O3。

图1 伊利石的粒径分析
2.2 伊利石/纳米TiO2 光催化剂制备条件对降解率的影响
2.2.1 水热温度对降解率的影响
图2 所示为在溶液pH 4,水热反应4 h 条件下制备的伊利石/纳米TiO2光催化剂在光照30 min时降解MB趋势图。由图可见,随着温度的升高,催化剂的催化能力呈现先上升而后下降的趋势,当反应温度130~150 ℃时,降解率由72.2 %上升至92.5 %;当水热温度进一步上升至170 ℃时,降解率由92.5 %下降至65.13 %。造成这一现象的主要原因是温度上升使伊利石颗粒在溶液中发生团聚,不利于TiO2的负载,由此导致降解率先升高后降低这一结果的发生。由此可以确定,反应温度为150 ℃为最佳反应温度。
2.2.2 水热时间对降解率的影响

图2 不同水热反应温度下合成样品的在光照30 min时的光催化降解图
图3 是在溶液pH 4,反应温度150 ℃时,通过调控水热时长制备的伊利石/TiO2光催化剂在光照30 min时降解MB趋势图。由图3可见,随着水热反应时间的增加,催化剂的活性呈明显的上升趋势,当水热反应时间由3 h增加至4 h时,底物降解率由37.7 %上升至92.5 %,进一步增加反应时间,降解效果几乎不变化。表明在反应温度和载体量不变的条件下,TiO2负载量随着反应时间的延长而增加;当负载量到达阈值时,进一步延长反应时间无法继续增加负载量。因此选取反应时长4 h为最佳反应时间。
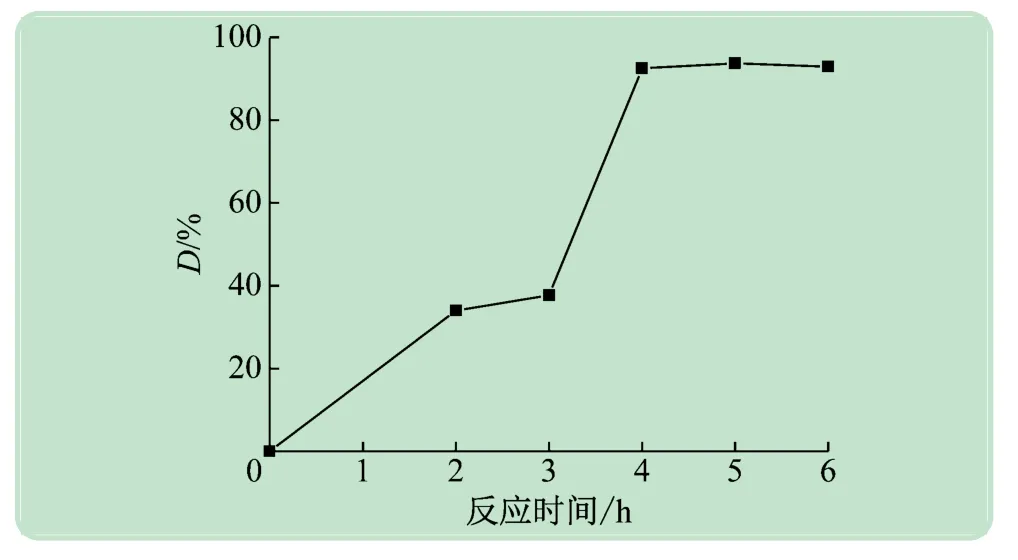
图3 不同水热反应时间下合成样品在光照30 min时对MB的光催化降解图
2.2.3 纳米TiO2/伊利石负载比例对降解率的影响
由图4 可知,在仅使用伊利石进行降解实验时,底物也会发生一定程度的降解,发生这一现象的主要原因是伊利石本身就具有较强的吸附能力[13]。当使用负载纳米TiO2比例不同的产物进行光降解实验时,可以明显地看出,随着TiO2负载比例的不断增加,光降解效果也越好,造成这一现象的原因可能是由于光催化反应主要在催化剂的表面进行,在催化剂使用量不变的条件下,适当的增加TiO2用量有助于在单位时间内产生更多具有强氧化性空穴和强还原性的电子,从而提高参与反应的活性位点密度,进而提高产物的光催化活性[14]。因此根据实验结果,选取TiO2/伊利石负载比例为50%最佳负载量。

图4 TiO2/伊利石负载比例对MB光催化降解曲线图
2.3 伊利石/纳米TiO2 催化剂的表征
图5(a)、(b)分别为伊利石及最佳条件下(反应温度150℃,反应时间4 h,溶液pH 4,TiO2/伊利石负载比例为50%)制备的产物SEM 图。由图可见,反应前后伊利石的片状形貌发生碎裂,即由有规则的层状有序堆叠状转变为无序堆叠。与此同时,可以清晰地看到在原料表面负载了一层TiO2颗粒(见图5(b)),经XRF表征,此时产物中纳米TiO2含量约占15.4%。图5(c)为原料及最佳条件下制备的产物XRD 图,谱中特征峰经归峰后可以确认为伊利石(JCPDS.No.02-0056),同时含有少量的石英峰(2θ = 20.8°、26.6°),由于谱图中特征峰细尖,因此可以确认原料为结晶度较高的伊利石。产物衍射峰角度虽然没有发生明显变化,但衍射峰强度大大减弱,同时可以清楚地观察到TiO2的特征峰,由此说明原料经水热反应后结晶度降低,伊利石也与TiO2发生了部分结合,这也与SEM图中观察到的情况相符。

图5 原料及最佳条件下制备的产物SEM及XRD图
2.4 伊利石/纳米TiO2 光催化降解机理
根据实验现象,可以大体总结出伊利石/纳米TiO2催化剂光催化降解亚甲基蓝的机理。根据实验结果来看,光催化降解MB的过程主要分为两部分:①伊利石在溶液中具有一定的吸附能力,进而导致了MB的降解,这也与图4 中的实验结果相符合。② 伊利石/纳米TiO2催化剂在受到光照射后,负载的Ti 原子中的价带电子发生跃迁,导致价带上留下空穴[15]。一部分的电子空穴由于自身的氧化性与负载在载体上的MB发生反应;另一部分的电子空穴会通过扩散的方式迁移到粒子表面,被OH-,H2O 以及O2捕获,生成具有强氧化性的HO·,最终使MB中的发色基团被破坏,最终实现了伊利石/纳米TiO2光催化降解亚甲基蓝中这一过程。
3 实验运行模式及内容拓展
本综合实验为开放式实验运行模式,学生在电子文献资料库(如中国知网等)对实验内容进行预习,然后以小组为团队,讨论实验方案,与老师沟通确认后,进行实验,并最终在班级内就实验内容进行团队间互相交流式汇报。这不仅可以打破学生“被动学习”的弊端,增进师生间距离,也能增强学生对实验的主动性和积极性。除上述实验内容外,学生可在现有实验的基础上,运用已掌握的实验技能对现有实验进行如下拓展:
(1)对伊利石/纳米TiO2光催化剂的制备条件进行细化,如进一步细化实验温度,调节反应体系pH值等条件来增加伊利石表面的纳米TiO2光负载量,以此提高光催化降解效果。
(2)在伊利石/纳米TiO2光催化剂的制备过程中掺杂N、F、V等元素,以期提升其光催化降解效果。
(3)利用本学科所授的材料结构表征及应用、热力学及动力学相关知识,对伊利石/纳米TiO2光催化剂的结构进行研究分析、对该材料在催化降解MB 过程中的化学动力学,热力学进行研究。
在拓展实验内容的过程中,不仅可以提高学生查阅文献的能力,也加深了学生们对本专业课程的认识,培养了学生们的科研探究能力,为今后从事科研工作打下了良好的素质基础。
4 结 语
本综合实验设计在考察伊利石/纳米TiO2光催化剂的制备及其光催化降解染料能力的同时,引入了XRD、XRF、SEM等实验表征,是集材料学、环境科学及仪器分析知识为一体的研究性综合实验,该综合实验依托本校实验教学资源,融合了科技前沿知识。在教学环节以学生为中心,这不仅有利于提高高校实验教学效果,也对学生的创新思维、科研创新能力以及综合实践能力的提高有着十分积极的影响。

