基于iTRAQ 技术筛选烟叶响应衰老差异表达蛋白
何聪莲 ,郑志云,陈颐,赵高坤,何承刚,胡彬彬,姜永雷,邹聪明
1 云南省烟草农业科学研究院,云南省昆明市五华区圆通街33号 650031;2 云南农业大学,云南省昆明市盘龙区沣源路452号 650201;3 云南省烟草公司玉溪市公司,云南省玉溪市红塔区凤凰路120-1号 653100
烟草(Nicotiana tobacum L.)是重要的经济作物。蛋白质是植物生理功能的执行者和生命活动的直接体现者[1]。在烟叶成熟过程中,蛋白质含量不断发生变化,烟叶成熟度不同,蛋白含量差异较大[2]。随着蛋白质含量的变化,其调控的能量代谢和物质转化也随之发生改变[3]。而烟叶品质与烟叶体内物质代谢密不可分,因此,深度探索烟叶衰老过程中物质代谢过程是提高卷烟品质的关键[4]。打顶抹杈改变了烟草植株内的物质运输和积累的同时,也改变了烟叶的正常衰老模式[5],对烟叶的成熟度具有重要影响,因此,研究烟叶衰老过程蛋白质变化,可在蛋白质组学层面为烟叶衰老机理研究提供理论依据。随着蛋白质组学的广泛应用,已有大量关于拟南芥、水稻、油菜、棉花等作物的抗胁迫及衰老过程中蛋白质组学研究。唐秀英等[6]采用iTRAQ 技术研究乡野生稻根系响应低温胁迫蛋白质表达情况及功能,共鉴定到146 个的差异表达蛋白,且这些差异蛋白质参与信号传导和逆境胁迫等代谢过程。侯晓梦等[7]通过比较棉花化学打顶和人工打顶蛋白质组学研究,共检测到69 个差异表达蛋白,其中下调蛋白参与碳水化合物和能量代谢等过程,而上调蛋白参与赤霉素(GA)调节,增强GA效应。目前,烟草蛋白质组学研究主要集中于烟草抗胁迫、抗病虫害、不同肥力梯度下以及品种间、种植区域间烟叶蛋白质组学研究[8],而关于烟叶衰老过程中蛋白质组学研究甚少。本研究以烟草品种K326 为材料,结合iTRAQ 技术与PRM 验证技术,对三个成熟时期的烟叶进行蛋白质组学研究,为揭示烟叶衰老机理奠定理论基础。
1 材料与方法
1.1 供试材料
本研究所用烤烟品种为K326,由玉溪中烟种子有限责任公司提供。于2018 年4 月至9 月种植于云南省玉溪市红塔区研和试验基地(102°29’58″E,24°14’21″ N,海拔1635 m),采用随机取样法,选取未熟-IM(移栽后85 天)、适熟-WM(移栽后92 天)和过熟-OM(移栽后97 天)3 个时期中部叶片作为分析材料,3 个时期样品各2 次重复共6 份样品。
1.2 酶活性测定
在Giannopolitis等[9]所描述的方法基础上略作修改,进行酶提取。选取不同时期中部新鲜叶片1 g,放在3 mL的0.05 mol·L-1磷酸钠缓冲液中研磨成匀浆,磷酸钠缓冲液包括1 mL MEDTA和2%(w/v)PVP,pH值为7.8。匀浆在4℃下13000 g离心20 min,利用上清液测定酶活性,所有步骤均在4℃下进行。超氧化物歧化酶(SOD)采用硝基四氮唑蓝还原法测定[10]。过氧化氢酶(CAT)活性采用紫外吸收法进行测定[11]。过氧化物酶(POD)活性采用愈创木酚法测定。抗坏血酸过氧化物酶(APX)活性采用紫外吸收法进行测定[11]。
1.3 蛋白质组学分析
参照Xie 等[12]的方法分别对未熟、适熟和过熟烟叶进行全蛋白质提取。对提取后的蛋白质样品进行还原烷基化处理,用考马斯亮蓝法进行蛋白浓度测定[13]。按1 ∶50 的质量比例(胰酶:蛋白)加入胰蛋白酶,37℃酶解过夜,酶解后的肽段用C18 柱脱盐,真空冷冻干燥脱盐后的肽段。根据iTRAQ-8标试剂盒(AB SCIEX,美国)说明书进行标记,IM-1,115;IM-2,116;WM-1,117;WM-2,118;OM-1,119;OM-2,121。将标记后的样品混合,应用强阳离子交换色谱(SCX)对混合后的肽段进行预分离,然后再进行液相分离和色谱分析。
1.4 差异蛋白的选择
使用与AB Sciex 5600 plus 配套的搜索引擎—Proteinpilot TM V4.5。对于proteinpilot 的鉴定结果,进行进一步过滤,对于鉴定到的蛋白,认为unused score ≥1.3(即可信度水平在95%以上),每个蛋白至少包含一个不同肽段的蛋白为可信蛋白;对于鉴定的肽段和蛋白质定量,我们以conf.≥95 过滤,即可信度在95%以上认为可信肽段用于蛋白质定量。通过两两对比获取显著差异蛋白,根据BH 校正法,对原数据进行P-value ≤0.05 校正,将差异倍数≥1.2 或者≤0.83 倍时视为表达差异蛋白[14]。
1.5 生物信息学分析
1.6 PRM 验证
根据iTRAQ 结果,采用LC-MS/MS 液质联用系统对烟草样品中12 个目标蛋白进行相对定量比较。采用基于质谱的平行反应监测技术(parallel reaction monitoring, PRM)对相关蛋白进行靶向定量分析,通过非连续变形分析(discontinuous deformation analysis, DDA)检测后,将鉴定到的目标蛋白的肽段加入质谱采集方法的输入列表(inclusion list)中,使质谱针对这些特定肽段进行数据采集,通过抽提碎片离子信息进行靶向相对定量分析。
1.7 数据统计
所有数据均采用EXCEL 2016、SPSS 22.0 和Origin 8.0 分析软件进行统计分析和作图。
2 结果与分析
2.1 4 种抗氧化酶酶活性变化
在植物生长过程中,抗氧化酶维持着植物体内活性氧(ROS)的动态平衡[15]。由图可知,随着烟叶成熟度的增加, 4 种抗氧化酶活性均呈先增加后下降的趋势,表现为适熟>过熟>未熟。
2.2 蛋白质的iTRAQ 鉴定分析
图2 为蛋白质组学蛋白质定量结果,二级图谱总数为435604,匹配到的图谱数量为158095,鉴定到的肽段的数量为23346,鉴定到特有肽段序列的数量为3292,鉴定到的蛋白质数量为4747。
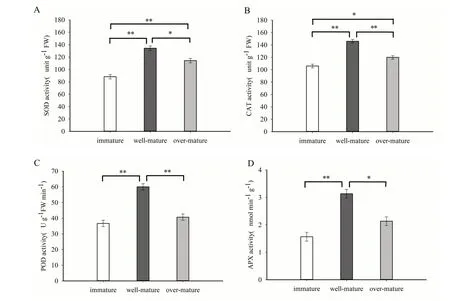
图1 烟叶不同时期抗氧化酶活性Fig. 1 Antioxidant enzyme activities of tobacco leaves at different stages
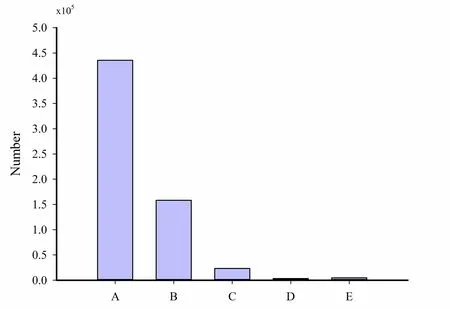
图2 iTRAQ 鉴定的蛋白信息Fig. 2 Protein information identified by iTRAQ
2.3 三个对比组间蛋白质定量分析
在全蛋白质基础上,将生物学重复得到的蛋白质数据合并,将其共同表达的蛋白质用于差异蛋白筛选。其中,在OM vs IM 对比组中,共鉴定出 321 种共同差异表达蛋白,其中上调122 种(P ≤0.05,fold change >1.2), 下 调199 种(P ≤0.05,fold change <0.83)(图3A)。在OM vs WM 中,共鉴定到差异表达蛋白种类为319,124 种蛋白表达上调,195 中蛋白表达下调(图3B)。在WM vs IM 中,存在223 种差异表达蛋白,125 种蛋白质表达上调,98中蛋白质表达下调(图3C)。
2.4 差异蛋白质GO 功能注释
针对不同组别差异蛋白质进行GO功能注释分析,分别从生物过程、细胞组成和分子功能进行注释。图4A 表示过熟烟叶与未熟烟叶中差异蛋白GO 注释结果,OM vs IM 差异蛋白参与了23 个生物过程、9 个细胞组成和9 个分子功能。在生物过程分类中,代谢过程、细胞过程、应激反应等过程占据较大的比例。此外,上调蛋白质参与节律过程(rhythmic process)和病毒繁殖(viral reproduction),下调蛋白质参与生长发育(growth)、碳固定(carbon utilization)和色素沉着(pigmentation)等过程;在细胞组成分类中,大部分差异蛋白质位于细胞、细胞组分、细胞器中,上调蛋白质参与构成细胞外区部分(extracellular region part)细胞组分;在分子功能分类中,催化活性和连接活性所占比例较高,下调蛋白质存在电子载体活性(electron carrier activity)、分子转换器活动(molecular transducer activity)和核酸结合转录因子活性(nucleic acid binding transcription factor activity)3 种功能。
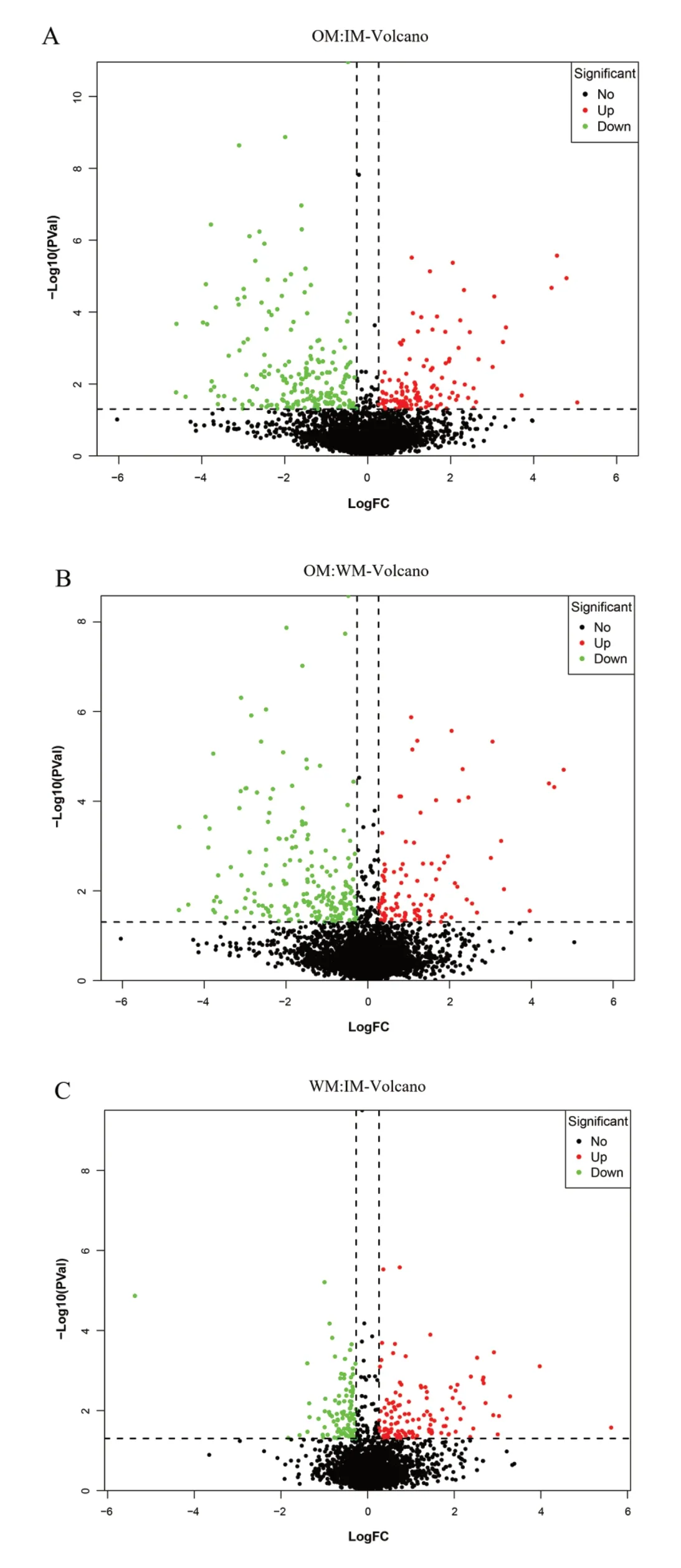
图3 火山图表示不同时期样品间蛋白质丰度变化Fig. 3 Volcanic chart of protein abundance change of samples at different stages
图4B 是过熟烟叶与适熟烟叶差异蛋白质GO 功能注释结果,OM vs WM 差异蛋白质参与了24 个生物过程、11 个细胞组成和9 个分子功能。在生物过程中,差异蛋白质在代谢过程、细胞过程和应激反应等过程所占比例较高,上调蛋白质参与氮利用率(nitrogen utilization)和节律过程(rhythmic process),下调蛋白参与色素沉着(pigmentation)和碳固定(carbon utilization)两种生物过程;在细胞组成中,大部分差异蛋白质位于细胞、细胞组分、细胞器中;在分子功能中,催化活性所占比例较大,下调蛋白具有电子载体活动(electron carrier activity)、分子传导活动(molecular transducer activity)和核酸结合转录因子活性(nucleic acid binding transcription factor activity)3 种分子功能。
图4C 为适熟烟叶与未熟烟叶差异蛋白质GO 功能注释结果,WM vs IM 差异蛋白参与了20 个生物过程、11 个细胞组成和9 个分子功能。在生物过程中,差异蛋白质在代谢过程和细胞过程等过程所占比例较大;在细胞组成分类中,大部分差异蛋白质位于细胞、细胞组分、细胞器中;在分子功能分类中,催化活性和连接活性所占比例较大,上调蛋白存在酶调节剂活性功能(enzyme regulator activity),下调蛋白具有分子转换器活性(molecular transducer activity)和核酸结合转录因子活性(nucleic acid binding transcription factor activity)两种分子功能。
1.请家长来学校了解教学情况和学生的学习情况。针对不同层次的学生使用不同的方式请家长参观学校,对成绩良好但思想不太优秀的学生说:“你的学习成绩是优秀的,老师想让你更优秀,老师需要和你的父母讨论一些其他方面的问题。”对有一技之长的后进生说:“你擅长体育(音乐、绘画等),如果你深入学习,然后去上一个更高层次的学校,你将有一个强有力的立足于社会的技能。”简单的教育方式蕴涵着一个朴素的教育理念——相信学生,教育学生的全部秘密在于相信学生和解放学生。相信学生、解放学生,首先要赏识学生。
2.5 差异蛋白质KEGG 富集分析
通过KEGG pathway 显著性富集发现,差异蛋白质显著富集于代谢途径(Metabolic pathways)、不同环境中的微生物代谢(Microbial metabolism in diverse environments)、光合作用(Photosynthesis)等代谢途径。在OM vs IM 中,上调蛋白质显著富集于络氨酸代谢(Tyrosine metabolism)、异喹啉生物碱的生物合成(Isoquinoline alkaloid biosynthesis)等代谢途径。下调蛋白质显著富集于光合作用(Photosynthesis)、代谢途径(Metabolic pathways)、光合生物中的固碳作用(Carbon fixation in photosynthetic organisms)等代谢途径(图5A)。
在OM vs WM 中,上调蛋白质显著富集于络氨酸代谢(Tyrosine metabolism)、异喹啉生物碱的生物合成(Isoquinoline alkaloid biosynthesis)等代谢途径中。下调蛋白质显著富集于光合作用(Photosynthesis)、代谢途径(Metabolic pathways)等代谢途径(图5B)。
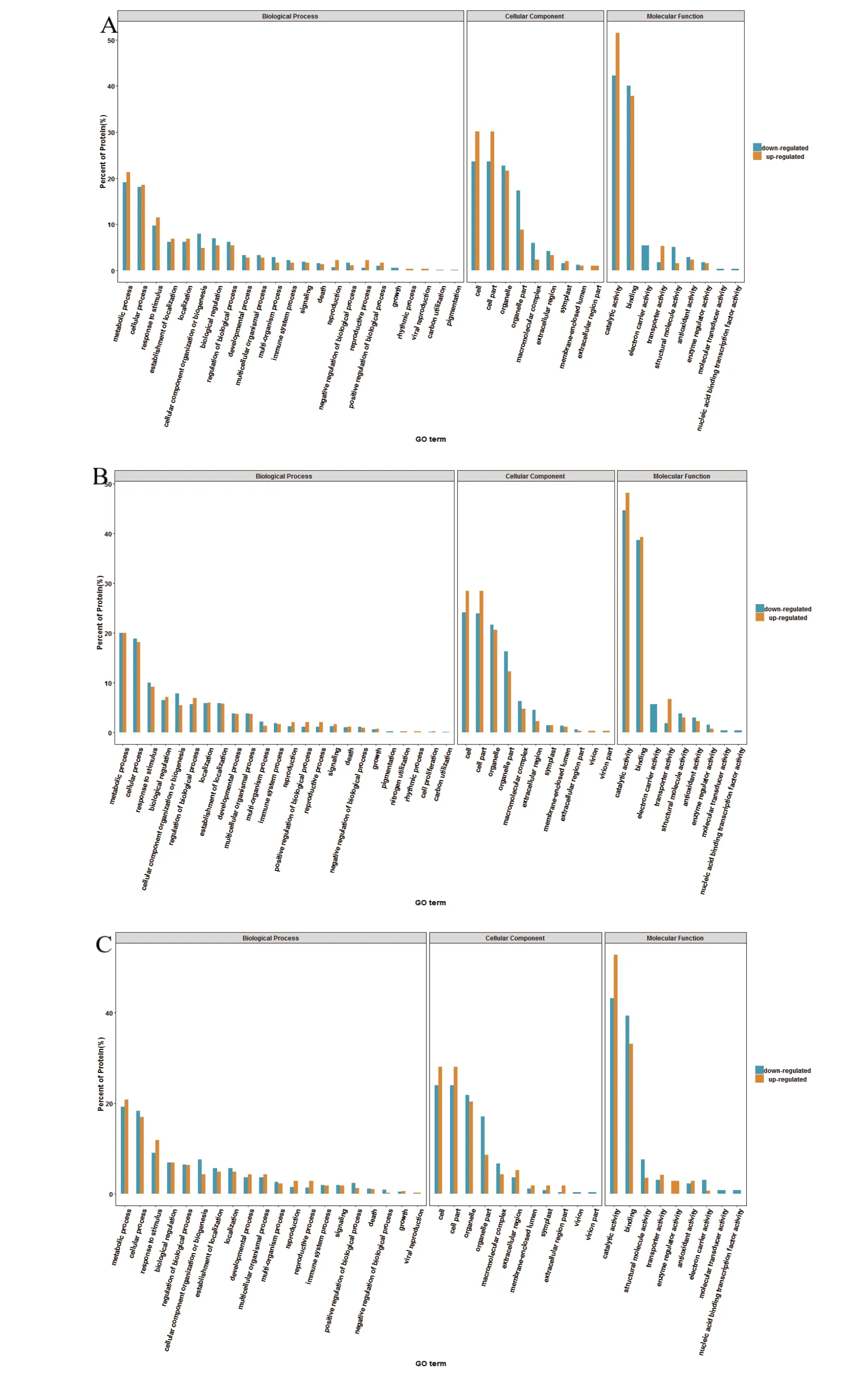
图4 差异蛋白质GO 注释结果Fig. 4 GO annotation results of differentially expressed protein
在WM vs IM 中,上调蛋白质显著富集于次生代谢产物的生物合成(Biosynthesis of secondary metabolites)、异喹啉生物碱的生物合成(Isoquinoline alkaloid biosynthesis) 等 代 谢 途 径。 下 调 蛋 白质参与光合生物中的碳固定(Carbon fixation in photosynthetic organisms)、光合作用(Photosynthesis)等代谢途径(图5C)。
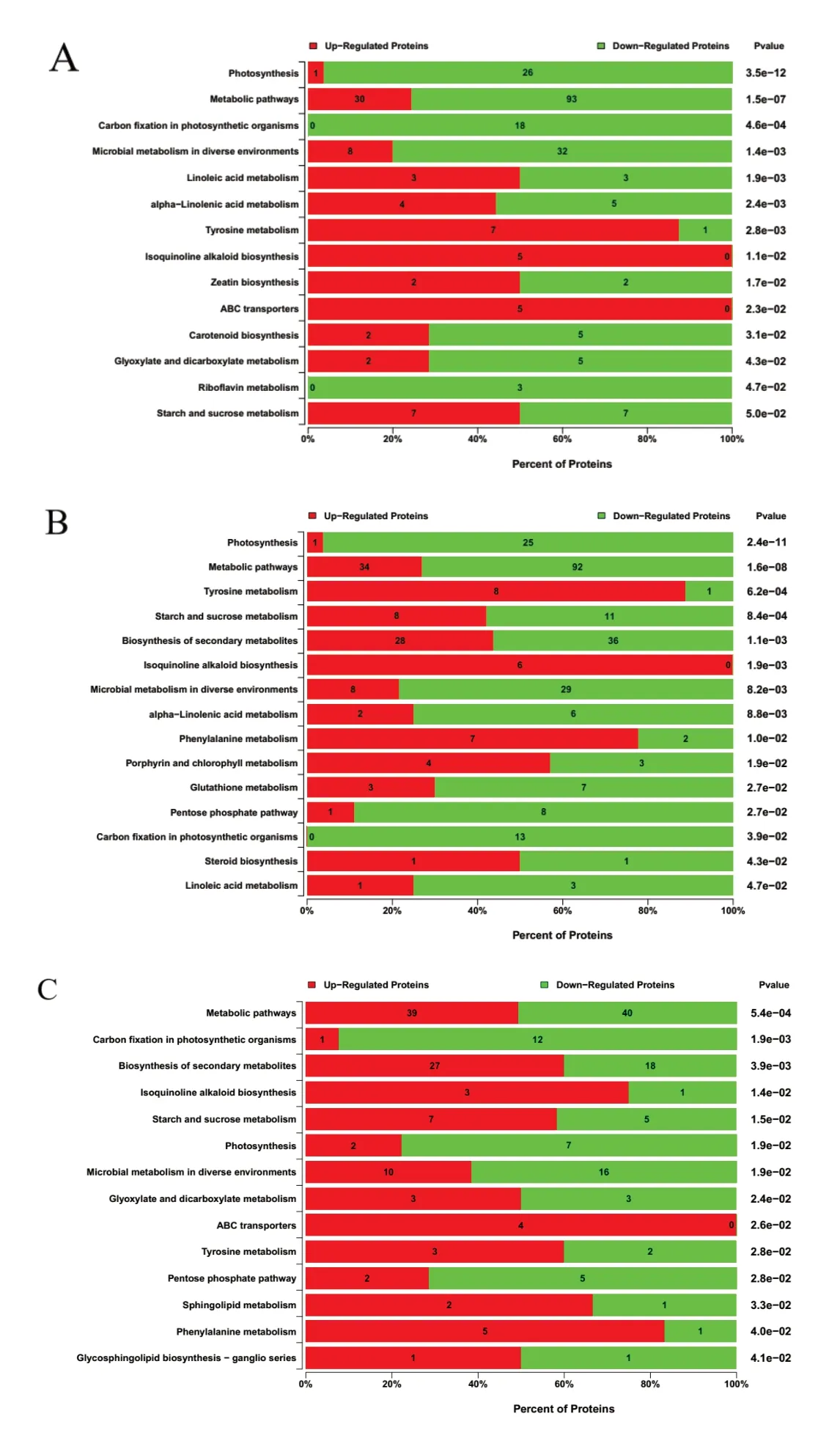
图5 差异蛋白通路富集分析显著性统计图Fig. 5 Statistical graph of significance of enrichment analysis of differentially expressed protein pathway
2.6 三组间共同差异蛋白
比较三个对比组OM vs IM、OM vs WM 与WM vs IM 的差异表达蛋白,发现86 个共同差异表达蛋白(图6)。对比3 个成熟时期(IM、WM、OM)86 个共同差异蛋白的表达丰度值(Z-score 处理)。在热图中,红色部分代表上调,蓝色部分代表下调。其中有17 个蛋白质包括A0A1S4DCM1、A0A1S4C433、A0A1S3ZQP6 等随着烟叶的衰老,其表达呈增加趋势,有29 个蛋白质的表达(包括Q1WL43、A0A1S4AKK6、A0A140G1P2 等)随着烟叶的衰老呈下降趋势(图7)。此类蛋白质可能是烟叶衰老潜在靶标蛋白。

图 6 3 组间共同差异表达蛋白Fig. 6 Common differentially expressed proteins between groups
2.7 PRM 验证
在本研究中,根据iTRAQ 实验结果,采用了PRM 靶向策略,对12 个目标蛋白进行分析,整体结果显示较好。在比较OM vs IM 的差异蛋白质验证中,有6 个蛋白质表达上调,6 个蛋白质表达下调,和iTRAQ 定量结果比较,有10 个蛋白质表现为表达量变化水平一致,2 个蛋白质表现为相反(图8A)。在比较组OM vs WM 的差异蛋白质验证中,7 个差异蛋白质表达上调,5 个差异蛋白质表达下调,与iTRAQ 定量结果相比,有9 个差异蛋白质表现为表达量变化水平一致,3 个蛋白质表现为相反(图8B)。在比较组WM vs IM的差异蛋白验证中,有6个蛋白质表达上调,6 个蛋白质表达下调,与iTRAQ 定量结果进行对比时,发现10 个蛋白质表现为表达量变化水平一致,2个蛋白质表现相反(图8C)。验证结果表明,有6 个蛋白质在3 组间均表现为与iTRAQ 定量结果一致的趋势, 包 括Q1WL43、A0A1S4DCM1、A0A1S4C433、A0A1S4AKK6、A0A1S3ZQP6、A0A140G1P2。
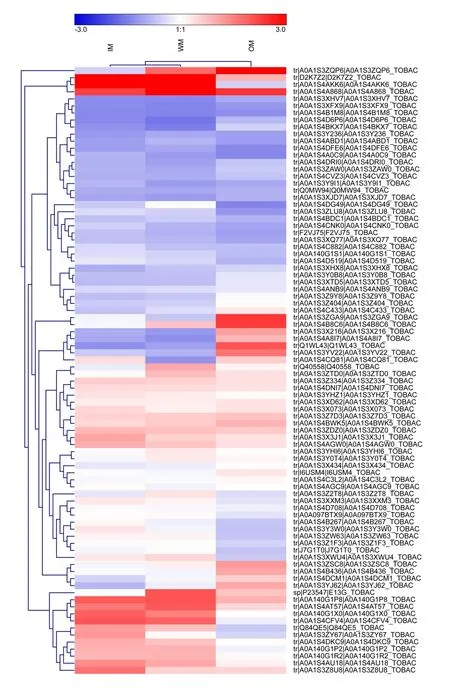
图7 3 个成熟时期中86 个差异蛋白的热图Fig. 7 Heat maps of the 86 differentially expressed proteins at three stages
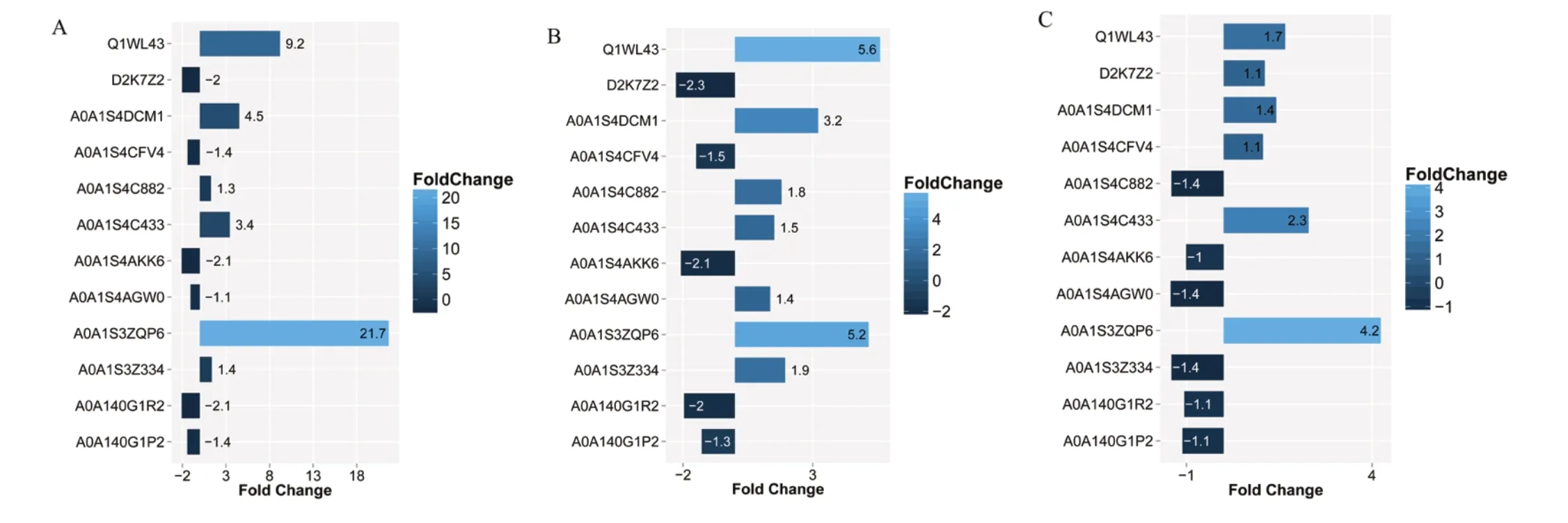
图 8 PRM 验证结果Fig. 8 PRM verification results
3 讨论
叶片衰老是一个受基因调控的复杂而有序的生理活动过程[16]。叶片颜色由绿变黄、合成代谢减弱而分解代谢加强、蛋白质及大分子物质的降解是叶片衰老过程中的重要表现[17]。本研究结合烟叶衰老过程中抗氧化酶活性和蛋白质组学研究,探讨了烟叶衰老过程中的生理变化和蛋白质组学变化。
一般情况下,活性氧是植物发育性细胞程序性死亡的重要信号分子[18]。在植物生长发育过程中,抗氧化酶参与活性氧的清除过程,平衡植物体内活性氧含量[19]。随着烟叶的衰老,抗氧化酶包括SOD、CAT、POD 和APX 活性呈先增加后下降的趋势。说明在烟叶衰老初期,抗氧化酶还保持一定的活性,但随着烟草植株各生理代谢的减弱,抗氧化酶活性显著下降。该研究结果与小麦[20],甜瓜[21]等作物的研究结果一致。
在GO 分析中,差异蛋白质涉及代谢过程、细胞过程和应激反应等过程,存在于细胞、细胞组分等部位,有催化活性、绑定活性等功能。KEGG 通路分析表明,不同时期烟叶差异蛋白主要参与代谢途径、不同环境中的微生物代谢、光合作用、次生代谢产物的生物合成等代谢途径。其中,在代谢途径、不同环境中的微生物代谢、光合作用中,下调蛋白所占比例较大,说明在烟叶衰老过程中,代谢途径、不同环境中的微生物代谢、光合作用等代谢途径代谢强度下降。
在86 个差异蛋白聚类分析中,大量差异蛋白参与代谢途径,如A0A1S4AKK6(Chlorophyll a-b binding protein,chloroplastic, 叶 绿 素a-b 结 合 蛋白, 叶 绿 体)、A0A1S3ZQP6(polyphenol oxidase E, chloroplastic-like isoform X1,多酚氧化酶E,类叶 绿 素X1)、A0A1S3X216(polyphenol oxidase E, chloroplastic-like,多酚氧化酶E,类叶绿体)等。叶绿素a/b 结合蛋白是植物光系统中与植物色素分子结合的一系列蛋白,具有捕获光能、传递能量以及响应各种胁迫的功能[22]。该类蛋白在烟叶衰老过程中表达下调,说明烟叶捕获光能的能力减弱。多酚氧化酶与类囊体膜结合,大量存在于植物体内,易发生聚合作用生成醌类物质,还具有促进清除活性氧的功能[23]。该类蛋白在烟叶衰老过程表达上调,说明烟叶衰老叶色变化可能与叶内多酚氧化酶相关,也可能是因为叶内活性氧含量增加,导致该类蛋白呈增加趋势。
86 个差异蛋白质中,与烟叶衰老过程光合作用相关的蛋白质有A0A140G1P2(Photosystem II protein D1,光系统II 蛋白D1)、D2K7Z2(Photosystem I reaction center subunit,光系统I 反应中心亚基)、A0A140G1R2(Photosystem I P700 chlorophyll a apoprotein A2, 光 系 统I P700 叶 绿 素 载 脂 蛋 白A2)、A0A1S4CFV4(photosystem I reaction center subunit IV A,chloroplastic,光系统I 反应中心IV A亚单元,叶绿体)等。光合作用的光反应发生在叶绿体类囊体膜上,光系统I、光系统II、细胞色素b6f复合体(Cyt b6f)、ATP 合酶等复合物参与光合作用中电子传递[24]。4 个光合作用相关的蛋白质均表现为下调,说明在烟叶衰老过程中,光合过程电子传递受阻,从而影响光合作用的顺利进行。
在PRM 验证中,三个对比组选择12 个蛋白进行验证,分别存在10/9/10 个趋势与iTRAQ 结果一致的蛋白,说明iTRAQ 定量结果可靠,验证了iTRAQ 结果的可靠性。6 个蛋白质在3 组间均表现为与iTRAQ结果一致的趋势,包括Q1WL43、A0A1S4DCM1、A0A1S4C433、A0A1S4AKK6、A0A1S3ZQP6、A0A140G1P2 可能是烟叶衰老潜在靶标蛋白。
4 结论
(1)烟叶衰老过程中抗氧化酶包括SOD、CAT、POD 和APX 活性在烟叶成熟的3 个时期存在显著差异。
(2)烟叶衰老过程中,共鉴定出4747 个定量蛋白,过熟与未熟烟叶相比找到321 个差异蛋白,包括122 个上调蛋白与199 个下调蛋白。过熟与适熟烟叶相比,有319 个差异蛋白,其中124 个表现为上调,195 个表现为下调。适熟与未熟相比,发现223 个差异蛋白质,包括125 个上调蛋白和98 个下调蛋白。
(2)GO功能注释中,差异蛋白质主要参与代谢过程(metabolic process)、细胞过程(cellular process)等生物过程;构成细胞(cell)、细胞组分(cell part)、细胞器(organelle)等细胞组成;主要的分子功能有催化活性(catalytic activity)、结合(binding)等。
(3)在KEGG 功能富集中,差异蛋白质显著富集于代谢途径、光合作用、次生代谢产物的生物合成代谢途径。
(4)PRM 验证中,在对比组OM vs IM,OM vs WM 和WM vs IM 中,分别有10/9/10 个蛋白质验证结果与iTRAQ 定量表现出相同的趋势。6 个差异蛋白 包 括Q1WL43、A0A1S4DCM1、A0A1S4C433、A0A1S4AKK6、A0A1S3ZQP6、A0A140G1P2 可能是烟叶衰老潜在靶标蛋白。

