烟草黑胫病不同植物源生防菌的筛选及防效测定
常栋,顾建国,贾方方 ,马文辉,许跃奇,闫海涛
1 河南省烟草公司平顶山市公司,河南省平顶山市建设路263号,467000;2 商丘师范学院生物与食品学院,植物与微生物互作河南省高校重点实验室,河南省商丘市文化路293号,476000
烟草黑胫病是由烟草疫霉菌(Phytophthora parasitica var.nicotianae)引起的一种重要的土传病害,该病在高温、高湿环境下易流行爆发,典型症状为植株矮化、叶片自下而上凋萎发黄、根部和茎部萎缩、坏死[1-2],茎髓部呈碟片状。近年来,随着我国烟区连作烟田比例的增加[3],烟草黑胫病愈演愈烈,病害严重的地块发病率高达75%,甚至绝收,给我国烟叶生产带来重大威胁。生产上多采用种植抗病品种[4-5]和通过化学药剂[6-7]进行黑胫病的防治,但是当前尚未发现对烟草黑胫病免疫种,且品种抗性会随着黑胫病菌生理小种的消长而减低[8];同时,化学农药易造成环境污染及烟叶中农药残留,长期使用还会使病菌产生抗药性[9]。因此,寻找一种安全、高效、无公害的烟草黑胫病防治方法已成为烟草生产的当务之急。
生物防治可修复和改良作物的微生态环境、抑制植物病害病原菌的生长并激活作物的防御反应,已成为目前国际上病害防治的首选[10-11]。Luna等[12]从香蕉幼苗中分离到了粘质沙雷菌(Serratia marcascens),可提高香蕉植株的防御酶活性 ,进而抑制香蕉幼苗的枯萎病。Larran 等[13]从小麦中分离的内生菌株钩状木霉 (Trichoderma hamatum)、青霉属(Penicillium sp.)、芽孢杆菌属和淡紫拟青霉(Paecilomyces lilacinus)等对小麦黄斑叶枯病具有明显的防治效果。这些研究均为从病害作物的抗病株中分离拮抗菌,除此之外,从其他非寄主植物中寻找生防菌,扩大内生菌的获得范围,也逐渐成为生物防治的重要途径。Prado 等[14]分离出的植物内生真菌木质素降解子囊菌(Paraconiothyrium variabile)对病原菌尖孢镰刀菌(Fusarium oxysporum)的生长可起到明显的拮抗作用,并抑制其致病毒素的产生。Romeralo 等[15]从地中海松中分离的内生真菌木霉属(Trichoderma spp.)、出芽短梗霉(Aureobasidium pullulans) 等均可对枯梢病病斑的扩展起到有效抑制作用。王兰英等[16]从砂仁(Amomum villosum Lour.)中分离得到的内生细菌SRJ-4 菌株,对水稻纹枯病的盆栽和田间防效分别可达80.7%、79.4%。余杰颖等[17]从石斛(Dendrobium nobile Lindl)中分离的内生菌DEB-2 可防治辣椒白星病。上述研究从非寄主作物中分离内生菌,皆取得了较好的防治效果,为进一步的生防菌剂复配研发奠定了基础。然而,当前烟草黑胫病的生防菌获取对象仍然局限于烟草[18-22],鲜见从其他不同植物中分离筛选拮抗菌,限制了生防菌株的来源及后期菌剂的研发推广。本研究从构树、枸杞、马铃薯、辣椒、曼陀罗、茄、夹竹桃、烟草等8 种不同植物茎内,筛选烟草黑胫病的拮抗菌株,旨在扩大烟草黑胫病微生物防治菌的菌种来源,为研制开发烟草黑胫病生防菌剂提供菌种资源。
1 材料与方法
1.1 烟草疫霉菌的分离鉴定
从平顶山市郏县烟草种植地黑胫病发病严重地块选取具备烟草黑胫病典型症状的植株(中烟100),经流水冲洗30 min,切开茎,取片状髓部,置于胡萝卜固体培养基于28℃恒温培养,待长出菌丝后连续转移3~4 次纯化。通过分离和纯化,获得烟草黑胫病病原菌菌株,观察其菌落、菌丝、孢子囊形态,并进行致病性的分析测定。培养基培养的烟草黑胫病菌CTAB 法提取基因组DNA,利用通用引物ITS1、ITS4 进行扩增,产物连接到克隆载体,送至南京金斯瑞生物有限公司进行测序。测序得到的序列在NCBI(http://www.ncbi.nlm.nih.gov)BLAST 搜 索比对,MEGA6.0 软件进行Neighbor-Joining 分析生成系统发育树,确定菌株为烟草疫霉菌(Phytophthora parasitica var. nicotianae)。
1.2 不同植物内生菌的分离与纯化
采集构树、枸杞、马铃薯、辣椒、曼陀罗、茄、夹竹桃、烟草(发病地区健康烟株)的茎杆样品,按照如下方法进行植物内生细菌的分离:
将待分离植物置于流水下冲洗30 min 后切段,用75%的乙醇、2%次氯酸钠消毒、无菌水冲洗5 次后再用灭菌滤纸吸干表面水分,最后用无菌刀切成2~3×3~5 mm 小段,置于装有灭菌水的三角瓶中,编号。震荡三角瓶,用吸管分别吸1 mL 菌液,涂抹于培养基上,28℃恒温培养1~3 d,挑取不同形状的菌落重新置于新的平板上划线纯化。挑取划线培养的单个菌落移入试管斜面保存,备用。
1.3 拮抗菌的筛选、鉴定
采用平板对峙培养法筛选2 次,将分离出的内生菌和烟草疫霉菌接种到胡萝卜平板培养基上28℃黑暗培养3 d。用半径5 mm 的打孔器将烟草疫霉菌接种到培养基的中心,在菌块离中心15 mm 处对称两侧接种3 μL 拮抗菌液(约1.0×106cfu/mL),倒置,观察黑胫病菌周围有无抑菌带,并测量其抑菌直径和抑菌率,每处理重复3 次。选取平板对峙效果较好的拮抗菌按上述方法进行第2 次室内拮抗实验。
抑菌率(%)=[(对照组菌落直径-处理组菌落直径)/(对照组菌落直径-菌饼直径)]×100%
抑菌直径(mm)=对照组病原菌菌落直径-处理组病原菌菌落直径
菌株鉴定:综合室内平板对峙实验与盆栽防效结果,对拮抗和防病效果较好的拮抗菌,通过形态观察[23]、生理生化测试[24-25]和16S rDNA 序列分析[26]对菌株进行种属鉴定,测序过程和公司同烟草疫霉菌。
1.4 拮抗菌株对盆栽和田间烟草黑胫病的防治效果测定
从筛选出的拮抗细菌菌株斜面上挑取1 环培养物接种于50 mL NA 液体培养基中,于35℃、140 r/min振荡培养12 h 得到拮抗菌种子液。
选择抑菌活性均达显著水平的6 个菌株进行温室盆栽试验,对照组CK 为只接种病原菌处理:在烟苗还苗后,用手术刀划伤烟株茎基部,然后,采用灌根法接种10 mL 烟草黑胫病病原菌;处理1 到处理6 分别为J11、J21、T3、T23、G3 和KY 不同拮抗菌组,于烟苗还苗后,先采用灌根法接种拮抗菌发酵液(孢子浓度为1.0×108cfu/mL),每盆接种10 mL,7 d 后接种烟草黑胫病病原菌10 mL,此后每7 d 接种拮抗菌发酵液1 次,发酵液共接种3 次。每处理9 株,各处理重复3 次,接种14 d 后开始调查发病情况。
大田试验在平顶山市白龙庙村黑胫病高发地块进行,于2019 年4 月26 日移栽,将拮抗菌发酵液稀释20 倍,每株灌根200 mL,保证其孢子总量同盆栽试验一致,考虑到大田烟株生育期比盆栽长,将大田接种时间间隔定为15 d,共灌根3 次。每处理63 株,共重复3 次。以自然条件下未作处理烟株为对照。烟草黑胫病分级标准参照中华人民共和国烟草行业标准(GB/T 23222—2008)进行。
发病率 =(染病株数/调查总株数)×100%
病情指数 =∑(各级病株数×该病级值)/ (调查总株数×最高级值)×100%
相对防效 =(对照病情指数-处理病情指数)/对照病情指数×100%
1.5 拮抗菌培养液灌根对烟株生长的影响
于成熟期,分别从对照组和各处理组(处理1 至处理6)中随机选择3 株,测量其株高、茎围、有效叶片数、最大叶叶长、叶宽和叶面积。
2 结果与分析
2.1 不同植物源内生菌的分离与平板对峙作用
从构树、枸杞、马铃薯、辣椒、曼陀罗、茄子、夹竹桃、烟草等8 种不同植物茎内共分离出89 种内生菌,室内平板对峙拮抗筛出10 种有较好的拮抗作用的内生菌。从10 株菌株中筛选出6 株具有较强拮抗作用的内生菌(表1),分别为来自构树的J11、J21、G3,马铃薯的T3、T23,及烟草中的KY。平板拮抗试验下该6 株拮抗菌株的抑菌带清晰透明,宽度均达到5 mm 以上,对病原菌的扩展具有明显的抑制作用。以T3、KY 和J21 的抑菌效果最好,其抑菌直径均达到48 mm,抑菌率均高于91%。

表1 拮抗菌对烟草疫霉菌生长的抑制效果Tab. 1 The inhibition effect on growth of Phytophthora parasitica var.nicotianae by antagonistic bacteria
2.2 不同植物内生拮抗菌的形态观察与理化测试
拮抗细菌形态观察和生理生化反应结果见表2、表3。

表2 拮抗细菌的形态观察Tab. 2 Morphological observation of antagonistic bacteria

表3 不同拮抗细菌的生理生化反应Tab. 3 Physiological and biochemical reactions of different antagonistic bacteria
2.3 盆栽和大田防效测定
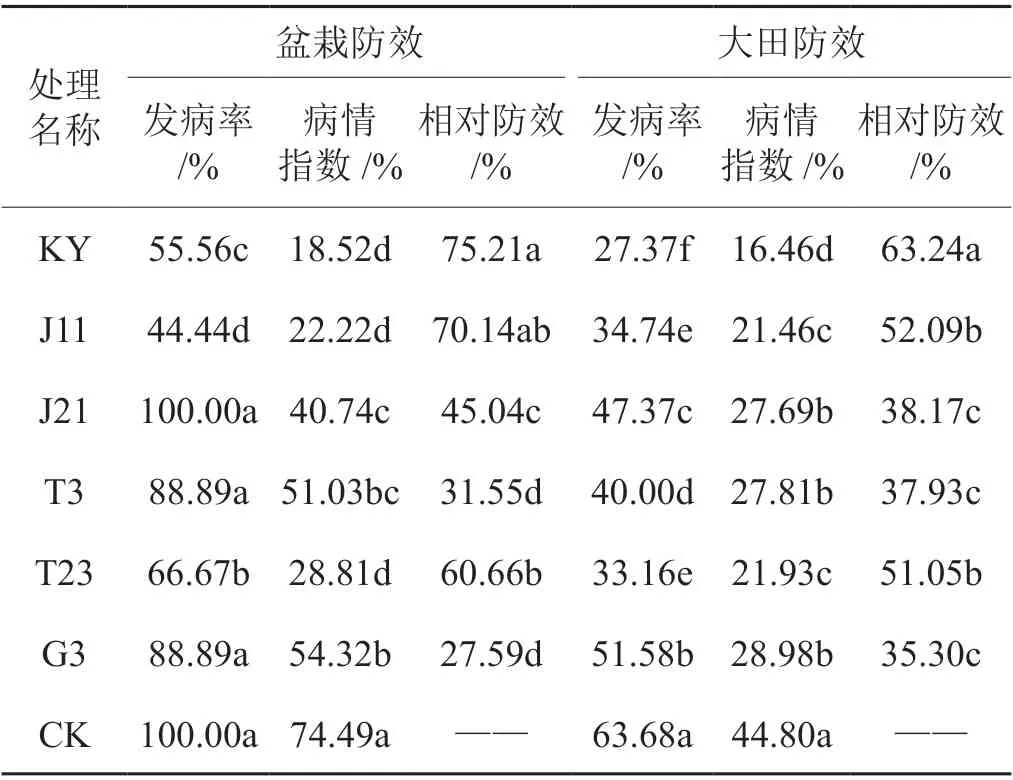
表4 不同处理盆栽及大田试验防治效果Tab. 4 Control effect of different treatments in pot and field tests

图1 不同拮抗菌处理的盆栽防效(a)和成熟期大田防效(b)Fig. 1 Control effect of different antibacterial treatments in pot test (a) and field test (b)
盆栽试验在接种烟草疫霉菌两周后,各处理均不同程度地呈现烟草黑胫病的典型症状,于成熟期统计各处理最终的发病情况。其中对照发病率为100%,同对照相比,各拮抗菌处理的发病率和病情指数均得到明显控制,其中以KY 的病情指数最低,相对防效最高,达到75.41%。J11、T23 次之(表4,图1a)。
大田试验于成熟期各处理开始呈现自然发病症状,由于所选试验田为往年黑胫病高发区,观其对照,发病率高达63.68%,极大降低了烟草的产量。采用灌根法接种不同拮抗菌发酵液后,病情得到了明显控制,发病率和病情指数显著降低,防治效果明显,相对防效仍以KY 最高,达到63.62%,J11 和T23 次之,分别为52.67%和51.11%(表4,图1b)。
2.4 不同菌株对烟株农艺性状的影响
为了解各拮抗菌对烟株农艺性状的影响,进一步调查了不同菌剂处理下烟株的农艺性状指标(表5):同对照相比,各处理的株高、茎围均有显著性提高,株高以KY 最大,茎围以J11 最大;而有效叶片数、叶长、叶宽和叶面积四项指标各处理间差异均不显著。初步表明各拮抗菌株可通过抑制黑胫病病害的发生,进而影响烟株株高、茎围等的生长发育。
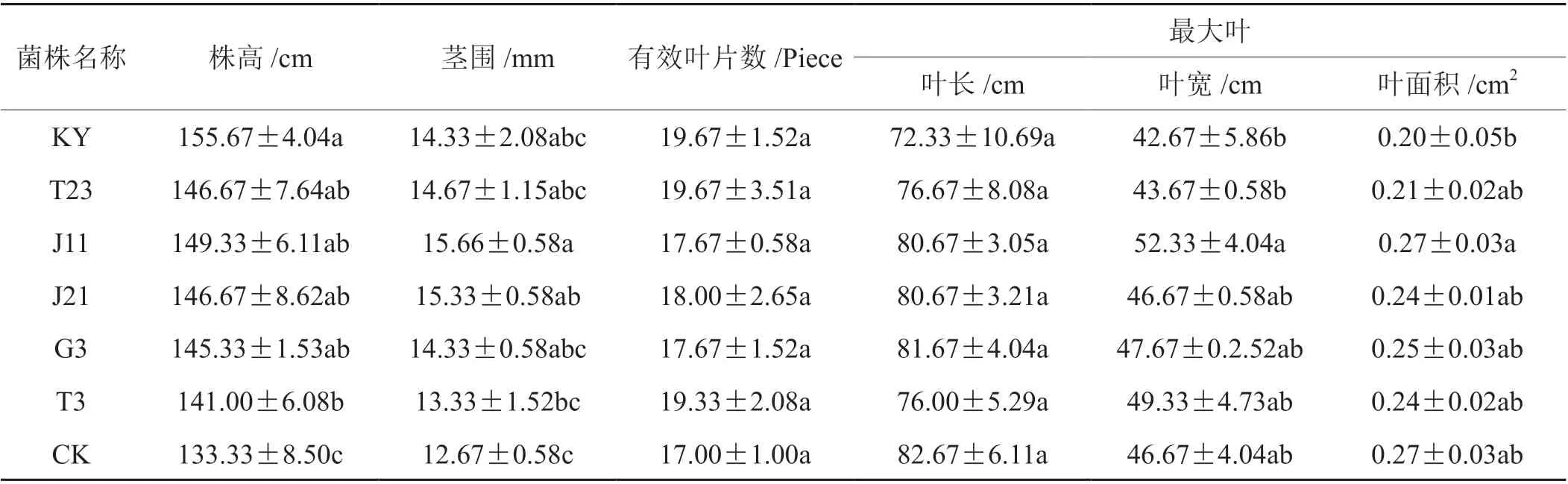
表5 不同拮抗菌剂处理对大田烟株农艺性状的影响Tab. 5 Effects of different antagonistic agents on agronomic characters of tobacco plants in field
2.5 烟草疫霉菌拮抗细菌的16S rDNA 鉴定
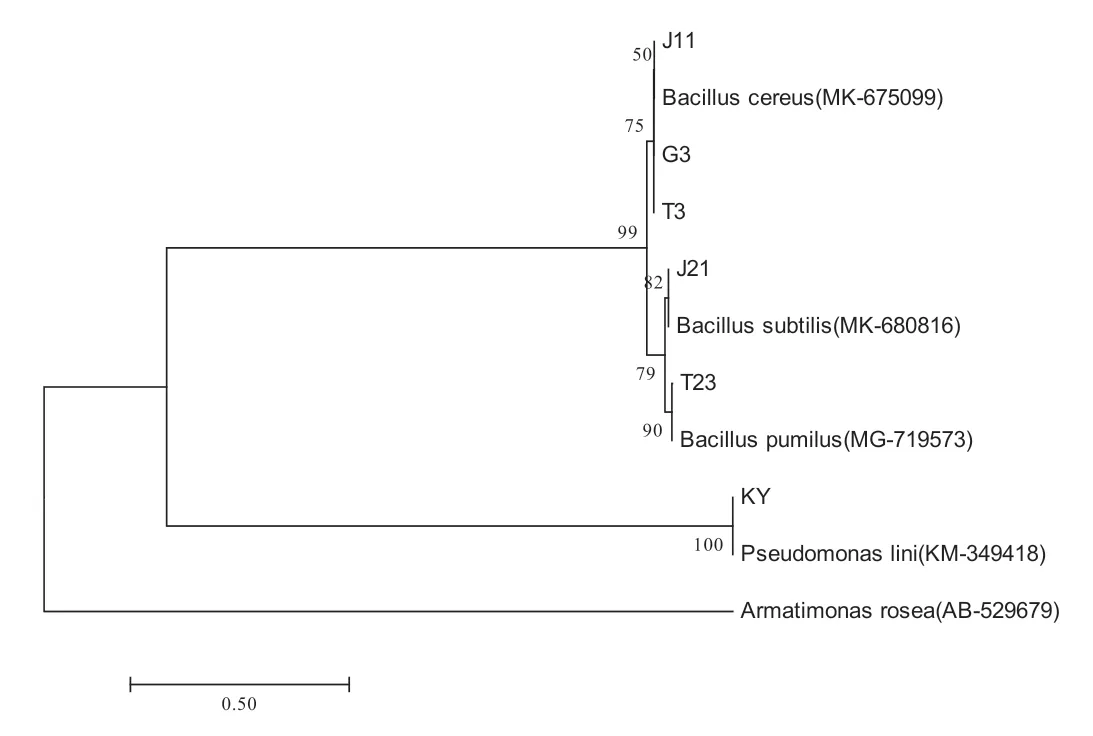
图2 16SrDNA 全序列系统发育树Fig. 2 The full sequence phylogenetic tree of 16 S rDNA
KY、T23、J21 的16SrDNA 序 列 长 度 为 1388bp,1385 bp 和1397 bp,J11 菌 株、G3 菌 株 和T3 菌株的16SrDNA 序列长度均为1400bp。将这6种菌株的16SrDNA 序列用blast 在数据库进行比对,然后用MEAG7 建立系统发育树,见图2。
结合形态观察、生理生化特性和16SrDNA 序列同源性分析,KY 初步鉴定为亚麻假单胞菌,登录号为KM-349418;J11 菌株、G3 菌株和T3 菌株初步鉴定为蜡状芽孢杆菌,登录号为MK-675099;T23 初步鉴定该菌为短小芽孢杆菌,登录号为MG-719573;J21 初鉴定该菌为枯草芽孢杆菌,登录号为MK-680816。
3 结论与讨论
3.1 内生菌的分离、筛选与鉴定
以构树、枸杞、马铃薯、辣椒、曼陀罗、茄子、夹竹桃、烟草等8 种植物的茎为分离材料,获得烟草疫酶菌的拮抗菌株89 株,其中拮抗作用较好的为10种,通过室内二次平板对峙筛选出6 株:KY、T23、J11、J21、G3 和T3,经过形态观察、生理生化试验和16S rDNA 序列分析,初步鉴定J11、G3、T3 同为芽孢杆菌属的腊状芽孢杆菌(Bacillus cereus),J21为枯草芽孢杆菌(Bacillus subtilis),T23 为短小芽孢杆菌(Bacillus pumilus);KY 为假单胞菌属的亚麻假单胞菌(Pseudomonas lini)。经过盆栽试验和大田试验复筛后,以从烟草中分离的KY(亚麻假单胞菌,Pseudomonas lini)、从马铃薯中分离的T23(短小芽孢杆,Bacillus pumilus)和从构树中分离的J11(腊状芽孢杆菌,Bacillus cereus)防效最好。
本试验经二次平板对峙筛选出的6 株拮抗菌中,除KY 为从烟草中分离的内生菌外,其余5 株均为从其他植物中分离筛选,且拮抗效果较好,表明从非寄主植物中亦可获取对烟草黑胫病防效显著的生防细菌,该结论扩展了前人将烟草或其根际土壤作为防治烟草病害生防菌筛选的单一来源的试验方法[27]。此外,本文从烟草中分离筛选出的亚麻假单胞菌(Pseudomonas lini)在烟草黑胫病的生物防治研究尚未见报道。
试验筛选出的J11、G3、T3 菌株,虽然同为腊状芽孢杆菌(Bacillus cereus)的,其抑菌率、盆栽和大田防效均不稳定,造成这种差异的主要原因是分离纯化内生菌时选用的不同植物来源;另外,该试验工作量大,共持续进行了两年,内生菌的分离及筛选历经了不同的试验操作人员试验批次,也会对试验结果有一定的影响,下一步亟需建立一套高质高效的拮抗菌筛选体系。
3.2 烟草根茎类病害生防菌剂的研发
本文针对烟草黑胫病开展了生防菌的筛选鉴定,获得的6 株拮抗菌分别为芽孢杆菌属[28]和假单胞菌属[29],是自然界广泛分布的生防细菌,种群庞大,对烟草疫霉菌的拮抗作用较强[30],是烟草黑胫病生物防治中的研究热点。本文结果为烟草黑胫病生物防治试验的第一阶段,筛选出的生防菌株正在投入进行:培养温度、pH 等发酵条件的优化;各菌株对种子萌发的影响,在烟株体内的定殖试验;以及无互斥作用的2株或2 株以上的菌株之间的复配等第二阶段试验。然后将以大田试验效果确定拮抗菌剂的浓度、剂型、喷施方式及时间等,最终实现烟草黑胫病的生防菌剂的产业化,以期为烟草农业的可持续发展提供实践支持。
本研究用烟草疫霉菌为单一筛选目标,然而实际生产中烟草黑胫病、根腐病和根际线虫病等根茎类病害常相伴发生,互相影响。若是只针对其中一种病害,易造成生防菌剂防效单一,综合防病能力差等问题,今后可针对烟草根茎类病害开展内生菌的综合筛选,探明其各自病原菌致病机理,利用我国丰富的生防菌资源,开发出高效、低毒、环保的烟草根茎类病害综合防治抗菌药物。

