奶牛分娩后早期血浆代谢物变化研究
张萌 罗芳 王敏 武彦泽 王俊奎 和东迁 陈丽尧 陶金忠
(1. 宁夏大学农学院,银川 750021;2. 内蒙古圣牧控股有限公司,巴彦淖尔 015000;3. 宁夏上陵牧业有限公司,青铜峡 751600)
围产期是从产前3周到产后3周,这个阶段奶牛机体代谢发生巨大的变化[1]。主要体现在随着分娩的临近,奶牛干物质的摄入不能满足自身能量消耗,从而导致奶牛负能量平衡(Negative energy balance,NEB)[2]。NEB 损害奶牛的健康和影响生产,并导致免疫力下降[3]。当奶牛发生NEB时通常引起脂肪肝和酮病[4],而这两种疾病均能造成肝功能的损伤[5-6]。肝脏是能量代谢的主要器官,奶牛体内的糖代谢主要来自于肝脏糖异生[7]。天冬氨酸(Aspartic acid,ASP)、组氨酸、蛋氨酸、脯氨酸和丝氨酸的浓度在患有酮症的奶牛中下降[8]。这些氨基酸的浓度降低,因为它们在糖异生过程中被大量使用[9-10]。而在分娩后的几天内,乳腺对葡萄糖、氨基酸和脂肪的需求量成倍增加,肝脏糖异生和脂肪动员的速度大大加快[11-12]。因此,奶牛分娩后血浆代谢物发生显著变化,影响奶牛的健康。代谢组学是一种高通量、高灵敏度的现代分析技术。目前,代谢组学方法已成功地应用于奶牛产后血浆生物标志物的筛选[13]。
为此,本研究通过对分娩当天和产后第7天血浆代谢组学研究,探究分娩后早期奶牛血浆代谢物的变化情况,探讨分娩后血液代谢组变化,旨为了解分娩后血浆代谢物变化对奶牛健康状况提供参考。
1 材料与方法
1.1 材料
1.1.1 试验仪器和设备 超高效液相:1290 UHPLC(美国Agilent公司);高分辨质谱1:QTOF 6550(美国Agilent公司);高分辨质谱2:Triple TOF 6 600(AB Sciex);天平:BSA124S-CW(Sartorius);研磨仪:JXFSTPRP-24(上海净信科技有限公司);超声仪:PS-60AL(深圳市雷德邦电子有限公司);纯水仪:明澈D24 UV(Merck Millipore);色谱柱:ACQUITY UPLC BEH Amide 1.7 μm 2.1×100 mm(Waters)。
1.1.2 试验材料和试剂 醋酸铵(CNW Technologies);乙腈(CNW Technologies);氨水(CNW Technologies);甲醇(CNW Technologies);L-2-氯苯丙氨酸(上海恒柏生物科技有限公司)。
1.2 方法
1.2.1 试验动物分组和血液的采集保存 在宁夏某大型集约化奶牛场,选择15头2-3胎、预产期和体况相近(体况评分BCS 3.0-3.5)的健康荷斯坦奶牛,奶牛奶产量(分娩当天由于采集初乳无法统计)和胎次的均值±SD,见表1。分别在分娩当天(A组)和产后第7天(B组)晨饲前(5:00-6:00)尾静脉采集血液10 mL,使用肝素钠抗凝,并以3 000 r/min离心10 min进行分离,收集上层血浆于冷冻管中,标记后置于-80℃冰箱冷冻保存,以备后续分析。

表1 奶牛奶产量和胎次
1.2.2 检测方法
1.2.2.1 代谢物提取 参照张萌等[14]的代谢物提取方法。
1.2.2.2 上机检测 使用的色谱柱为购自Waters的UPLC BEH Amide 色谱柱(1.7 μm×2.1×100 mm)。进样体积为2 μL。按照表2中的流动相参数在安捷伦1290超高效液相控制下进行分析。
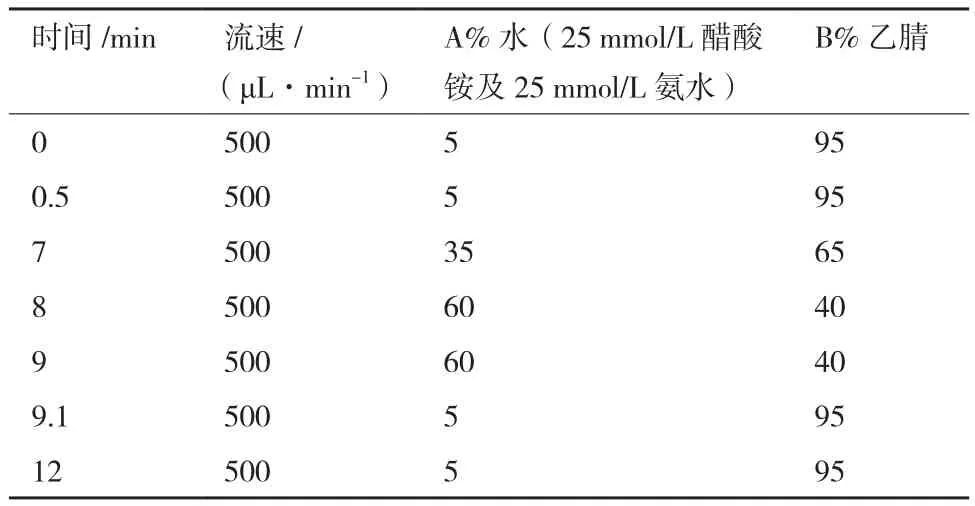
表2 液相色谱流动相条件
控制软件(Analyst TF 1.7,AB Sciex)控制下AB 6600 Triple TOF & Agilent 6550 QTOF质谱仪基于IDA功能进行一级、二级质谱数据采集。每个数据循环采集中,筛选出强度最强且大于100的分子离子进行采集对应的二级质谱数据。轰击能量:30 eV,每50 ms15张二级谱图。ESI离子源参数设置如下:温度:650℃,辅助气压:60 Psi,气帘气压:35 Psi,雾化气压(GS1):60 Psi,喷雾电压:5 000 V(正离子模式)或-4 000 V(负离子模式)。
1.2.3 数据处理 原始数据经ProteoWizard软件处理,将数据转换成mzXML格式。采用XCMS程序对转化后数据进行峰对齐、提取峰面积和峰积分等处理工作。检查数据的完整性和缺失值状况,补充或删除数据中的极值和数据中组内缺失值大于50%的离子峰。内标校正和归一化处理数据,使得代谢物之间和各样本之间均可以进行平行比较。
1.2.4 统计学分析 使用SIMCA软件对处理后数据进行模式识别和Pareto-scaling预处理。对处理后数据进行多元统计分析,无监督主成分分析(Principal component analysis,PCA),正交偏最小二乘判别分析(Orthogonal partial least squares-discriminant analysis,OPLS-DA)。构建表达模型,并对模型中的数据进行置换检验(Permutation test),计算根据OPLSDA模型得到变量投影重要度(Variable importance in the projection,VIP)。对数据进行单变量统计分析包括:变异倍数(Fold change,FC)和Students t-test分析。
1.2.5 差异代谢物鉴定和生物学信息学分析 经过多元统计分析得到VIP大于1的值,用产后第7天均值比上分娩当天均值得到FC值,结合P值。以VIP>1初步筛选出各组间的差异物,单变量统计分析P<0.05和FC>1.3或FC<0.77进一步筛选显著性差异代谢物。显著性差异代谢物使用Origin 8.0进行ROC Curve分析得到AUC面积大于0.8的代谢物。将筛选出的显著性差异代谢物在线分析平台MetaboAnalyst进行聚类分析和代谢通路分析。
2 结果
2.1 代谢谱分析
由图1可知,QC样本TIC出峰保留时间和峰面积都重叠很好,表明在整个实验过程中仪器稳定性很好。由图2可知,QC样本相关性越接近于1,说明整个方法稳定性越好数据质量越高。QC样本相关性很高,表明数据质量很高。
2.2 多元统计学分析、
由图3可知,对分娩当天(A组)和产后第7天(B组)的PCA分析,观察所有样本之间的总体分布趋势,表明正、负离子模式数据下A组和B组有一定的分离趋势。由图4可知,建立A组和B组的OPLS-DA模型,得到的模型评价参数正离子模式R2Y=0.959和负离子模式R2Y=0.973。R2越接近1表明模型越稳定可靠,本试验正负离子均R2Y≥0.95,表明模型稳定可靠。由图5可知,显示了基于正、负离子模式数据两组OPLS-DA模型的置换检验图,正、负离子模式数据置换检验截距,分别是Q2=-
0.340(正离子模式)和Q2=-0.329(负离子模式)。Q2intercept<0说明本试验正、负离子模式数据建立的OPLS-DA模型均未发生过度拟合。
2.3 差异代谢物的筛选
以 VIP>1、P<0.05、FC>1.3或FC<0.77进一步筛选显著性差异代谢物。分娩当天和产后第7天两组共筛选出17种显著性代谢物。正离子模式下筛选出9个显著性差异代谢物,其中4个代谢物产后第7天显著低于分娩当天组,5个代谢物产后第7天显著高于分娩当天组(P<0.05)。负离子模式下筛选出8个显著性差异代谢物,其中2个代谢物产后第7天显著低于分娩当天组,6个代谢物产后第7天显著高于分娩当天组(P<0.05)。正、负离子模式下鉴定出的差异代谢物见表3。
2.4 生物信息学分析和生物标记物筛选
利用ROC曲线对显著性差异代谢物进行分析筛选,考察这些显著性差异代谢物的分类识别能力。当ROC曲线下的面积(Area under curve,AUC)大于0.5识别能力较好,AUC值越接近于1,识别效果越好。如图6,结果显示A组和B组共有11个代谢物AUC面积在0.8以上。筛选出11个代谢物产后第7天比分娩当天全部上调:磷脂酰胆碱(16∶0/16∶0)、二醇胆酸、脯氨酸-丝氨酸、脯氨酸-甘氨酸、1-硬脂酰基-sn-甘油3-磷酸胆碱、乳清、L-天冬氨酸、N-乙酰基-L-天冬氨酸、异戊酰甘氨酸、L-肉碱和苯甲酸。
利用MetaboAnalyst分析平台对ROC曲线筛选出的显著性差异代谢物进行聚类分析和KEGG代谢通路分析。图7显示了正负离子模式A组和B组显著性差异代谢物层次聚类结果。结果发现同组样品很好聚类在同一簇中,聚在同一簇内的代谢物具有相似的表达模式,表明筛选的显著性差异代谢物合理且准确。由图8可知,A组和B组两组11个显著性差异代谢物共参与11种不同代谢通路。11个代谢通路分别是:丙氨酸,天冬氨酸和谷氨酸代谢、亚油酸代谢、α-亚麻酸代谢、精氨酸生物合成、组氨酸代谢、泛酸和CoA生物合成、β-丙氨酸代谢、甘油磷脂代谢、花生四烯酸代谢、嘧啶代谢和氨基酰基-tRNA生物合成。主要代谢通路以影响力大于0.2(Pathway impact>0.2)为筛选标准,Pathway impact>0.2代谢通路丙氨酸,天冬氨酸和谷氨酸代谢。甘油磷脂代谢和嘧啶代谢两组影响力相对较小(Pathway impact>0.05)。

图1 QC样本TIC图
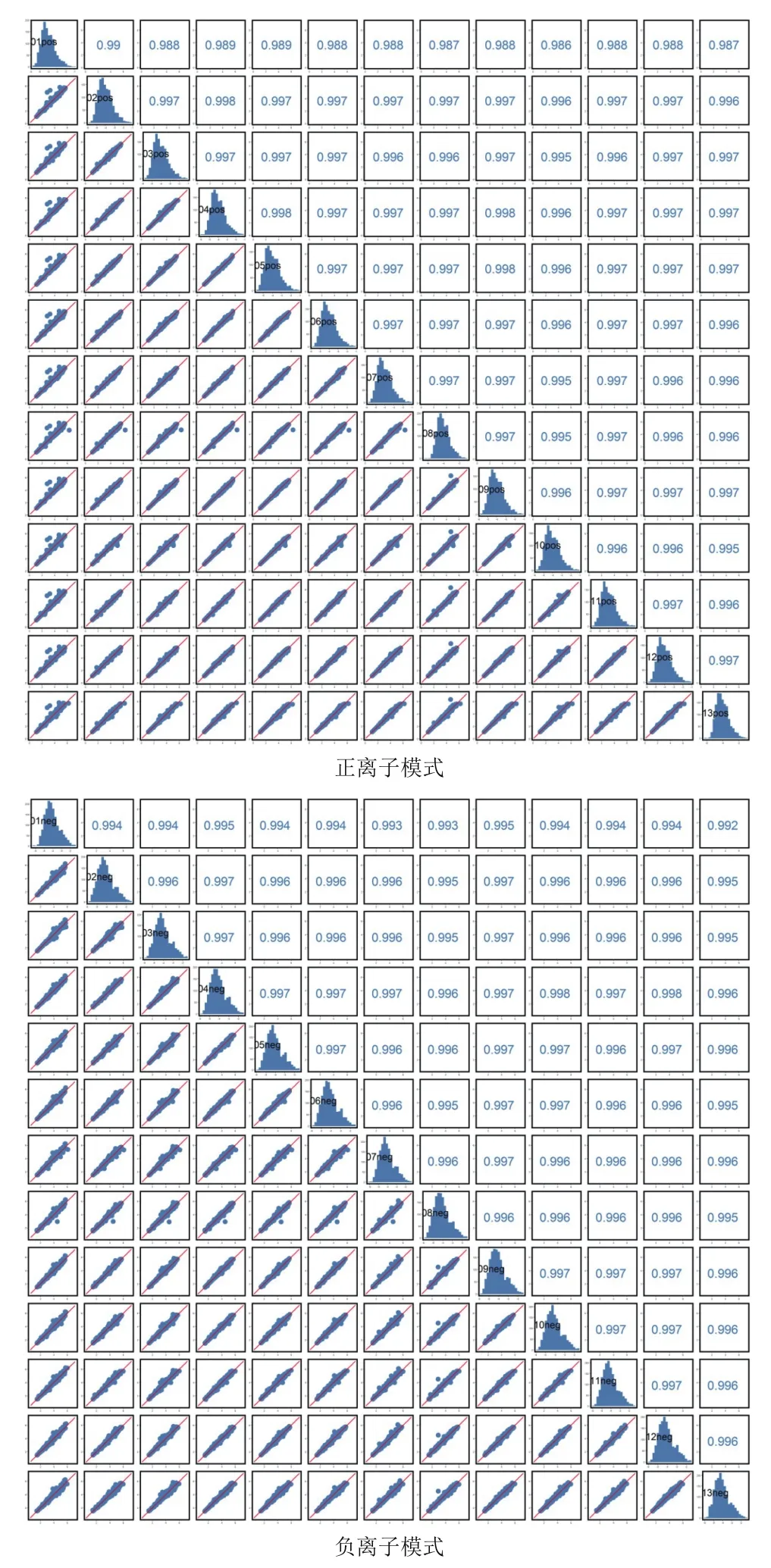
图2 正离子和负离子QC样本相关性分析
3 讨论
3.1 丙氨酸,天冬氨酸和谷氨酸代谢
N-乙酰 -L-天冬氨酸(N-acetyl-aspartic acid,NAA)是存在于哺乳动物大脑中的游离氨基酸[15],在线粒体由游离ASP乙酰化以乙酰辅酶A(CoA)为辅助因子合成[16]。NAA被认为是多种神经系统疾病的生物标志物[17]。ASP是一种重要的非必需氨基酸,主要参与尿素循环、糖异生和苹果酸-天门冬氨酸穿梭等多种生化过程[18]。这些生化过程主要发生在肝脏,当ASP含量降低时导致氨积累,且引起肝脏损伤[19-20]。ASP含量的增加表明通过糖异生等过程产生的能量增加[19]。ASP的乙酰化可以促进其从线粒体中去除,有利于谷氨酸转化为酮戊二酸,从而进入三羧酸循环进行能量生产[16]。有研究表明丙氨酸、ASP和谷氨酸代谢在淋巴细胞再生和免疫过程中起着重要作用[21]。在本研究中NAA和ASP在产后第7天相对分娩当天上调,可能是在丙氨酸,天冬氨酸和谷氨酸代谢中参与能量代谢,维持分娩后泌乳需要大量的能量。这可能是为了增加机体能量的产生,减轻对肝脏的影响,维持奶牛分娩后的机体健康。
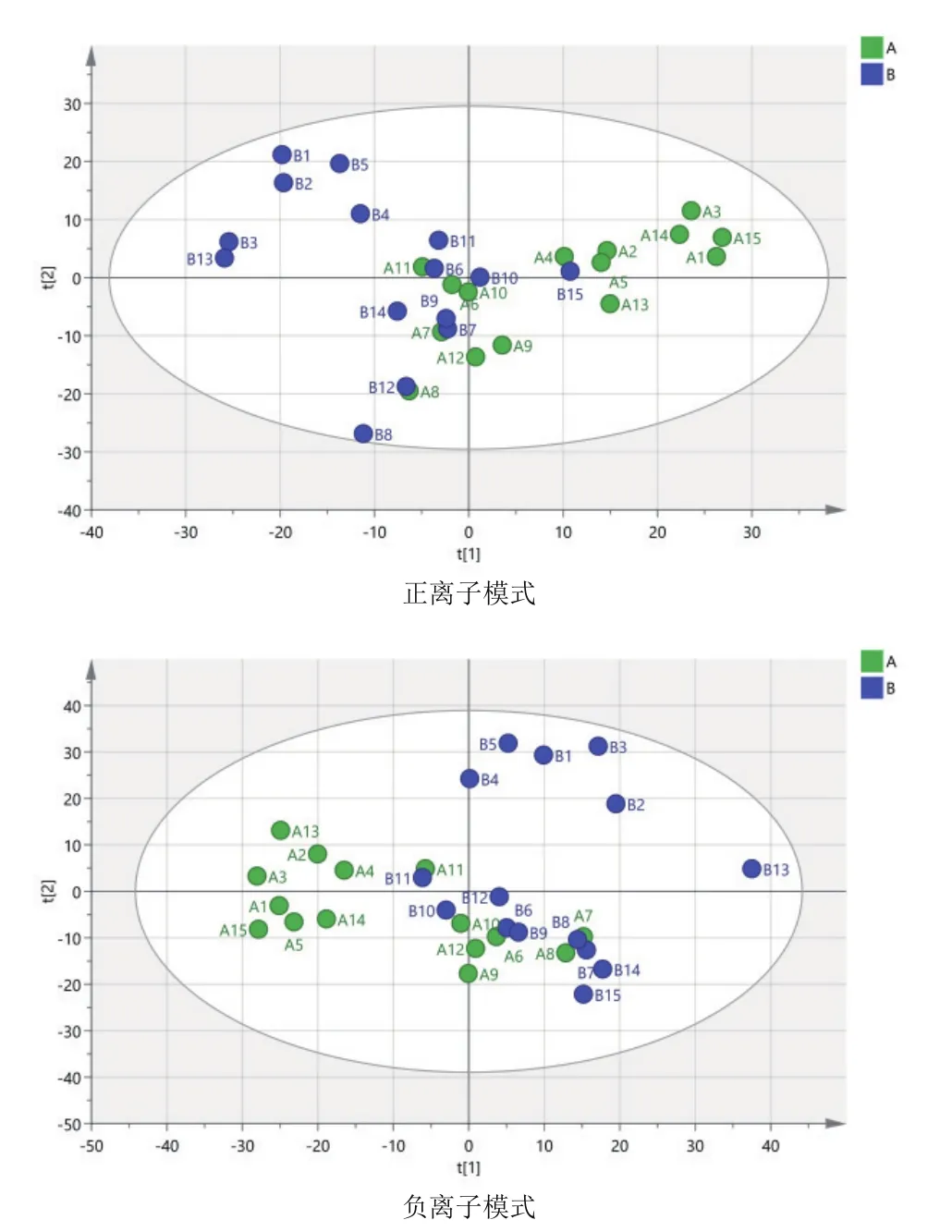
图3 A组和B组两两比较正、负离子模式下PCA图谱
3.2 甘油磷脂代谢
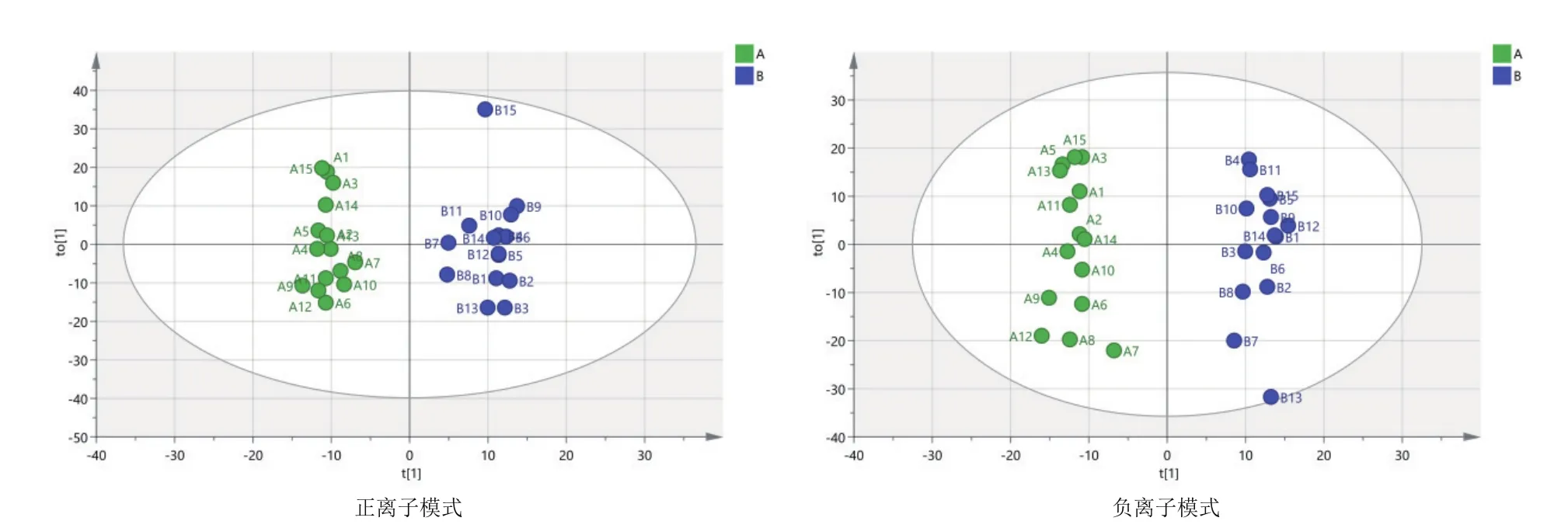
图4 A组和B组两两比较正、负离子模式下OPLS-DA图谱
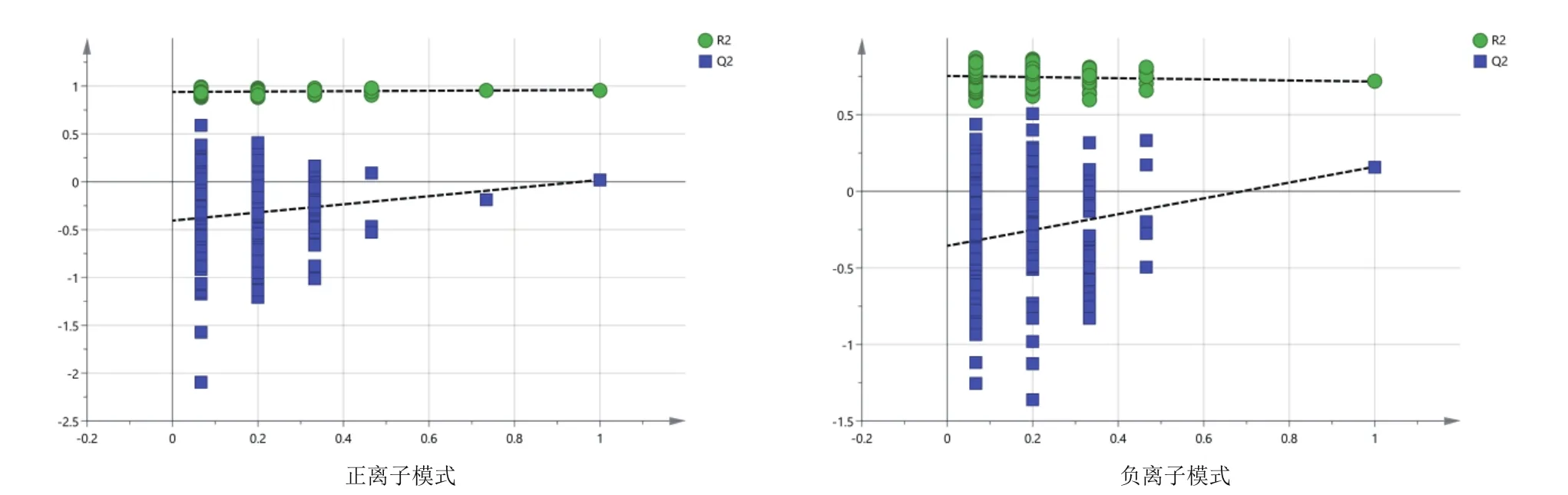
图5 A组和B组正、负离子模式下OPLS-DA模型置换检验图
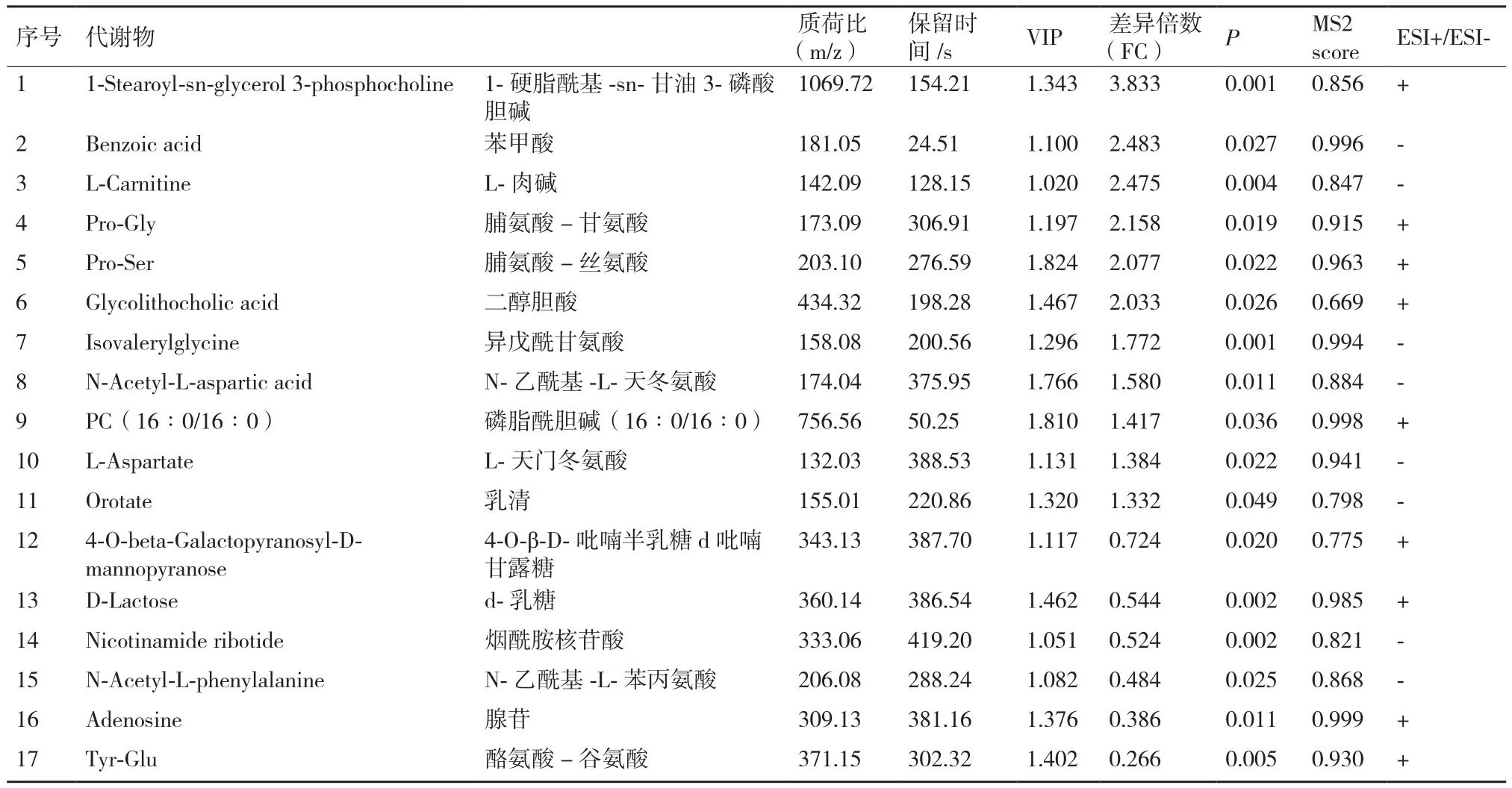
表3 A组和B组正、负离子模式下鉴定的差异代谢物
磷 脂 酰 胆 碱(Phosphatidyl cholines,PC) 是细胞膜的主要磷脂成分和生产脂质第二信使的底物[22],也是肝脏三酰甘油(Triacylglyceride,TAG)分泌所必需的甘油磷脂[23]。PC主要参与甘油磷脂代谢,甘油磷脂是比较复杂的代谢,代谢中主要有PC和磷脂酰乙醇胺(PE)两种甘油磷脂[24]。而PE转化为PC是肝脏特异性的PC合成途径[25]。PC是促进肝脏中极低密度脂蛋白(Very low density lipoprotein,VLDL)转运甘油三酯必需的物质[26]。血液中PC水平的升高会导致奶牛肝脏中VLDL的分泌增加[27]。从妊娠到哺乳期血浆PC减少与产后脂肪肝的发展有关[28]。血浆中PC从泌乳早期到泌乳后期增加了10倍[29]。奶牛血浆中PC的浓度从分娩前2周开始下降,分娩后开始上升到第4周达到高浓度[30]。有研究表明PC可以作为产后奶牛脂肪肝血浆脂质评价生物标志物[31]。本研究从分娩当天到产后第7天血浆PC浓度升高,与前人研究结果一致。说明分娩后PC浓度增加,使得奶牛肝脏中VLDL的分泌增加,增强了TAG从肝脏中转运出来的速度,降低了产后奶牛患脂肪肝的几率,降低了奶牛分娩后负能量平衡的发生机率。

图6 11个显著性差异代谢物的ROC曲线

图7 A组和B组显著性差异代谢物聚类热图
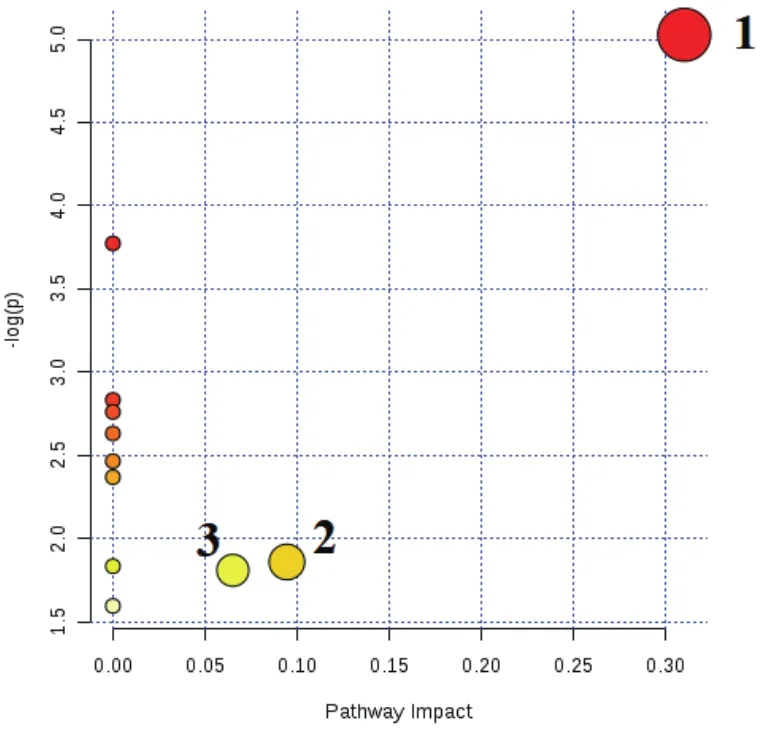
图8 A组和B组差异代谢物的代谢通路分析
3.3 嘧啶代谢
乳清酸(Orotic acid,OA)是核酸碱基的前体,也是嘧啶合成的中间体。OA的多少与奶牛的来源、饮食和泌乳期有关[32]。比较泌乳奶牛和非泌乳奶牛乳腺组织表达时发现,OA是奶牛泌乳关键代谢产物,泌乳组奶牛OA显著高于非泌乳组奶牛[33]。OA的再循环通常可以在肝脏中发生,肝细胞将其吸收并转化为尿苷,用于嘧啶循环途径[34]。嘧啶核苷酸合成的最后一步将OA转化为有活性的尿酶[35]。当肾脏受到严重损害时,尿酶活性较低[36]。本研究产后第7天OA相比分娩当天浓度上调,增加的OA可能是和泌乳密切相关,升高的OA可能在嘧啶代谢中转化为尿酶,从而降低对肾脏损伤,有利于维持奶牛分娩后机体健康。
4 结论
本研究通过分析分娩当天和产后第7天奶牛血浆代谢物,发现产后第7天与分娩当天相比NAA、天冬氨酸、PC和OA上调。这些代谢物变化有利维持奶牛分娩后机体健康。

