好氧反硝化菌Achromobacter sp.L16的脱氮特性
李思琦 杨静丹 刘琳 刘二佳 王晓慧
(1. 北京化工大学化学工程学院,北京 100029;2. 北京航天宏图信息技术股份有限公司,北京 100195)
异养硝化-好氧反硝化(Heterotrophic nitrification-aerobic denitrification,HN-AD)菌是一类能够在有机物存在的条件下将氨氮氧化,在溶解氧存在条件下将亚硝态氮、硝态氮代谢为氮气的微生物[1],不受传统反硝化菌厌氧条件的控制,在单个反应器中同时进行硝化和反硝化,且异养菌与自养菌相比生长速率快,繁殖周期短,节约工艺处理时间及成本,好氧反硝化菌的发现为生物脱氮技术提供了一种新的思路和方法[2]。
长期以来厌养反硝化菌被认为是唯一能够进行反硝化作用的细菌。1980年,Meiberg等[3]在研究HyphomicrobiumX菌对二甲胺的好氧厌氧降解机理过程中发现其具有好氧反硝化能力,1983年Robertson等[4]在硫自养反硝化菌株分离实验中发现了好氧反硝化菌的存在,随后证实泛养硫球菌是一种好氧反硝化菌,打破了传统厌氧反硝化的壁垒。目前从环境中分离出来的好氧反硝化菌主要有假单胞菌属(Pseudomonas)[5-6]、不动杆菌属(Acinetobacter)[7]、芽孢杆菌属(Bacillus)[8-9]、粪产碱菌(Alcaligenes faecalis)[10]、硫杆菌属(Thiobacillus)等[11]。
本研究从河北某垃圾处理厂的垃圾渗滤液中提取出一株好氧反硝化菌L16,对其进行16S rDNA分析鉴定为无色杆菌,填补了垃圾渗滤液中好氧反硝化细菌较少的空缺,系统地研究了碳源、C/N、温度、转速等理化因素对该菌株反硝化和硝化能力的影响,以期为该菌株在渗滤液脱氮处理等应用方面提供参考。
1 材料与方法
1.1 材料
菌源提取自河北某垃圾填埋场的垃圾渗滤液,样品置于采样瓶中4℃保存,用于后续实验。
LB富集培养基(g/L):胰蛋白胨1.0 g,酵母提取物0.5 g,硝酸钾KNO32.0 g。
BTB溴百里酚蓝固体培养基(g/L):KNO31.0 g,琥珀酸钠 8.5 g,KH2PO41.0 g,FeCl2·6H2O 0.05 g,CaCl20.2 g,MgSO4·7H2O 1.0 g,1%的溴百里酚蓝1 mL,琼脂20.0 g。
NI异养硝化培养基(g/L):NH4Cl 1.5 g,琥珀酸钠 11 g,MgSO4·7H2O 0.1 g,Na2HPO4·12H2O 6.7 g,KH2PO41.0 g,微量元素溶液2 mL。
DM好氧反硝化培养基(g/L):KNO33.0 g,琥珀 酸 钠 13 g,KH2PO41.5 g,MgSO4·7H2O 0.1 g,Na2HPO4·12H2O 7.9 g,微量元素溶液2 mL。
微量元素溶液(g/L):EDTA 50.0 g,ZnSO42.2 g,CaCl25.5 g,MnCl2·4H2O 2.06 g,FeSO4·7H2O 5.0 g,(NH4)6Mo7O2·7H2O 1.1 g,CuSO4·5H2O 1.57 g,CoCl2·6H2O 1.61 g。
培养基调节pH为7.0-7.3,在121℃高压蒸汽灭菌20 min。
1.2 方法
1.2.1 菌株筛选 取垃圾渗滤液10 mL按10%(V/V)接种在LB培养基中,30℃,150 r/min条件培养,24 h后取10 mL重新接种至新鲜LB培养基,连续富集培养5次,用格利斯试剂定性检测硝酸盐是否转化为亚硝氮,培养基变红,垃圾渗滤液中的菌群有反硝化活性。
富集菌液按倍比稀释,取10-6和10-7浓度菌液涂布在BTB培养基,30℃恒温培养3 d。反硝化细菌消耗硝酸钾产生碱度,使溴百里酚蓝变蓝,挑取蓝色单菌落在BTB培养基上多次划线培养纯化作为初筛菌株。
挑取初筛纯菌株接种于LB培养基,30℃,150r/min条件下富集24 h,4 000 r/min离心3 min,弃去上清液加入无菌水制备菌悬液。将菌悬液以2%(V/V)接种至DM和NI培养基中培养2 d,复筛出降解硝氮、氨氮能力最强的菌株,命名为L16。富集培养保存在甘油管中,在-20℃冰箱里暂存。所有操作在无菌台上进行,培养基及其他仪器事先灭菌。
1.2.2 菌株鉴定 将菌株L16富集培养制备菌悬液,在BTB培养基划线培养24 h,挑取单菌落通过扫描电子显微镜(JSM-7500F型)观察菌体形态。
将菌株L16富集培养制备菌悬液,在BTB培养基划线培养,通过16S rDNA分析鉴定。过程为:利用DNA提取试剂盒提取,用DNA通用引物进行PCR扩增,上游引物(27F)5'-AGAGTTTGATCCTGGCTCAG-3',下游引物(1429R)5'-GGTTACCTTGTTACGACTT-3',PCR体系:10×Ex Taq缓冲液5.0μL,2.5 mmol/L dNTP 混合物 4.0 μL,10 pmol/L 引物各 1.0 μL,模板 2.0 μL,5 U/μL Taq DNA 聚合酶 0.5 μL,无菌水 36.5 μL,共 50 μL,扩增程序 :95℃预变性5 min,95℃变性30 s,54℃退火30 s,72℃延伸90 s,经过30个循环,72℃延伸10 min,4℃保温。将PCR产物经电泳检测条带单一、大小正确后,经切胶回收克隆后测序。测序结果在EZbiocloud网站上进行同源性比对,构建系统发育树。
1.2.3 菌株异养硝化-好氧反硝化性能研究 将菌株L16富集制备菌悬液以2%(V/V)分别接种至100 mL DM、NI培养基,测定其好氧反硝化和异养硝化能力,控制单一变量,分别在不同碳源(乙酸钠、葡萄糖、甘油、柠檬酸钠和琥珀酸钠),不同碳氮比(0、5、10、15、20和25),不同温度(20、30和37℃),不同转速(50、100、150和200 r/min)下,30℃,150 r/min培养48 h(温度、转速实验除外),每隔12 h检测菌株生长量,每隔6 h检测DM培养基中硝氮、亚硝氮浓度和NI培养基中氨氮浓度,并测量总氮浓度变化。
1.2.4 测定方法 生长量(OD600)采用分光光度法(GB/T 26810-2011),氨氮采用纳氏试剂分光光度法(GB HJ535-2009),硝氮采用麝香草酚法分光光度法(GB HJ/T346-2007),亚硝氮采用N-(1-萘基)-乙二胺光度法(GB 7493-87),总氮采用碱性过硫酸钾消解紫外分光光度法(GB HJ636-2012)。
氨氮去除率:

硝氮、亚硝氮、总氮去除率计算公式同上。
2 结果
2.1 菌株形态特征
L16菌落培养及扫描电镜图如图1,菌落呈圆形,边缘整齐,表面光滑,呈乳白色,透明,菌体大小约1.6 μm×0.18 μm。
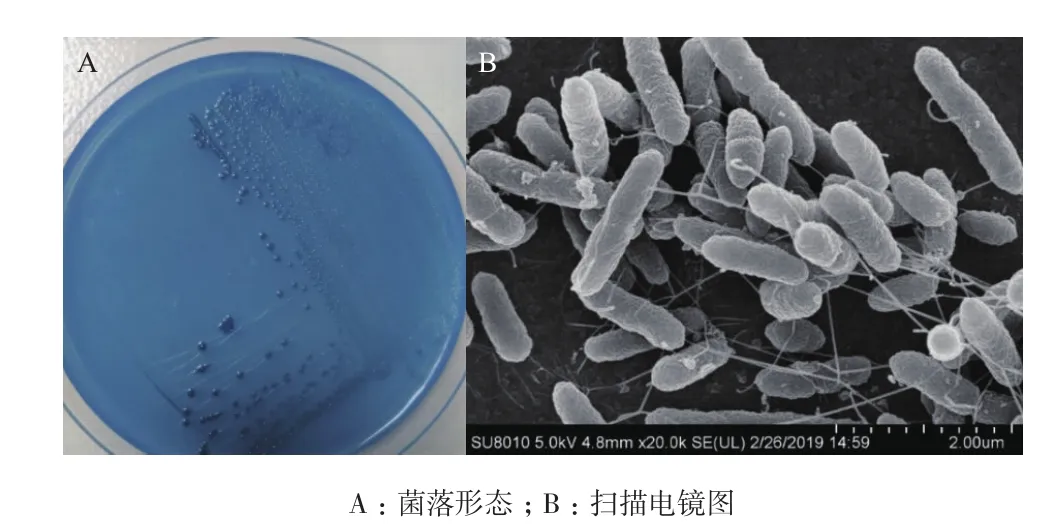
图1 菌株L16的形态特征
2.2 16S rDNA序列及系统发育分析
对菌株L16测序得到1 420 bp长度的16S rDNA基因序列,在EZbiocloud网站上进行同源性比对,菌 株 L16与Achromobacter insuavis、Achromobacter ruhlandii、Achromobacter xylosoxidans、Alcaligenes faecalis、Achromobacter denitrificans及Achromobacter piechaudii相似性均在99%以上,初步确定菌株L16为无色杆菌(Achromobactersp.)通过MEGA 7.0软件,以Neighbor-Joining法构建系统发育树如图2,菌株L16与Achromobacter insuavisLMG26845具有99.7%同源性。目前分离出多种异养硝化-好氧反硝化菌,无色杆菌较少,本研究分离的无色杆菌L16丰富了异养硝化-好氧反硝化细菌的多样性,也表明无色杆菌在脱氮领域具有潜在的应用价值。
2.3 菌株脱氮特性
2.3.1 好氧反硝化特性 菌株L16的生长曲线如图3-A,前12 h浊度由0.030增长到0.072,硝氮由569.2 mg/L降至550.0 mg/L,均无明显变化,此阶段为菌体的适应期。从12-36 h培养基细胞生物量迅速增加,细菌处于对数生长期,硝氮含量降至8.996 mg/L,亚硝氮含量增加到244.5 mg/L,说明菌株L16的好氧反硝化过程是消耗硝氮产生亚氮进而转化为氮气或自身生物量积累,此过程硝氮去除率达98.40%,菌株对硝氮的去除主要发生在对数生长期,反硝化效果性能突出。36 h后培养基各物质含量变化不大,浊度基本稳定,且有减小的趋势,细菌在36 h后处于稳定期并逐渐进入衰减期。
2.3.2 异养硝化特性 菌株L16的生长曲线与DM培养基中相似,前12 h浊度由0.015增至0.018,氨氮由314.6 mg/L降至285.6 mg/L,去除率9.22%,为细菌的适应期。从12 h-36 h培养基浊度迅速增加,氨氮浓度降至110.6 mg/L,去除率61.5%,此时处于对数生长期,此后进入稳定期并逐渐进入衰减期(图3-B)。菌株L16是兼具异养硝化-好氧反硝化能力的菌株,其好氧反硝化能力更强。
2.4 环境因素对菌株L16好氧反硝化性能的影响
2.4.1 碳源对菌株L16好氧反硝化能力的影响 碳源对菌株L16好氧反硝化能力的影响如图4-A,菌株L16以乙酸钠、柠檬酸钠、琥珀酸钠为唯一碳源时,硝氮基本完全去除,去除率分别为99.61%、99.15%和99.74%,总氮去除率分别为28.79%、38.85%和29.00%,培养基初始时总氮包括培养基的硝氮和细菌胞内氮,48 h后硝氮一部分转化为亚硝氮,一部分直接转化为N2排出,其余部分转化为细菌胞内氮,其48 h后总氮含量变化近似于转化为N2部分的氮损失。
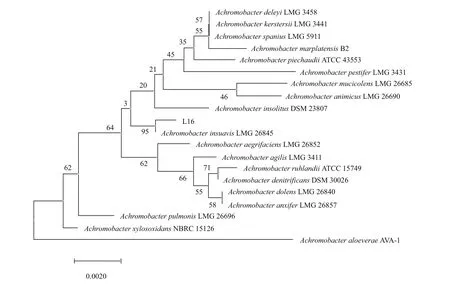
图2 菌株L16系统发育树
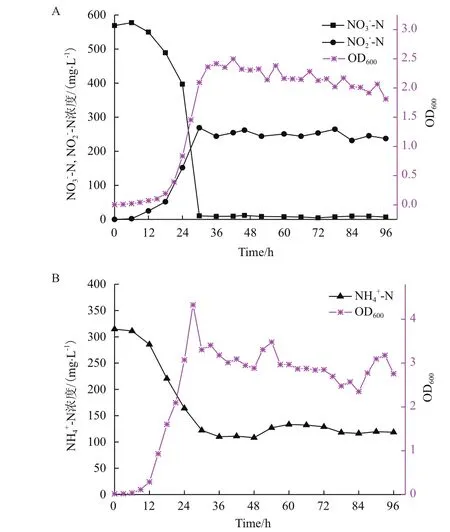
图3 菌株L16异养硝化-好氧反硝化特性
以甘油为唯一碳源时生长效果最好,对硝氮去除率仅10.16%,总氮的去除率6.72%,说明菌株能够利用甘油生长但没有好氧反硝化能力,可能是因为碳源为微生物生长提供所需的能量和好氧反硝化过程中的电子供体,碳源不同,细菌生长速率不同,硝酸盐的还原和中间产物的积累程度也不同,对反硝化速率影响很大。本研究中无色杆菌L16在不同碳源的培养基中脱氮效果由高向低依次为柠檬酸钠、琥珀酸钠、乙酸钠、葡萄糖、甘油,柠檬酸钠培养基中硝氮去除率高,其总氮去除率最高,亚硝氮积累量为296.5 mg/L,剩余部分氮转化为细胞生物量,菌株L16以柠檬酸钠为碳源时好氧反硝化能力最好。
2.4.2 C/N对菌株L16好氧反硝化能力的影响 碳氮比对菌株L16好氧反硝化能力的影响如图4-B,固定DM培养基氮源含量,使用2.4.1中好氧反硝化能力最好的柠檬酸钠为碳源,改变柠檬酸钠含量以改变碳氮比。在碳氮比达到10以上后,对硝氮的去除能力基本稳定,均在97%以上,在碳氮比为20、25时总氮去除率最高分别为58.90%、56.79%,且亚硝氮积累量也相较于碳氮比为15时有所降低。
在碳氮比为15时OD600达3.304,菌株生长最好,亚硝氮在碳氮比为15条件下积累量最高,菌株L16在碳氮比为0、5时基本不生长,说明菌株L16生长过程需要外加碳源,是异养的反硝化菌。碳氮比对菌株生长情况有显著影响,低的反硝化能力可能是碳源不足菌体生长不良导致。本研究中碳氮比为20的培养基中总氮去除率最高,硝氮去除率为97.12%,亚硝氮积累量为231.6 mg/L,在碳氮比为20时L16的反硝化能力最好。
2.4.3 温度对菌株L16好氧反硝化能力的影响 温度对菌株L16好氧反硝化能力的影响如图4-C,在以柠檬酸钠为碳源,碳氮比为20的DM培养基中实验,培养温度为30、37℃的菌株基本将硝态氮降解完全,去除率分别为97.56%、96.97%,30℃下的菌株生长及总氮去除能力都比37℃时要好,可能是高温导致生物核酸或蛋白的变性,细胞功能下降,影响脱氮效果。
菌株在3个培养温度下均能正常生长,30、37℃时OD600达到2.772和2.562,而20℃时为1.512,在20℃生长情况较其他温度稍差,且基本不降解硝态氮,同时也没有亚硝态氮的产生,说明低温对于菌株L16的生长和好氧反硝化有明显的抑制作用,可能是低温抑制了酶活性,影响其脱氮效果。30℃条件下总氮去除率为43.87%,亚硝氮积累223.0mg/L,对菌株L16好氧反硝化能力较好的培养温度应在30℃左右。
2.4.4 溶解氧对菌株L16好氧反硝化能力的影响 溶解氧对菌株L16好氧反硝化能力的影响如图4-D,调整培养箱转速来改变溶解氧浓度,图中表明溶解氧含量越高,细菌生长状况越好,验证了菌株L16为好氧菌。各培养基对于硝态氮的去除趋势一致,且去除效果基本相同,将氮转化为气体的能力与溶解氧含量成正比,最后硝态氮都稳定在10 mg/L以下,去除率分别为97.79%、97.30%、99.83%和98.15%,在培养后期均有降解亚硝酸盐的能力,菌株L16在150 r/min下脱氮效果最好,可能是因为HN-AD 菌株在好氧条件下进行反硝化,但亚硝酸盐还原过程对氧极其敏感,高浓度溶解氧会抑制亚硝酸盐的还原,低浓度溶解氧又抑制异养菌株的生长,过高过低的溶解氧量都会影响菌株的脱氮能力。其中150 r/min转速的培养基积累亚硝态氮含量少,且硝态氮去除能力最强,亚硝氮积累量为245.5 mg/L,总氮去除率48.44%,菌株L16最适的转速在150 r/min左右。
2.5 环境因素对菌株L16异养硝化性能的影响
2.5.1 碳源对菌株L16异养硝化能力的影响 碳源对菌株L16异养硝化能力的影响如图5-A,菌株L16以氨氮为氮源,以柠檬酸钠为碳源时对氨氮和总氮去除率最高,这与前面好氧反硝化性能影响实验一致,可能是由于柠檬酸钠参与细胞三羧酸循环,能够更加有效的被菌体利用。
以葡萄糖为碳源的菌株生长最好,但以甘油和葡萄糖为碳源的菌株去除氨氮的能力较差,以乙酸钠、柠檬酸钠、琥珀酸钠为碳源的培养基中后期氨氮稳定在35 mg/L以下,对氨氮的去除率分别为62.33%、67.90%和62.02%,菌株L16在不同碳源的培养基中脱氮效果由高向低依次为柠檬酸钠、乙酸钠、琥珀酸钠、葡萄糖和甘油,在以柠檬酸钠为碳源的培养基中对氨氮去除率最高,总氮去除率为54.72%,菌株L16以柠檬酸钠为碳源时异养硝化能力最好。
2.5.2 C/N对菌株L16异养硝化能力的影响 C/N对菌株L16异养硝化能力的影响如图5-B,培养基以柠檬酸钠为碳源,随碳氮比的增加,菌株生长情况越好,且对氨氮和总氮去除率也逐渐升高,说明碳氮比能够显著影响菌株的生长情况及其异养硝化能力。
菌株L16在C/N为0、5时基本不生长,氨氮去除能力也低,可能是碳氮比小时碳源不充分,细菌生长受限制,异养硝化能力受影响。48 h后,碳氮比为15、20和25的培养基中氨氮的去除效果分别为95.79%、96.31%和97.51%,在C/N为25时OD600达1.477,菌株生长最好,且总氮去除率也最高为90.58%,考虑到实际应用中高碳氮比投加碳源的成本以及可能造成水体化学需氧量的升高,可以取碳氮比为20作为菌株L16异养硝化能力的碳氮比,其总氮去除率也可达到86.79%。
2.5.3 温度对菌株L16异养硝化能力的影响 温度对菌株L16异养硝化能力的影响如图5-C,取柠檬酸钠为碳源,碳氮比为20,菌株在3个培养温度下均能正常生长,且20℃下生长情况最好,3种温度下氨氮去除率分别为95.56%、97.19%和96.87%,低温对于菌株L16的硝化作用基本没有影响,其异养硝化作用受温度影响小,其中培养温度为30℃时的氨氮去除率最大,总氮去除率最高为78.24%,对菌株L16异养硝化能力较好的培养温度可以在20-37℃左右。
2.5.4 转速对菌株L16异养硝化能力的影响 转速对菌株L16异养硝化能力的影响如图5-D,各培养基对于氨氮去除效果基本相同,去除率分别为90.87%、83.23%、89.87%和93.41%,转速对菌株L16的硝化作用没有太大影响,异养硝化能力最好的是转速200 r/min的培养基,总氮去除率为87.50%;其次是转速为50 r/min的培养基,总氮去除率为86.33%,菌株L16的异养硝化能力对溶解氧的要求不高,菌株L16异养硝化能力较好的转速可以在50-200 r/min左右。
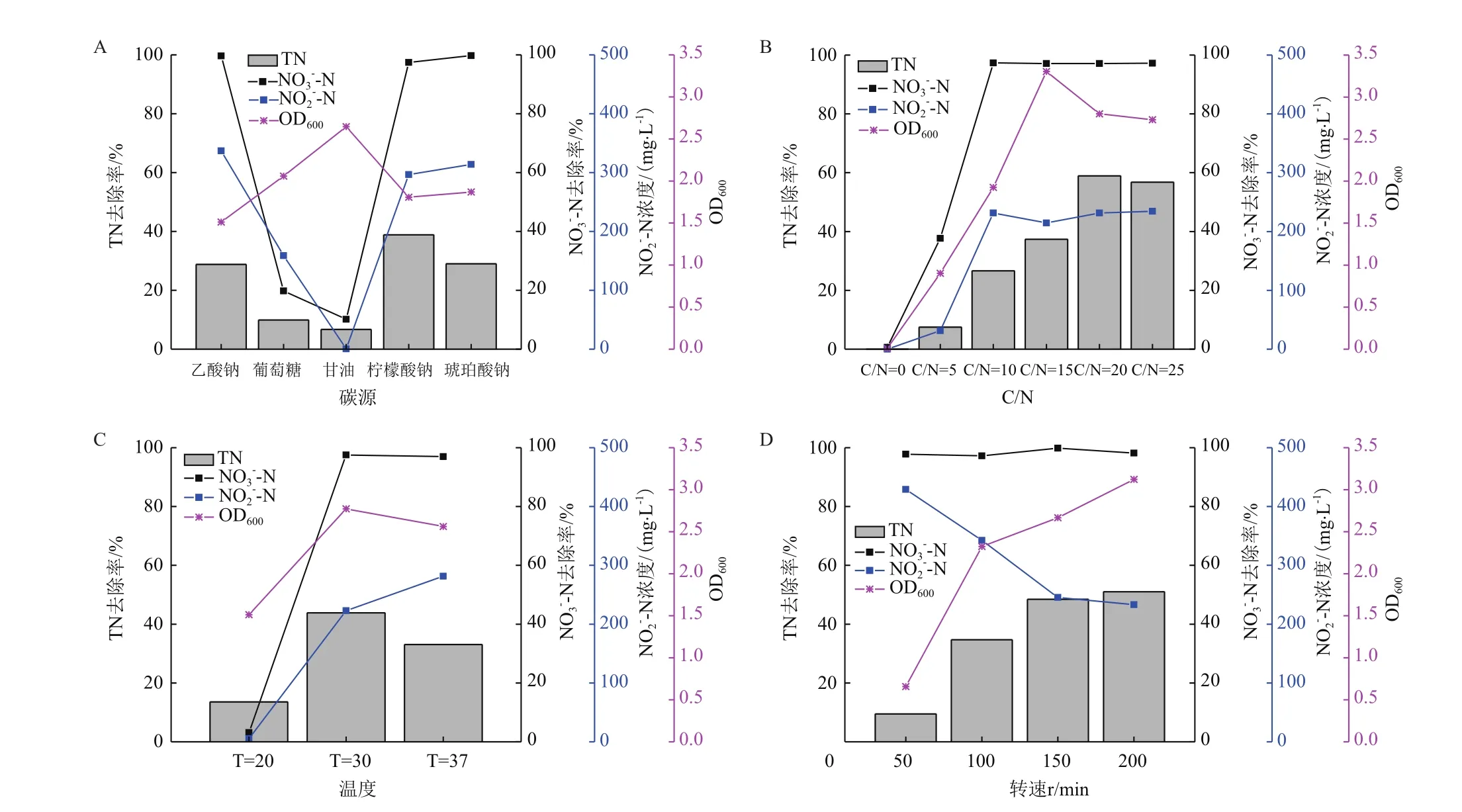
图4 环境因素对菌株L16好氧反硝化能力的影响
2.6 菌株L16好氧反硝化-异养硝化性能的优化
以单因素实验中脱氮能力最强的环境因子作为实验条件,即以硝酸盐为氮源、柠檬酸钠为碳源、C/N为20、培养温度为30℃、培养转速为150 r/min条件下培养48 h,优化环境因素影响后L16对硝酸盐去除率99.74%,总氮去除率为58.90%。
L16在以氨氮为氮源、柠檬酸钠为碳源、C/N为20、培养温度为30℃、培养转速为200 r/min条件下氨氮去除率提高到93.41%,总氮去除率86.33%(图 6)。
3 讨论
在探究环境因素对菌株L16的异养硝化-好氧反硝化性能的影响实验中,L16在碳源为柠檬酸钠的培养基中脱氮效果最好,这与Enterobacter asburiaeYT[12]和Acinetobactersp. T1[13]结果一致,其他研究也有以丁二酸钠[14]、琥珀酸钠[15]、葡萄糖[16]为唯一碳源时效果最好,说明碳源为微生物生长提供所需的能量和好氧反硝化过程中的电子供体,对微生物的生长和脱氮能力影响很大。L16在碳氮比为20的培养基中脱氮效果最好,低于田雪雪等[17]分离的醋酸钙不动杆菌N7,与克雷伯氏菌y5[1]和y6[18]结果相似,目前有些研究中分离在低碳氮比(5-10)下进行好氧反硝化的菌株[19-24],有效解决生物法处理低C/N比废水存在碳源不足、脱氮效率不高的问题。L16在 30℃下培养脱氮效果最好,在大部分好氧反硝化菌生长最适温度范围内[8,25-29],也有学者在从低温环境下提取出嗜冷菌株[30-34],能耐10-15℃低温。L16异养硝化-好氧反硝化最适转速分别在200 r/min和150 r/min左右,与假单胞菌 WUST-7[6]和发光细菌 NNA4[35]结果相似,转速对细菌脱氮能力的影响可能是由于亚硝酸盐还原过程对氧敏感,高浓度溶解氧会抑制亚硝酸盐的还原,低浓度溶解氧又抑制异养菌株的生长,过高过低的溶解氧量都会影响菌株的脱氮能力[10]。以最佳环境因子作为培养条件优化L16的脱氮能力,硝酸盐氮去除率99.74%,氨氮去除率提高到93.41%,说明环境因素显著影响L16的异养硝化-好氧反硝化能力。
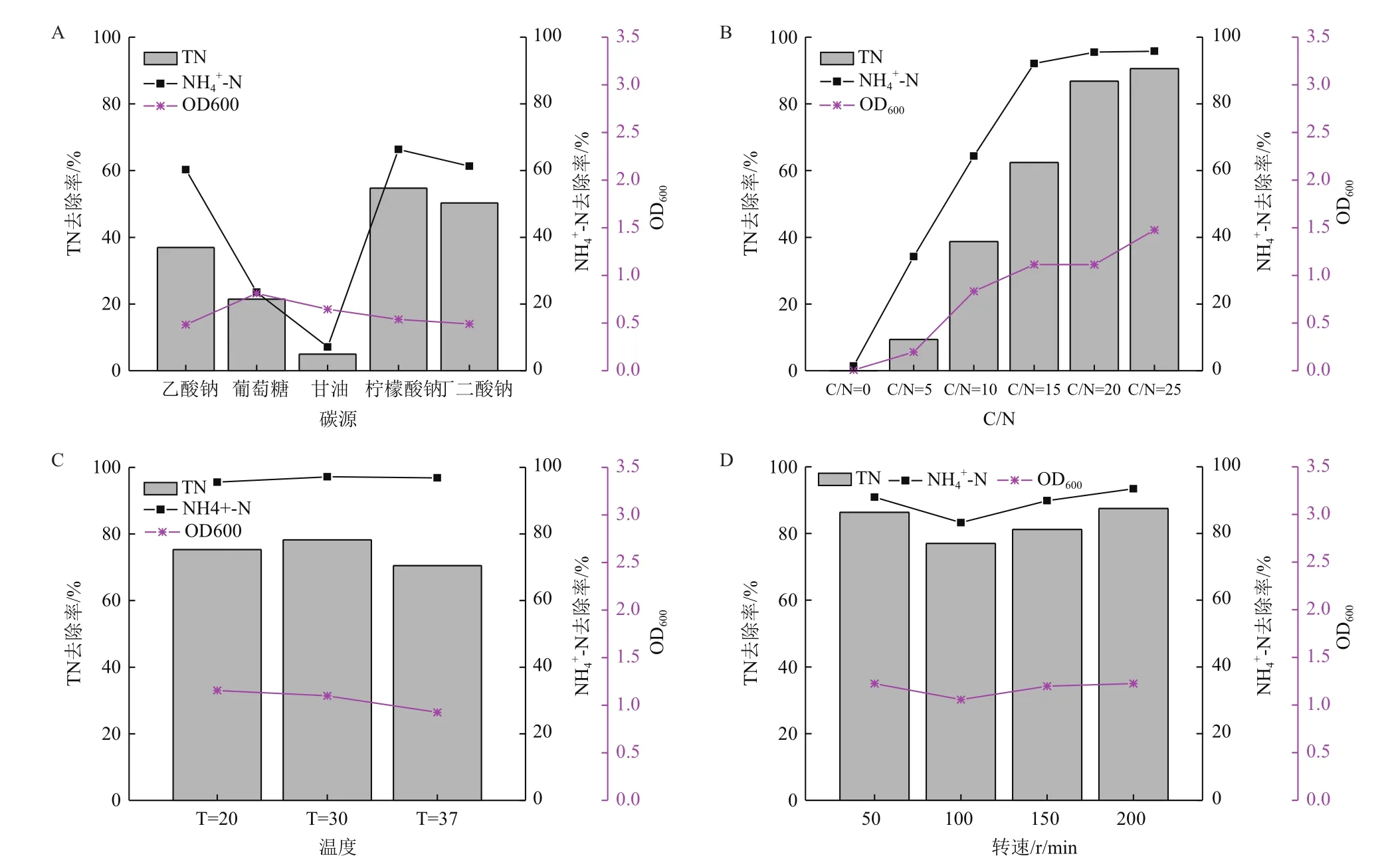
图5 环境因素对菌株L16异养硝化能力的影响
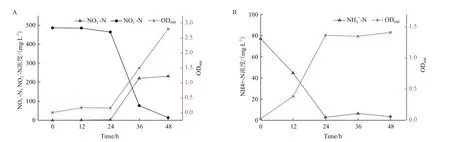
图6 菌株L16好氧反硝化-异养硝化性能的优化
4 结论
(1)从垃圾渗滤液中提取出一株HN-AD菌,对其进行16S rDNA同源性分析,结果为无色杆菌(Achromobacter insuavisLMG26845)。对其好氧反硝化下硝氮去除率达98.4%,同时具有异养硝化能力,异养硝化的氨氮去除率为61.5%。
(2)对菌株L16的好氧反硝化能力进行影响因素分析,在以乙酸钠、柠檬酸钠、琥珀酸钠为碳源,C/N为15-5,培养温度为30-37℃,培养转速为100 r/min-200 r/min,其中以柠檬酸钠为碳源,C/N为20,培养温度为30℃,培养转速为200 r/min时的脱氮能力最强。
(3)对菌株L16的异养硝化能力进行影响因素分析,在以乙酸钠、柠檬酸钠和琥珀酸钠为碳源,C/N为15-25,培养温度为20-37℃,培养转速为50 r/min-200 r/min,其中以柠檬酸钠为碳源,C/N为25,培养温度为30℃,培养转速为200 r/min时的脱氮能力最强。
(4)对菌株L16异养硝化-好氧反硝化能力优化,在脱氮能力最佳的环境因素下,L16的好氧反硝化硝酸盐氮去除率为99.74%,总氮去除率58.90%。L16异养硝化的氨氮去除率提高到93.41%,总氮去除率86.33%。

