长足大竹象幼虫肠道纤维素酶活性研究
何慧,叶垚君,杨瑶君,付春
乐山师范学院生命科学学院,竹类病虫防控与资源开发四川省重点实验室,乐山 614000
长足大竹象(Cyrtotrachelus buqueti),属鞘翅目象甲科,主要分布于四川、重庆、贵州、广东以及广西等省区。长足大竹象寄主广泛,危害水竹(Phyllostachys heteroclada)、青皮竹(Bambusa textilis)、崖州竹(Bambusa textilisvar. gracilis)、慈 竹 (Neosinocalamus affinis) 、 绿 竹(Dendrocalamopsis oldhami) 、 撑 绿 杂 交 竹(Bambusa pervaria-bilis×Dendrocalamopsis daii)等约28 种竹种的竹笋。
在世界范围内,每年大约会有1010~2×1011t 植物有机物质被生产,其中将近一半都为纤维素[1],同时纤维素作为饮食中的一种重要的膳食纤维,是自然界最丰富的可再生资源之一。纤维素作为最难降解成葡萄糖的碳水化合物,在其利用过程中常常没有得到充分的利用,从而造成了大量资源浪费,因此纤维素如何高效地利用和转化对于解决当前世界能源匮乏、粮食稀缺以及环境污染等问题具有不可或缺的意义[2]。随着现代生物技术的发展,纤维素酶由于具有降解速度高、降解底物环保的优点而被广泛利用,特别是昆虫内源纤维素酶在工业生产与能源领域等方面得到广泛关注与应用[3-4]。
大多数昆虫体内都有纤维素酶,可以消化他们所摄取的食物中的纤维素,从而提供昆虫正常生长所需的物质和能量。昆虫纤维素酶首先在白蚁和蟑螂的肠道中发现[5-6],然后在细菌(如大肠杆菌)、放线菌(如马都拉放线菌)、真菌(如木霉属的绿色木霉与青霉属的灰绿青霉)和其他昆虫(如属鳞翅目昆虫的蝗虫)以及其他动物(如白蚁和蜗牛)都检测到纤维素酶[7-8]。刘洁丽,王靖[9]中研究发现:除了昆虫肠道内所含有的共生微生物能够产生纤维素酶以外,某些特殊的昆虫体内还存在内源性的纤维素酶。
昆虫内源性纤维素酶研究以鞘翅目昆虫最为广泛,李燕利[6]等研究了12 种甲虫体内的纤维素酶活性,研究发现除了栗山天牛体内检测不到内切-β-1,4-葡聚糖苷酶活性,其余实验组甲虫体内均能检测到完整的纤维素酶。徐丽霞[10]等研究了黑胸散白蚁、黄翅大白蚁、象白蚁和锯白蚁4 种白蚁及其肠道不同组织部位的内切-β-1,4-葡聚糖酶(EG)、β-葡萄糖苷酶(BG)和外切-β-1,4 葡聚糖酶(CBH)3 种纤维素酶活性,并研究了白蚁肠道不同组织部位的内切-β-1,4-葡聚糖酶(EG)的分布及多样性。研究表明,在这研究的4 种白蚁中,EG 酶的比活力均高于BG 酶和CBH 酶。刘新博[11]、段旭[12]等研究了竹虫体内纤维素酶系活性,研究发现竹虫体内存在完整的纤维素酶系,并对3 种酶活性大小进行了研究为,β-葡萄糖苷酶的底物羧甲基纤维素钠的降解活性>外切-β-1,4-葡聚糖苷酶的底物微晶纤维素的降解活性>内切-β-1,4-葡聚糖苷酶的底物水杨素的降解活性,CB 的最适pH 为7.0,实验组还设置了对底物的不同反应时间和纤维素酶系的分离,结果显示,CB 的最适pH 值为7.0,温度为70 ℃,反应时间为60 min;CMC 的最适pH 值为9.4,温度为30 ℃,反应时间为40 min;SA 的最适pH 值为8.2,温度为50 ℃,反应时间为20 min。该研究为接下来研究长足大竹象肠道酶活性质提供了研究方法和可靠地实验数据。刘超、万东海[13]等研究了长足大竹象幼虫体内消化酶活性,并比较出了其体内消化酶活性大小为:半纤维素酶 >果胶酶 >纤维素酶,但对于体内纤维素酶系的活性没有做进一步研究。尽管各类鞘翅目昆虫体内纤维素酶活性研究较多,但尚未有长足大竹象幼虫体内纤维素酶活性的比较,本研究选取了长足大竹象幼虫肠道的纤维素酶来作为研究对象,对不同的温度及pH 值条件下对纤维素酶活性影响进行比较研究,筛选出纤维素酶酶活的最佳条件,为开发高效纤维素酶系提供了数据参考。
1 材料与方法
1.1 虫体来源
长足大竹象幼虫均采于四川省乐山市沐川县大楠镇(N28°58′5.06″,E104°0′6.93″)。
1.2 试剂来源
水杨素(Salicin)试剂、羧甲基纤维素(CMC)试剂购买于Sigma 公司,微晶纤维素(MCC)试剂购买于Fluka 公司,其余试剂没有特别说明均为国产分析纯。
1.3 初酶液的制备
选取体型大小,生长状况大体相同的长足大竹象幼虫5 只,在冰浴条件下解剖,完整取出其肠道,再根据鞘翅目昆虫肠道分段要点,用解剖针将肠道分成前、中、后肠,分别放在含有0.02 mol·L-1pH 值7.5 的柠檬酸缓冲液的研钵中充分匀浆,然后在温度为5 ℃、转速为10 000 r·min-1的离心机上离心20 min,离心管上层的上清液即为长足大竹象幼虫各段肠道的原酶液。分别各取3 mL 的5 只幼虫虫体的3 段肠道的原酶液与只含相同浓度的柠檬酸缓冲液放入5 mL 的离心管中进行对应编号。分装好之后放入到-75 ℃的冰箱中保存。
1.4 稀释酶液的蛋白含量
采用Bradford 法[12]测定蛋白质的含量。配制1 mg·mL-1的标准蛋白溶液。
取11 支试管,分别用移液管加入浓度为1 mg·mL-1的 标 准 蛋 白 溶 液0.00、0.02、0.04、0.06、0.08、0.10、0.30、0.50、0.70、0.90 和1.00 mL,用蒸馏水定容到1 mL,再分别用移液管移取加入2.4 mL 考马斯亮蓝试剂,试管用匀微型旋涡混凝器混匀。最后在酶标仪595.0 nm 处测定这11 支试管的OD 值,构建出蛋白质标准曲线。
用移液枪分别移取肠道前、中、后3 段的供试酶液0.05 mL,以及蒸馏水0.05 mL,再分别用移液管移取加入2.4 mL 考马斯亮蓝试剂,用匀微型旋涡混凝器混匀之后在酶标仪595.0 nm 下测定3 段肠道的OD 值,每个样品设置3 个重复组,根据上述绘制出的蛋白质标准曲线计算出稀释后酶液当中的蛋白质含量。
1.5 葡萄糖标准曲线的绘制
首先配置1 mg·mL-1的葡萄糖标准溶液。
选取8 支相同刻度试管,编号为1~8,其中编号为1 的试管为空白对照组。依次向这8 支试管当中加入浓度为1 mg·mL-1的葡萄糖标准溶液0.00、0.02、0.04、0.06、0.08、0.10、0.12 和0.14 mL,分别用蒸馏水定容至1 mL,再分别加入1.5 mLDNS 显色剂,摇匀后将其置于沸水浴中加热5 min。加热完成后用水冷却摇匀,在酶标仪540.0 nm 处测定8 支管的OD 值。以这8 支试管当中的葡萄糖的浓度来作为横坐标,酶标仪所测量出的OD 值为纵坐标,从而绘制出葡萄糖标准曲线。
1.6 纤维素酶活性的测定
从温度、pH 值两个外界因素出发,探究5 个不同温度(分别为30、40、50、60、70℃)和7 个不同pH 值(分别为3、4、5、6、7、8、9)的35 个不同的外界因素组合条件下长足大竹象幼虫肠道前、中、后段的内切β-1,4-葡聚糖酶(Cx 酶)、外切β-1,4-葡聚糖酶(C1 酶)和β-葡萄糖苷酶的活性,并从以下3 个方面进行比较:1)同肠段内3 种纤维素酶活性的比较;2)不同肠段内同种酶之间活性比较;3)幼虫不同生长段的不同酶活性比较。
在测定Cx 酶的活性时以浓度为2%的羧甲基纤维素作为底物,在测定β-葡萄糖苷酶活性时以浓度为1%的水杨素作为底物,在测定外切β-1-4-葡聚糖酶活性时以浓度为1%的微晶纤维素作为底物[13]。底物在进行酶促反应之前还需要分别用0.2 mol·L-1pH 值为3、4、5、6、7、8 的磷酸二氢钠-柠檬酸缓冲液和0.2 mol·L-1pH 值=9 的甘氨酸-氢氧化钠缓冲液来创造实验中不同的酸碱度环境。
分别将0.1 ml 长足大竹象幼虫3 段肠道(即前、中和后)的稀释酶液与上述3 种底物0.3 mL 混合。分别在30、40、50、60、70 ℃水中浸泡2 h后,再向装有肠段稀释酶液的试管当中加入DNS 显色剂2 mL。在沸水中显色5 min 后,将试管置于流动水中冷却,最后在酶标仪的540 nm 处测定OD 值,每支试管的酶液测定设置3 个重复组,计算时取平均值,同时理应设置空白对照。以试验条件下酶液蛋白含量(mg)在单位时间(min)内酶促反应产生的还原糖(葡萄糖)量(μmol)计算酶活性,即μmol·min-1·mg-1。
1.7 数据分析
采用DPSS22.0 软件对所测数据进行方差分析和多重比较[14]。
2 结果与分析
2.1 长足大竹象幼虫前肠内3 种纤维素酶活性与pH 值和温度的关系
试验表明,温度和pH 值对3 种酶的活性均有显著影响(见图1-图3),β-葡萄糖苷酶的最佳温度范围为30~60 ℃,最佳pH 值为4~6,最高酶活性为0.0255 μmol·min-1·mg-1( pH 值=6,40 ℃) ,当pH 值较低(pH 值<4)、温度高于40 ℃时,β-葡萄糖苷酶活性呈上升趋势;而当pH 值较低(pH 值>7)、酶活性随温度的升高呈现下降趋势直至无活性。在前肠中,当β-葡萄糖苷酶在60 ℃时,活性是随着pH 值的增加而减小直至无活性状态,即碱性状态时,酶活性更易受到影响;Cx 酶的最适温度范围在30~60 ℃,最适pH 值在5~8 之间,最高酶活性为-0.0342 μmol·min-1·mg-1,在较酸或者较碱条件下,该酶活性较低,如在pH 值为3 温度为30 ℃时,该酶无活性;C1 酶的最适温度为30~60 ℃,最适pH 值为5~8,最高酶活性为0.0342 μmol·min-1·mg-1,在超出最适温度和最适pH 值后,酶活性均较低或失落(见图1)。

图1 长足大竹象幼虫前肠纤维素酶活性Fig.1 Cellulase activity in the foregut of Cyrtotrachelus bugueti larvae
2.2 长足大竹象幼虫中肠内3 种纤维素酶活性与pH 值和温度的关系
在长足大竹象幼虫中肠中,β-葡萄糖苷酶、Cx酶和C1 酶都受温度和pH 值的较大影响,3 种酶都只能在最适温度和最适pH 值条件下表现出相对较高的活性,其他不适条件活性较低或无活性(见图3)。在试验条件下,β-葡萄糖苷酶的最适温度为30~70 ℃,最适pH 值为4~9,β-葡萄糖苷酶最高酶活0.0262 μmol·min-1·mg-1,在温度较高或较低,酸碱度较酸或较碱条件下活性均低甚至无活性;Cx 酶最适温度为30~60 ℃,最适pH 值为5~8,Cx 酶最高酶活为0.0258 μmol·min-1·mg-1,在超出最适温度和最适pH值外活性较低;C1 酶的最适温度为30~70 ℃,最适pH值为4~8,C1 酶最高酶活为0.0343 μmol·min-1·mg-1,在温度较高或较低,酸碱度较酸或较碱条件下活性均较低。酶间比较发现,在相同条件下,C1 酶活性最高,且它的温度范围和pH 值范围较大。

图2 长足大竹象幼虫中肠纤维素酶活性Fig.2 Cellulase activity in the midgut of Cyrtotrachelus bugueti Larvae

图3 长足大竹象幼虫后肠纤维素酶活性Fig.3 Cellulase activity in the hindgut of Cyrtotrachelus bugueti Larvae
2.3 长足大竹象幼虫后肠内3 种纤维素酶活性与pH 值和温度的关系
在长足大竹象后肠中,3 种纤维素酶酶活性均受温度和pH 值的影响较大,3 种酶都只能在最适温度和最适pH 值条件下表现出相对较高的活性,其他不适条件活性较低或无活性。在试验条件下,β-葡萄糖苷酶的最适温度为30~70 ℃,最适pH 值为4~8,β-葡 萄 糖 苷 酶 的 最 高 活 性 为0.0274 μmol·min-1·mg-1,在温度较高或较低,酸碱度较酸或较碱条件下活性均低甚至无活性;Cx 酶的最适温度为30-70 ℃,最 适pH 值 为3~8,Cx 的 最 高 酶 活 性 表 现 为0.0279 μmol·min-1·mg-1,在超出最适温度和最适pH 值外活性较低;C1 酶的最适温度为30~70 ℃,最适pH 值为3~9,C1 酶最高酶活性为0.0365 μmol·min-1·mg-1,在温度较高或较低,酸碱度较酸或较碱条件下活性均较低(见图3)。
2.4 长足大竹象成虫肠道各段内(前、中、后)β-葡萄糖苷酶活性的比较
β-葡萄糖苷酶在前肠中的最高酶活性为0.0255 μmol·min-1·mg-1(pH 值=6,40 ℃),pH 值值3、7、8、9 时,该酶均无活性;β-葡萄糖苷酶在中肠中的最高酶活性为0.0249 μmol·min-1·mg-1(pH值=6,40 ℃),pH 值在3、8、9 时,该酶存在无活性状态;β-葡萄糖苷酶在后肠中的最高酶活性为0.0273 μmol·min-1·mg-1(pH 值=8,60 ℃)。β-葡萄糖苷酶活性在肠道各段内的大小依次是后肠>前肠>中肠(图4)。
2.5 长足大竹象幼虫肠道各段内(前、中、后)Cx 酶活性的比较
Cx 酶在长足大竹象成虫的前肠中的最高酶活性为 0.0249 mol·min-1·mg-1( pH 值=5,60 ℃) ,pH 值3、8、9 时,Cx 酶活性较低,pH 值7 开始,酶活性逐渐降低且降低趋势显著,推测这是Cx 酶适生pH 值临界点;Cx 酶在长足大竹象成虫的中肠当中 的 最 适 酶 活 性 为0.0258 μmol·min-1·mg-1(pH值=3,60 ℃)。在中肠中,当pH 值在3、9 时,在30~70 ℃的温度范围内都存在Cx 酶的无活性状态;Cx 酶在长足大竹象成虫的后肠当中的最适酶活性为0.027 μmol·min-1·mg-1(pH 值=5,70 ℃)。在后肠中,当pH 值为3、8、9 时,在30~70 ℃的温度范围内β-葡萄糖苷酶无活性。Cx 酶在长足大竹象成虫肠道各段内的酶活性大小依次是中肠>前肠>后肠(见图5)。
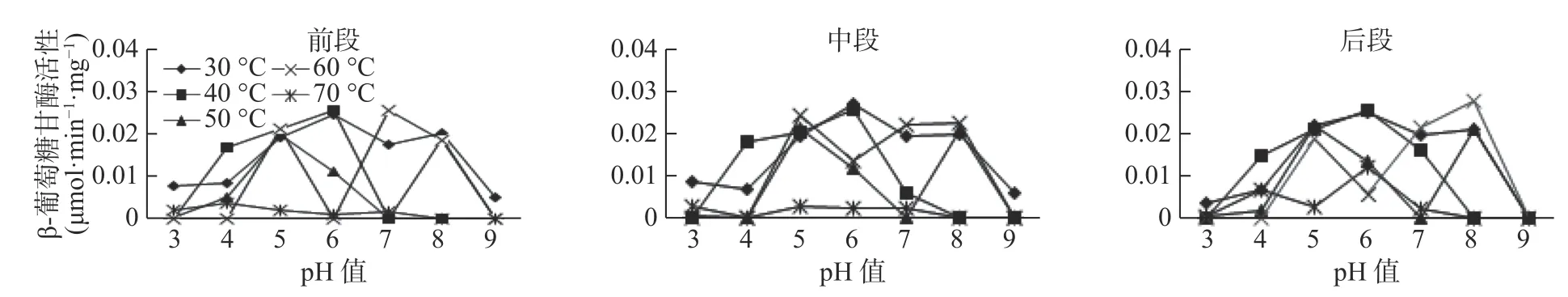
图4 长足大竹象幼虫肠道3 段中β-葡萄糖苷酶活性比较Fig.4 Comparison of β-enzyme activity in three intestinal segments of Cyrtotrachelus bugueti larvae

图5 长足大竹象幼虫肠道3 段中CX 酶活性比较Fig.5 Comparison of CX enzyme activity in three intestinal segments of Cyrtotrachelus bugueti larvae
2.6 长足大竹象幼虫肠道各段内(前、中、后)C1 酶活性的比较
前肠C1 酶最高酶活性为0.0342 mol·min-1·mg-1( pH 值=7,60 ℃) ,pH 值3、 4、 9,温 度30-70 ℃均无活性;中肠C1 酶最高酶活性为0.034 μmol·min-1·mg-1(pH 值=7,60 ℃)。pH 值3、4、8、9,温度30-70 ℃均无活性;后肠C1 酶最 高 酶 活 性 为0.0365 μmol·min-1·mg-1(pH 值=7,60 ℃),pH 值3、4、7、8、9,温度30-70 ℃均无活性。C1 酶在长足大竹象成虫肠道各段内的酶活性大小依次是后肠>中肠>前肠(见图6)。
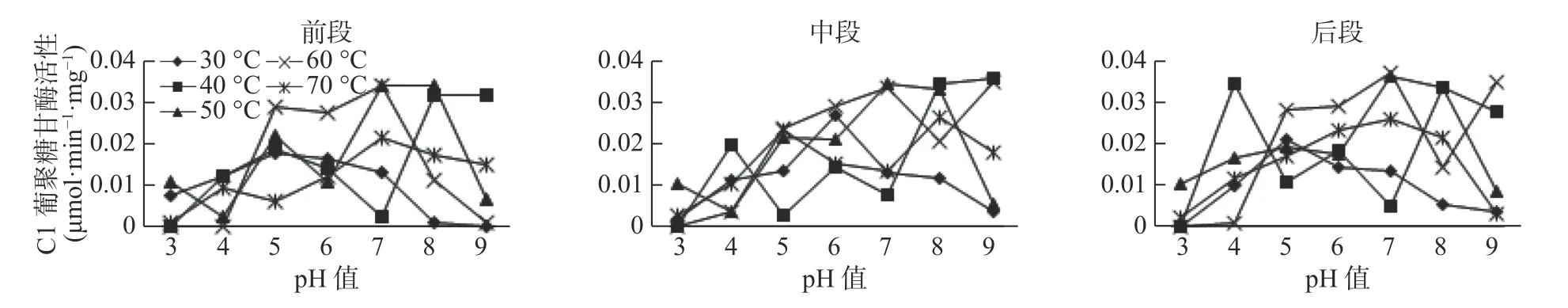
图6 长足大竹象幼虫肠道3 段中C1 酶活性比较Fig.6 Comparison of C1 enzyme activity in three intestinal segments of Cyrtotrachelus bugueti larvae
3 讨论
刘新博[11],段旭[12],刘超[13]等人都研究了竹虫体内纤维素酶系活性,均发现竹虫体内存在完整的纤维素酶系,并比较出3 种纤维素酶的活性大小,这都为接下来研究长足大竹象肠道酶活性质提供了研究方法和可靠地实验数据。测定纤维素酶活性的方法有很多种,但最主要且运用最广泛的是DNS 显色法,同时李燕利,刘新博等人也都运用该技术作为探究纤维素酶的主要手段,这直接作为本研究大足象幼虫肠道纤维素酶活性的技术选择。本研究利用该技术研究了长足大竹象幼虫不同肠道段的纤维素酶活性,结果表明,长足大竹象肠道(分前肠、中肠和后肠)中均有完整的纤维素酶系,它们的酶活性大小为后段>中段>前段,但各肠道段中的纤维素酶活性基本相同,差异不显著。通过设置pH 值3,4,5,6,7,8,9 等7 个梯度和温度为30 ℃,40 ℃,50 ℃,60 ℃,70 ℃等5 个温度梯度对3 种纤维素酶在长足大竹象幼虫不同段肠道的酶活性的探究得出,长足大竹象幼虫不同段中3 种纤维素酶活性在最适条件下酶的活性大小变化不大,差异不显著;3 种纤维素酶活性主要受温度和pH 值的影响,在最适温度为40~70 ℃具有相对较高的活性,在最适pH 值为4~7 也具有较高活性,在高温和低温以及过酸和过碱条件下,检测到纤维素酶较低,β-葡萄糖苷酶在pH 值>7 下,酶活基本不能检测到。
对长足大竹象幼虫肠道不同组织部位的纤维素酶活测定结果表明,不同组织部位和不同纤维素酶比活力均有可能有较大差异,这种同种组织不同酶比活力的差异可能与肠道内酶分解纤维素所起的作用不同有关[15],不同组织之间同种酶比活力的差异可能与竹象虫组织的生理状态不同有关,为进一步研究竹象虫生活习性奠定基础。竹象虫对于纤维素的需求主要是在幼虫阶段,幼虫蛀食竹笋、嫩笋,导致竹笋枯死,嫩笋无法生长,利用这一差异,可针对幼虫纤维素酶分布特点以及酶比活力的不同,研究开发竹象虫幼虫防治药物,减少幼虫对竹笋的伤害,为竹林防害提供相关依据[16-17]。竹象虫肠道具有独特理化环境,是消化纤维素的天然工厂,其肠道是共生微生物的生长繁殖提的理想场所[18],本文通过对长足大竹象幼虫肠道不同组织部位纤维素酶活性的初步研究,揭示了长足大竹象幼虫体内3 种纤维素酶的活性及分布等特征,为进一步阐明不同长足大竹象降解纤维素的机制和研究竹象虫对富含纤维素植物等生物质能的合理利用和开发奠定基础,为开发利用长足大竹象内源的纤维素酶作为新型的生物质能源产业奠定了一定的科学基础[19-20]。
长足大竹象对纤维素的降解是一个复杂的需要多种酶参与的过程,同时也不排除长足大竹象肠道内是否有内源纤维素酶的作用。对于竹象虫肠道内纤维素酶活性的最适反应时间、pH 值、温度还未精确,同时本文采用的测定方法是制备初酶液的,未将纤维素酶提取出来,对于如何高效提取肠道内纤维素酶的方法还有待研究。

