长足大竹象成虫各段肠道纤维素酶活性比较
汤小娟,杨瑶君,罗朝兵,龙文聪,付春
乐山师范学院生命科学学院,竹类病虫防控与资源开发四川省重点实验室,四川 乐山 614000
地球上每年通过光合作用合成的纤维素约1 000亿吨[1]。纤维素是地球上分布最广、最丰富的可再生生物资源,纤维素的利用和转化对于解决目前世界能源危机、粮食短缺、环境污染等问题具有十分重要的意义[2]。利用纤维素酶对纤维素进行降解利用是最为有效的方法。近年来,昆虫纤维素酶在工业生产和能源领域的潜在利用价值备受关注[3-4]。
一些昆虫能够利用纤维素酶消化食物中的纤维素,以获得生长发育所需的营养。昆虫体内共生微生物分泌的纤维素酶最早发现于白蚁和蜚蠊肠内[5-6],此后在细菌、放线菌、真菌等微生物和其他昆虫等动物(如白蚁、蜗牛)体内也检测到了纤维素酶的存在[7-8]。研究表明:除了昆虫肠内共生微生物产生纤维素酶以外,一些昆虫体内还存在内源的纤维素酶,目前对鞘翅目昆虫纤维素酶的研究还是较为广泛,但缺乏同种条件下对鞘翅目昆虫肠道内不同段内纤维素酶活性的综合比较,因此本研究通过研究长足大竹象成虫各段肠道内纤维素酶在不同pH 值和温度条件下的酶活性变化规律,为进一步寻找和开发高效纤维素酶系提供了基础理论指导。
长足大竹象成虫是鞘翅目象甲科昆虫,国内主要分布于四川、广东、重庆、广西、贵州等省区。长足大竹象在2003年被我国林业局列入危害我国林业有害生物名单,其寄主广泛,危害大约28 种竹种的竹笋,危害率高达50%~80%[9]。竹子作为我国林业上的常见物种,其作用也不可小觑,尤其是在食用、医药、建筑、经济等方面。但在林业上对竹子的使用常常出现严重浪费,不能物尽其用。更有甚者还会造成环境污染。而在长足大竹象成虫等甲虫体内发现的纤维素酶刚好可以降解竹子最主要的竹纤维,使不能被直接使用的竹纤维转化为单糖,继而制取酒精、食品、单细胞蛋白及其他化学化工原料[10]。现如今我国以原生态、无污染为根本出发点来发展农业与经济,与以往常见的物理、化学转化对竹纤维进行处理上利用纤维素酶对竹纤维的生物转化不仅不会浪费资源,还会保护环境。本实验利用长足大竹象成虫这种害虫体内的纤维素酶进行体外探究最适条件使得体外高效降解竹纤维甚至模拟昆虫体内降解竹纤维的理想条件来生物转化酒精等能源物质成为可能,从而达到变害虫为益虫的性质变化。
由于纤维素酶的活性于受到底物浓度、反应时间等诸多因素的限制,检测结果也容易受到蛋白质定量方法等因素的影响,很难和其他人的研究结果直接进行定量比较[11]。因此,在相同反应条件下对昆虫肠道3 个不同部位内纤维素酶活性的比较研究具有重要意义。本文在不同温度和pH 值条件下检测了长足大竹象成虫3 段肠道内纤维素酶的活性大小,为寻找生物高效降解竹纤维的最佳条件提供了可靠的研究基础。
1 材料与方法
1.1 虫体来源
长足大竹象(Cyrtotrachelus buqueti)采于四川省乐山市沐川县大楠镇。
1.2 试剂来源
羧甲基纤维素(CMC)和水杨素(Salicin)均由Sigma 公司生产,微晶纤维素(MCC)由Fluka 公司生产,其他试剂未有特别说明均为国产分析纯。
1.3 初酶液的制备
取体态大小相同的虫体5 只,冰浴解剖,取出肠道,用解剖针将肠道分成前、中、后肠,将其分别放在含有0.01 mol·L-1pH7.4 的柠檬酸缓冲液的研钵中充分匀浆,后于4 ℃10 000 r·min-1离心15 min,上清液即为原酶液。分别取3 mL 五只虫体的3 段肠道的原酶液与只含相同浓度的柠檬酸缓冲液放入5 mL 的离心管中进行对应编号。分装好之后放入到-70 ℃的冰箱中保存起来,备用。
1.4 稀释酶液的蛋白含量
采用Bradford 法[12]测定蛋白质的含量。称取100 mg 考马斯亮蓝G-250,溶于50 mL 95%乙醇中,加入磷酸100 mL,最后用蒸馏水定容到1 000 mL;取50 mg 牛血清白蛋白(BSA),溶于50 mL 0.15 M NaCl 溶液中,配置成1 mg·mL-1标准蛋白溶液。
取11 支试管,分别加入0.00,0.02,0.04,0.06,0.08,0.1,0.3,0.5,0.7,0.9,1.0 ml 的0.06 ml 1 mg·mL-1的标准蛋白溶液(移液管),蒸馏水定容至1 mL,加入2.4 mL 考马斯亮蓝试剂,混匀后(微型旋涡混凝器)在595.0 nm 处测定OD 值,建立蛋白质定量标准曲线。
分别取肠道3 段供试酶液0.05 mL,蒸馏水0.05 mL,分别加入2.4 mL 考马斯亮蓝试剂,混匀后在595.0 nm 处测定OD 值(酶标仪),每个样品重复3 次,根据标准蛋白曲线计算稀释后酶液中的蛋白质含量。
1.5 葡萄糖标准曲线的绘制
首先配置1 mg·mL-1的标准葡萄糖溶液:取恒重葡萄糖0.1000 g 于50 mL 烧杯中,加蒸馏水稀释后倒入100 mL 的容量瓶中,定容至100 mL。取8 支试管,分别加入0.00,0.02,0.04,0.06,0.08,0.1,0.12,0.14 mL 的1 mg·mL-1的标准葡萄糖溶液,用蒸馏水定容至1 mL 后,各瓶中均加1.5 mLDNS 显色剂,摇匀后置于沸水浴中加热5 min 后用水冷却,加蒸馏水0.5 mL,摇匀。以1 号瓶为空白对照在540.0 nm 处测定各管的OD 值。以各瓶中葡萄糖的浓度为横坐标,OD 值为纵坐标,绘制葡萄糖标准曲线。
1.6 纤维素酶活性的测定
在5 个温度和7 个pH 值(共计35 个组合)条件下分别对内切β-1,4-葡聚糖酶(CX酶)、外切β-1,4-葡聚糖酶(C1酶)和β-葡萄糖苷酶的活性进行比较测定。
CX酶的测定用1%羧甲基纤维素为底物,C1酶的测定用2%微晶纤维素为底物,β-葡萄糖苷酶的测定用2%水杨素为底物。各底物分别用pH 值为3,4,5,6,7,8 的磷酸二氢钠一柠檬酸缓冲液(0.2 mol·L-1)和pH 为9 的甘氨酸一氢氧化钠缓冲液(0.2 mol·L-1)配制。
取稀释酶液0.1 mL 与0.3 mL 上述底物充分混匀,分别在30,40,50,60,70 ℃水浴中温育2 h后,加入DNS 显色剂2 mL,沸水浴显色5 min,流水冷却,在540 nm 下测定OD 值,每测定重复3 次,取平均值,同时设空白对照。以试验条件下酶液蛋白含量(mg)在单位时间(min)内酶促反应产生的还原糖(葡萄糖)量(μmol)计算酶活性,即μmol·min-1·mg-1。
1.7 数据分析
温度和pH 值对甲虫体内纤维素酶活性影响采用方差分析法,各甲虫纤维素酶最适温度和pH 值条件下的活性值采用多重比较分析。所有数据处理均使用统计软件SPSS18.0。
2 结果与分析
2.1 长足大竹象成虫前肠内纤维素酶活性与pH 值和温度的关系
pH 值和温度的变化对长足大竹象成虫前肠中3 种纤维素酶活性有显著的影响。β-葡萄糖苷酶的最适温度范围为30~60 ℃,最适pH 值为4~6 之间,最高 酶 活 性 为 0.0257 μmol·min-1·mg-1( pH 值=5,60 ℃),当pH 值处于较酸情况时,温度高于40 ℃时β-葡萄糖苷酶活性呈上升趋势。当pH 值处于较碱情况下时,该酶活性随温度的升高呈现下降趋势直至无活性状态;CX酶的最适温度范围在50~70 ℃之间,最适pH 值为6~8 之间,最高酶活性为0.0258 μmol·min-1·mg-1,当pH 值<5 时,温 度 在30~70 ℃之间都呈现无活性状态,当5<pH 值<7时,各温度条件下的酶活都呈现上升趋势。但C1酶在各组合条件下的酶活性都较高,都有活性的存在,其中酶活性最高为0.0349 μmol·min-1·mg-1(pH值=3,40 ℃),最低的酶活为0.0012 μmol·min-1·mg-1(pH 值=9,40 ℃),当4<pH 值<7 时,在30~70 ℃的温度下,酶活性都呈现上升趋势(见图1)。
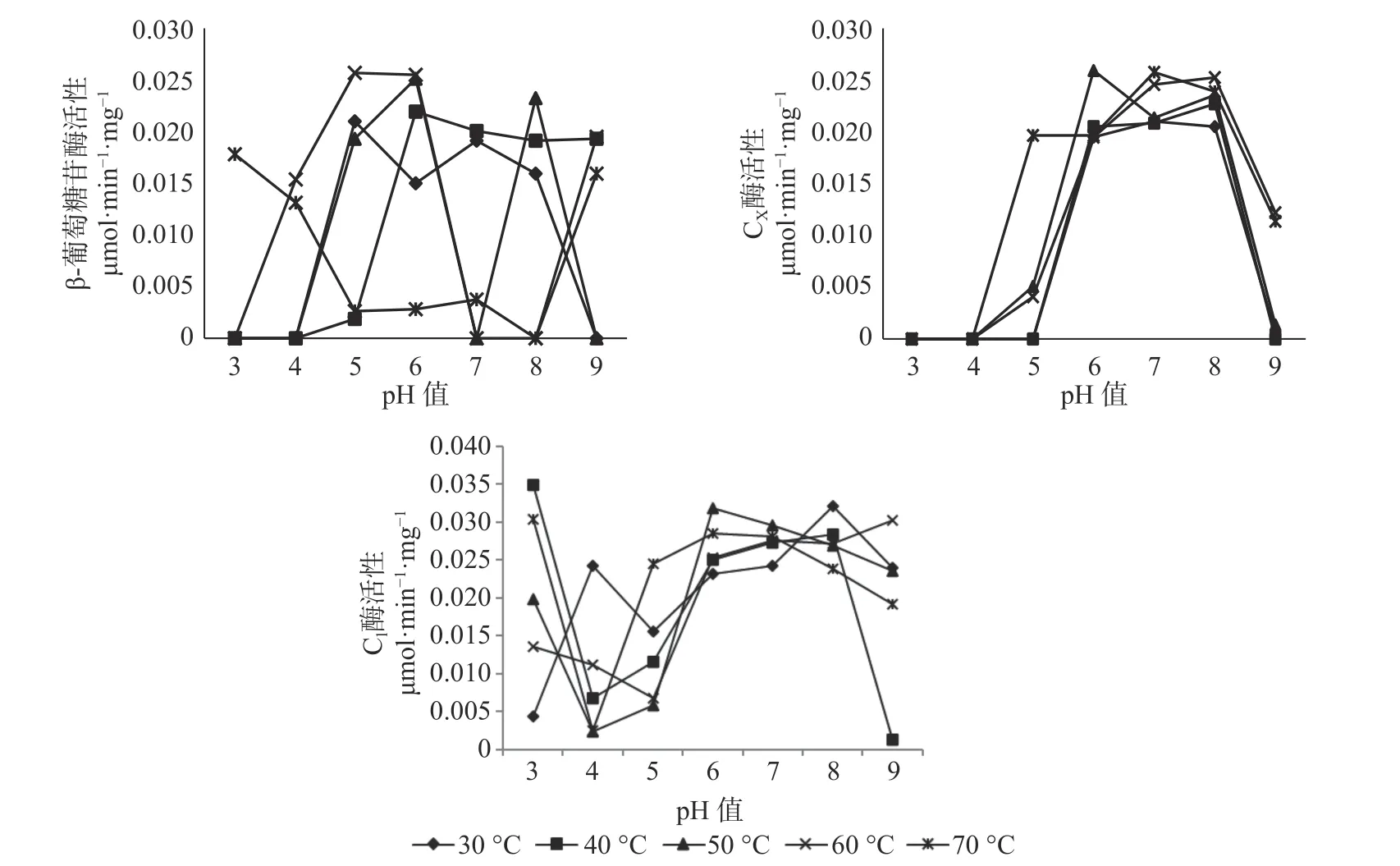
图1 长足大竹象成虫前肠纤维素酶活性Fig.1 Cellulase activity in the foregut of Cyrtotrachelus buqueti adults
2.2 长足大竹象成虫中肠内纤维素酶活性与pH 值和温度的关系
对于长足大竹象成虫的中肠而言,β-葡萄糖苷酶活性的最适温区为40~60 ℃,最适pH 值为5~6 之间,其 中 酶 活 性 最 高 为0.0228 μmol·min-1·mg-1(pH 值=6,T=50 ℃),当3<pH 值<4 等较酸状态下时,温度处于在60~70 ℃之间时酶活性较高,当7<pH 值<9 等较碱状态下时,温度在30~50 ℃时酶活性较高。CX酶的最适温度范围在40~60 ℃之间,最适pH 值为5~8 之间,其中最佳酶活性为0.031 μmol·min-1·mg-1(pH 值=6,T=50 ℃),当pH 值为3、4、9 时CX酶几乎没有酶活性的存在,当5<pH 值<8 时,在所实验的温度范围内酶活性都是依次递加的。C1酶的最适温度范围为30~70 ℃,最适pH 值为5~8 之间,其中C1酶最适酶活性为0.0337 μmol·min-1·mg-1(pH 值=3,T=40 ℃),当3<pH 值<4 与8<pH 值<9 之间时,各温度范围内酶活性都呈现下降趋势,当pH 值位于5~8 之间时,C1酶活性在各温度范围内呈现上升趋势(见图2)。
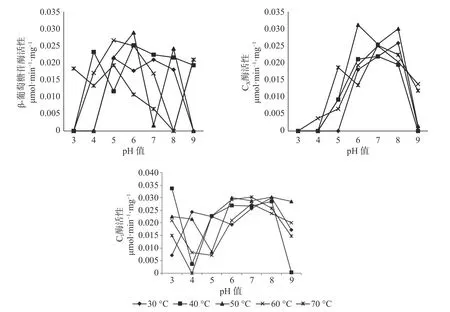
图2 长足大竹象成虫中肠纤维素酶活性Fig.2 Cellulase activity in the midgut of Cyrtotrachelus buqueti adults
2.3 长足大竹象成虫后肠内纤维素酶活性与pH 值和温度的关系
对于长足大竹象成虫的后肠而言,β-葡萄糖苷酶活性的最适温区为30~50 ℃之间,最适pH 值区间为5~8,其 中 最 佳 酶 活 性 为0.027 μmol·min-1·mg-1(pH 值=6,50 ℃),当pH 值为3~4 与9 时,温度处于60~70 ℃时酶活性处于较高状态,当pH 值为5~8 之间时,温度处于30~50 ℃β-葡萄糖苷酶处于较高的活性状态。当pH 值为3、4 时,除温度为70 ℃有活性外,其余温度状态下β-葡萄糖苷酶都处于无活性状态,当pH 值为7、8 时,温度处于60~70 ℃下几乎无活性的存在。CX酶的最适温区为30~50 ℃,最适pH 值区间为6~8,其中CX酶的最适酶活性为0.0263 μmol·min-1·mg-1( pH 值=7,70 ℃) ,当pH 值为3~5 之间时,在所测的30~70 ℃温度范围内CX酶几乎没有酶活性的存在,当pH 值为5~8 之间时,在30~70 ℃的温度范围内,CX酶的酶活性都随着pH 值的增加而增加,当pH 值为8~9 之间时,酶活性随着pH 值的升高而升高。C1酶的最适温区为40~50 ℃,最适pH 值区间为6~8,其中C1 酶的最 适 酶 活 性 为0.0317 μmol·min-1·mg-1(pH 值=3,40 ℃),在所测条件下除pH 值=9,40 ℃无酶活性外,其余各组合条件下均有酶活性的存在,当pH 值为3~4 之间时,各温度状态下,C1酶的酶活性随pH 值的增加而减少,当pH 值为4~8 之间时,C1酶的酶活性随pH 值的升高而升高,当pH 值为8~9 之间时,C1酶的酶活性随pH 值的增加而减少(见图3)。
2.4 长足大竹象成虫肠道各段内(前、中、后)β-葡萄糖苷酶活性的比较
β-葡萄糖苷酶在长足大竹象成虫的前肠当中的最适酶活性为0.0257 mol·min-1·mg-1(pH 值=5,60 ℃),当pH 值为3、4、7、8、9 时β-葡萄糖苷酶都存在无活性状态。β-葡萄糖苷酶在长足大竹象成虫的中肠当中的最适酶活性为0.0288 μmol·min-1·mg-1(pH 值=6,50 ℃),当pH 值为3、4、8、9 时β-葡萄糖苷酶存在无活性状态。β-葡萄糖苷酶在长足大竹象成虫的后肠当中的最适酶活性为0.027 μmol·min-1·mg-1(pH值=6,50 ℃),当pH 值为3、4、7、8、9 时β-葡萄糖苷酶存在无活性状态。β-葡萄糖苷酶在长足大竹象成虫肠道各段内的酶活性大小依次是中肠>后肠>前肠(见图4)。
2.5 长足大竹象成虫肠道各段内(前、中、后)CX 酶活性的比较
CX酶在长足大竹象成虫的前肠当中的最适酶活性 为0.0258 μmol·min-1·mg-1(pH 值=6,50 ℃),当pH 值为3、4、5、9 时CX酶都存在无活性状态。CX酶在长足大竹象成虫的中肠当中的最适酶活性为0.031 μmol·min-1·mg-1(pH 值=6,50 ℃),当pH 值为3、4、5、9 时CX酶都存在无活性状态。CX酶在长足大竹象成虫的后肠当中的最适酶活性为0.0263 μmol·min-1·mg-1( pH 值=7,70 ℃) ,当pH 值为3、4、5、9 时CX酶存在无活性状态。CX酶在长足大竹象成虫肠道各段内的酶活性大小依次是中肠>后肠>前肠(见图5)。
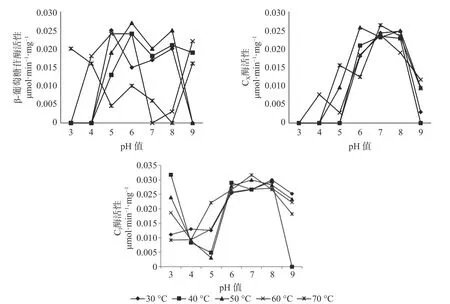
图3 长足大竹象成虫后肠纤维素酶活性Fig.3 Cellulase activity in the hindgut of Cyrtotrachelus buqueti adults
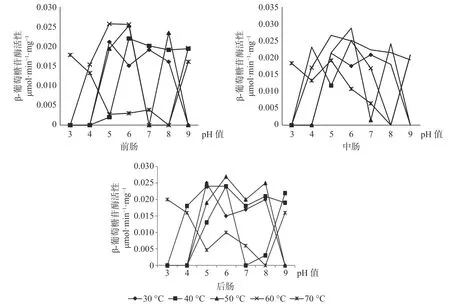
图4 长足大竹象肠道3 段中β-葡萄糖苷酶活性比较Fig.4 Comparison of glucosidase activity in three intestine segments of Cyrtotrachelus buqueti
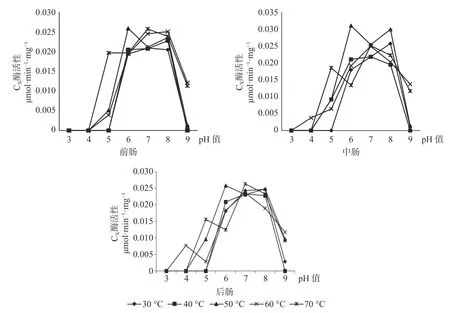
图5 长足大竹象肠道3 段中CX 酶活性比较Fig.5 Comparison of CX enzyme activity in three intestine segments of Cyrtotrachelus buqueti
2.6 长足大竹象成虫肠道各段内(前、中、后)C1 酶活性的比较
C1酶在长足大竹象成虫的前肠当中的最适酶活性为0.0349 μmol·min-1·mg-1(pH 值=3,40 ℃),其中C1酶在任何pH 值条件下都有酶活性的存在。C1酶在长足大竹象成虫的中肠当中的最适酶活性为0.0337 μmol·min-1·mg-1( pH 值=3,40 ℃) ,当pH 值为4、9 时C1酶都存在无活性状态。C1酶在长足大竹象成虫的后肠当中的最适酶活性为0.0317 μmol·min-1·mg-1( pH 值=3,40 ℃) ,当pH 值为9 时存在无活性状态。C1酶在长足大竹象成虫肠道各段内的酶活性大小依次是前肠>中肠>后肠(见图6)。
3 结论与讨论
本文研究的长足大竹象成虫肠道3 段(前、中、后)中均存在完整的纤维素酶系,但是各段内的纤维素酶系的活性又不尽相同。
在长足大竹象成虫的前肠当中β-葡萄糖苷酶的最适温区为30~60 ℃,最适pH 值为4~6 之间;CX酶的最适温区在50~70 ℃,最适pH 值为6~8 之间,而C1酶在任何的pH 值与温度的组合下都呈现出较高的活性。就长足大竹象成虫的前肠而言,CX酶比β-葡萄糖苷酶较易耐受高温以及强碱,这可能是因为长足大竹象成虫的前肠(包括口器、食道、嗉囊和前胃)主要的功能是镊取、储藏、磨碎食物,当长足大竹象成虫在摄取竹子进入消化道之后,竹子当中所含的丰富的纤维素首先进入前肠被研磨、消化[13],同时由于纤维素酶系消化纤维素是先由CX酶作用于纤维素内部的非结晶区或羧甲基纤维素,随机水解β-1,4-糖苷键,将长链纤维分子截断,产生大量的小分子纤维素,再由C1酶作用于纤维素线状分子末端,水解β-1,4-糖苷键,每次从纤维素链的非还原端切下一个纤维二糖分子,可以水解微晶纤维素,最后由β-葡萄糖苷酶水解纤维二糖和短链的纤维寡糖生成葡萄糖。而前肠主要起着研磨、分解纤维素的作用[14],因此CX酶与C1酶较β-葡萄糖苷酶在前肠当中的稳定性就较强,在最适条件下的纤维素酶活性也较高。
在长足大竹象成虫的中肠当中β-葡萄糖苷酶的最适温区为40~60 ℃,最适pH 值为5~6 之间。CX酶的最适温区在40~60 ℃,最适pH 值为5~8。C1酶的最适温区在30~70 ℃,最适pH 值为5~8 之间。其中中肠当中在最适条件下酶活性最大的为C1酶,其次为CX酶,这是由于长足大竹象成虫中肠前端膨大肠壁密生排列规则向外突起的乳头状盲囊,呈肉色,其数目不等,目的在于扩大肠壁面积,利于食物消化和营养物质的吸收。既然中肠的主要功能是在于食物的消化与营养物质的吸收,而由于纤维素在水解时由于C1酶水解纤维素之后产生的纤维二糖的积累会抑制CX酶的活性[15]而纤维素酶组分中β-葡萄糖苷酶含量最少、活力普遍较低,一般成为纤维素酶解的瓶颈[8],因此在中肠当中C1酶的活性较大。
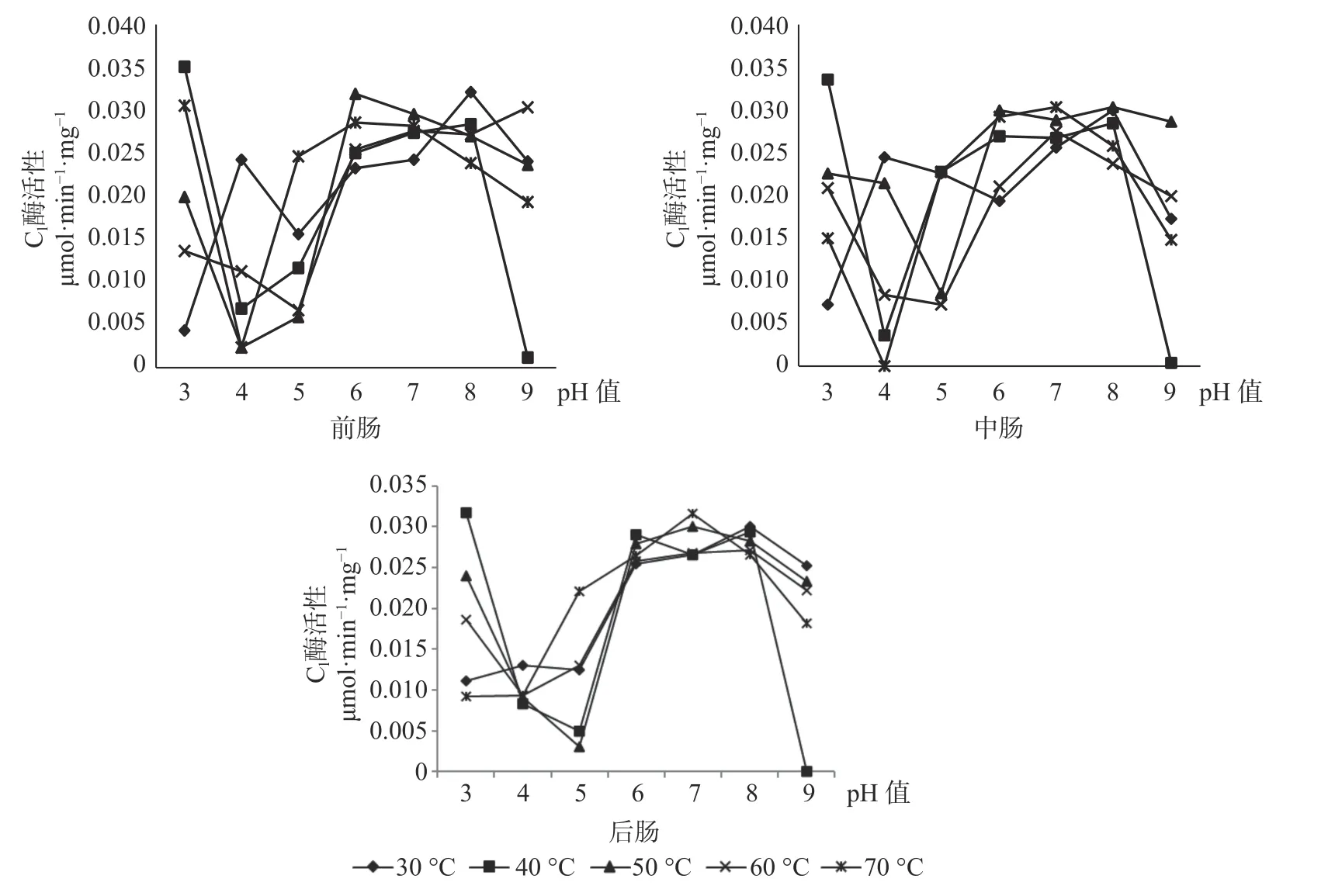
图6 长足大竹象成虫肠道3 段中C1 酶活性比较Fig.6 Comparison of C1 enzyme activity in three intestinal segments of Cyrtotrachelus buqueti adults
在长足大竹象成虫的后肠当中β-葡萄糖苷酶的最适温区为30~50 ℃,pH 值为5~8。CX酶的最适温区在30~50 ℃,pH 值为6~8 之间。C1酶的最适温区在40~50 ℃,最适pH 值为6~8 之间。在长足大竹象成虫的后肠当中在最适条件下酶活性最大的是C1酶,其次是CX酶,这是由于中肠与后肠以马氏管为界,分为透明细长管状的前后肠和发达的直肠,前后肠在虫体腹部回折两次,表面粘附很多气管,马氏管呈透明状,韧性变弱,易断裂,直肠直连肛门[16],其主要功能是回收水分。在后肠当中长足大竹象成虫摄取的竹纤维在此部位已经大致消化完全,因此其酶活性的大小特点就与中肠较为相似。
本实验从长足大竹象成虫的肠道各部位去分析其纤维素酶对其所摄食的竹纤维的分解情况,发现长足大竹象成虫肠道各段内的3 种纤维素酶活性在高温、强碱条件下均为检测出酶活性。值得关注的是,长足大竹象成虫各段肠道也可以在酸性条件下检测出酶活,其他一些甲虫也有着类似的规律,例如,赤拟谷盗[17]、芜菁[18]和几种天牛在酸性条件下酶活性较高[19]。这可能是因为植物中含有的纤维素、半纤维素和木质素等结晶组织需要酸性条件下分解。酸性处理纤维素底物能够产生非结晶末端,使纤维素更容易被分解[20]。

