磷矿渣对水溶液中Cd(Ⅱ)的吸附性能研究
李颖华 余 瑞 王柳杨 贾漫珂 任 东 任 顺 刘立明
(1.湖北省三峡地区生态保护与治理国际联合研究中心,湖北宜昌 443002;2.湖北省农田环境监测工程技术研究中心,湖北 宜昌 443002)
Cd(Ⅱ)具有生物不可降解性、生物蓄积性和剧毒性,已被美国环境保护局列入优先污染物清单,并被列入欧洲水框架指令的优先有害物质清单[1].环境中的Cd(Ⅱ)主要来源于电镀、肥料、冶炼、合金制造、颜料、塑料、电池和采矿活动等,直接摄入Cd(Ⅱ)或者通过食物链在人体中富集,可能对人类的骨骼、肾、肺和各种循环系统造成严重的损害[2-3],给人类健康带来风险.我国作为全球最大的初级镉金属产区之一,长时间的大规模开采活动和工业污水排放导致了大量的镉进入水环境中造成了水体镉污染.据生态环境部发布的《2018中国环境状况公报》调查显示,全国10 168个国家级地下水水质监测点中的个别监测点中的铅、锌、砷、汞、六价铬和镉等重(类)金属已经超标,污水排放汞、六价铬、铅和镉等污染物导致近岸海域水质变差.例如,韶关冶炼厂超标排放含镉废水,使北江韶关段镉质量浓度达到了0.069 mg/L[4],是《地表水质量标准》(GB 3838—2002)Ⅱ类水质规定的限值(0.005 mg/L)的13.8倍.因此如何修复和治理Cd(Ⅱ)污染已成为当前急需解决的环境问题之一.
目前,关于水中重金属去除的方法主要有沉淀、离子交换、反渗透、超滤、电渗析和吸附等[5].这些方法中,吸附具有潜力大、灵活性强、设计简单、操作方便等优点,是应用前景较好的去除方法之一.为此,已开发了多种高效的吸附材料去除环境中的重金属,但大数效率较高的吸附剂因为较高的成本限制了它们在重金属污染处理中实际应用[6].因此,以合理的成本将重金属浓度降低到可以排放水平的高效、廉价、环境友好的吸附材料的开发显得尤为重要.在此背景下,利用环境矿物材料处理污水中Cd(Ⅱ)污染引起了人们的极大兴趣,例如改性炭、羟基磷灰石、海泡石和蒙脱土等.磷矿渣是生产黄磷时产生的一种水淬渣,主要成分为硅酸盐、钙盐和少量的磷酸盐等.我国的磷矿资源丰富,黄磷生产产生大量的磷矿渣,该废渣多为堆放处置,只有少量用作建材原料(水泥、混凝土、陶瓷材料、烧结砖等)[7].大量的废渣堆放不但占据土地资源,还会对环境造成潜在破坏.因此,研究磷矿渣资源化利用问题意义重大.
本文以磷矿渣(Phosphorus Slag,PS)为吸附材料去除水中Cd(Ⅱ),研究吸附动力学和热力学,探讨吸附的影响因素.将磷矿渣用于治理Cd(Ⅱ)污染,不需要繁琐的处理过程,不仅能降低成本,而且磷矿渣磷含量较低,控制用量不会对环境造成二次磷污染,在治理Cd(Ⅱ)污染的同时也解决了废弃物堆积占据土地资源的问题.该研究将为实现固体废弃物的循环经济,去除水体和土壤中的重金属提供新的思路.
1 材料与方法
1.1 磷矿渣来源
实验所用的磷矿渣样品取自湖北省兴发集团白沙河化工厂,用蒸馏水浸泡,清洗表面杂质,置于105℃烘箱中烘干,球磨机研磨后备用,磷矿渣p H 为10.1.X 射线荧光光谱分析(XRF)(Axios,荷兰帕纳科公司)定量分析磷矿渣化学成分见表1.

表1 磷渣的主要化学成分
1.2 磷渣表征
利用傅里叶红外光谱仪(FTIR)(NICOLET iS10,美国赛默飞世尔科技公司)KBr压片法扫描进行红外光谱分析,定性分析磷矿渣吸附镉前后表面官能团的变化.X-射线光电子能谱仪(XPS)(K-Alpha+,美国赛默飞世尔科技公司)分析磷矿渣表面元素.激光粒度仪(Zetasizer Nano ZS 90,英国马尔文公司)测定磷矿渣(2 g/L分散液)不同p H 下的Zeta电位.
1.3 吸附实验
1.3.1 不同使用量下磷矿渣对Cd(Ⅱ)吸附和磷的释放的影响
在250 m L的锥形瓶中加入100 m L的Cd(Ⅱ)溶液(22.41 mg/L),分别将0.01到4.5 g的磷矿渣加入Cd(Ⅱ)溶液中,即磷矿渣用量从0.1 g/L到45 g/L,在25℃、150 r/min 条件下恒温振荡12 h,用孔径0.45μm 的滤膜过滤,采用ICP-MS(Agilent7500a,美国安捷伦科技公司)测定滤液中的Cd(Ⅱ)浓度,采用钼酸铵分光光度法(GB11893—1989)测定滤液中磷的浓度.
1.3.2 不同初始p H 值对磷矿渣吸附Cd(Ⅱ)能力的影响
在250 m L的锥形瓶中分别加入50 m L Cd(Ⅱ)溶液(100 mg/L),用0.1 mol/L 的 HNO3和 0.1 mol/L的NaOH 将Cd(Ⅱ)溶液p H 分别调节至3、4、5、6、7、8、9后加入0.1 g磷矿渣(磷矿渣用量为2 g/L).在25℃、150 r/min条件下恒温振荡12 h,用孔径0.45μm 的滤膜过滤,采用ICP-MS测定滤液中的Cd(Ⅱ)浓度.
1.3.3 吸附动力学实验
在1 L 的锥形瓶中加入500 m L 的Cd(Ⅱ)溶液(100 mg/L)和1 g磷矿渣(磷矿渣用量为2 g/L),在25℃、150 r/min条件下恒温振荡,分别在时间为15、30、60、120、240、360、480、720 min 时取样,用孔径0.45μm 的滤膜过滤,采用ICP-MS 测定滤液中的Cd(Ⅱ)浓度.
1.3.4 等温吸附实验
称取0.1 g磷矿渣于250 m L锥形瓶中(磷矿渣用量为2 g/L),分别加入50 mL 质量浓度为2、10、20、30、50、100 mg/L的Cd(Ⅱ)溶液,在25、35及45℃的条件下,150 r/min恒温振荡12 h,用孔径0.45μm 滤膜过滤,采用ICP-MS测定滤液中的Cd(Ⅱ)浓度.
1.4 数据处理
1.4.1 去除率和吸附量
利用式(1)计算磷矿渣的吸附量(qe)和去除效率(Re)
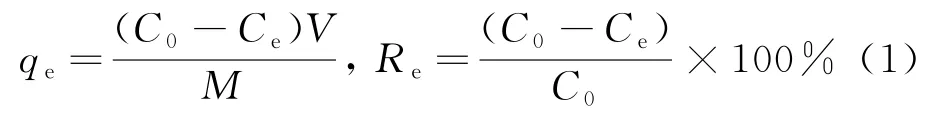
式中:qe为吸附量(mg/g);C0为 Cd(Ⅱ)的初始质量浓度(mg/L);Ce为一定接触时间后溶液中Cd(Ⅱ)的质量浓度(mg/L);V为 Cd(Ⅱ)溶液体积(L);M为磷渣质量(g);Re为去除率(%).
1.4.2 动力学模型
选取准一级线性方程、准二级线性方程、颗粒内扩散线性方程对吸附过程进行拟合[1,8].
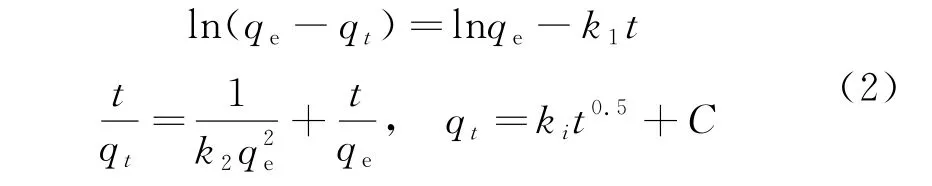
式中:t为吸附时间(min);qt为t时刻的吸附量(mg/g);qe为平衡吸附量(mg/g);k1为准一级反应速率常数(min-1);k2为准二级反应常数[g/(mg·min)];ki为颗粒内扩散速率常数[mg/(g·min1/2)].
1.4.3 等温吸附模型
采用Langmuir方程、Freundlich方程进行等温吸附模拟,公式如下[9].

式中:Ce表示平衡时吸附物质量浓度(mg/L);qe为平衡吸附量(mg/g);kL为Langmuir吸附常数(L/mg);qm为饱和吸附容量(mg/g);kF为 Freundlich等温线常数;n(无量纲)为吸附强度.
1.4.4 吸附热力学
热力学参数 ΔGθ,ΔSθ和 ΔHθ由下列方程确定[10-11].
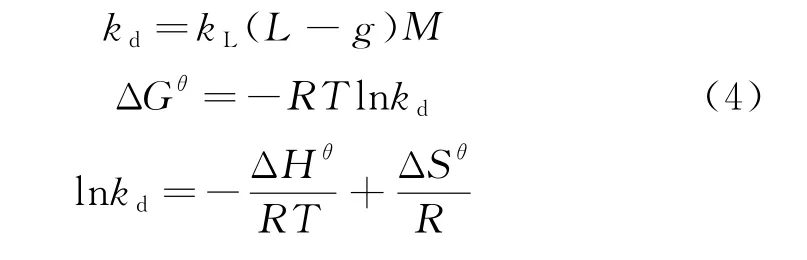
式中:kd为吸附平衡常数;kL为 Langmuir常数;M为相对摩尔质量,R=8.314 J/(mol·K)为理想气体常数;T为温度(K).
2 结果与讨论
2.1 吸附剂表征
2.1.1 红外光谱分析
在FTIR 光谱中(如图 1 所示),吸附后 PS 在474.35 cm-1处的Si-Si特征带蓝移到469.89 cm-1,表明Cd(Ⅱ)被吸附在磷矿渣上[9].在718 cm-1处出现的吸收峰是由于中碳氧键的弯曲振动引起的[12].在945cm-1波数附近吸收带,主要是由于Si—O(Si)的拉伸振动和P—O 键的弯曲振动引起的[13].在1 640 cm-1处的宽带对应于H—O—H 的弯曲振动,以3 445 cm-1为中心的宽频带为O—H 的拉伸振动[1],这些特征带位置没有变化,表明骨架结构保持不变.
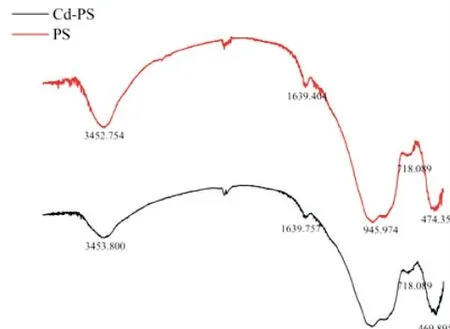
图1 吸附前后磷矿渣的红外光谱图
2.1.2 X 射线光子能量谱图分析
采用XPS法对吸附前后的磷矿渣粉末表面元素进行了分析(如图2a所示),吸附Cd(Ⅱ)后,磷矿渣中出现Cd(Ⅱ)的能量峰,同时Ca(Ⅱ)峰值降低,表明可能发生了离子交换[9].对Cd的3 d特征峰进行分峰拟合(如图2b所示).结果显示,Cd的两个特征峰分别位于405.58 eV 和412.38 e V 结合能处,表明存在两种化学形态[14],且主要为Cd(Ⅱ)的氧化态,在405.3 e V 出现的峰值说明可能生成Cd(OH)2或CdCO3沉淀[15].
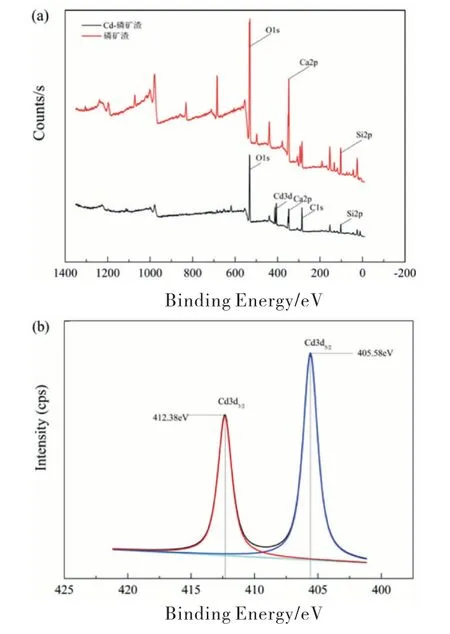
图2 吸附前后磷矿渣的xps图谱(a)和Cd-磷矿渣3 d的分谱(b)
2.2 不同使用量下磷矿渣对Cd(Ⅱ)吸附和磷的释放的影响
Cd(Ⅱ)的去除率(Re)随着磷矿渣使用量的增加而增大(如图3(a)所示),当磷矿渣的投加量为25 g/L时,Cd(Ⅱ)的去除率达到94.04%,主要是因为磷矿渣使用量的增加可以提供更多有效基团(OH-、等)和表面吸附位点,从而增加了Cd(Ⅱ)的去除率.进一步增加磷矿渣使用量对去除率影响较小,磷矿渣的使用量为45 g/L时,Cd(Ⅱ)去除率最大,达到96.62%.从图3(a)还可以看出,单位吸附量随磷矿渣添加量的增加而减小.这是由于吸附过程中单位质量磷矿渣结合的Cd(Ⅱ)减少,磷矿渣吸附位点不饱和所导致的.
增加磷矿渣的使用量,溶液中的磷含量随之增加(图3(b)).当磷渣使用量为2 g/L 时,水溶液中磷含量达到0.39 mg/L,达到了我国《地表水环境质量标准》(GB3838—2002)的Ⅴ类水质要求(0.4 mg/L).表明磷矿渣使用量在2 g/L 以下时不会对水体造成二次磷污染.
2.3 不同初始p H 值下磷矿渣的Zeta电位和对Cd(Ⅱ)吸附的影响
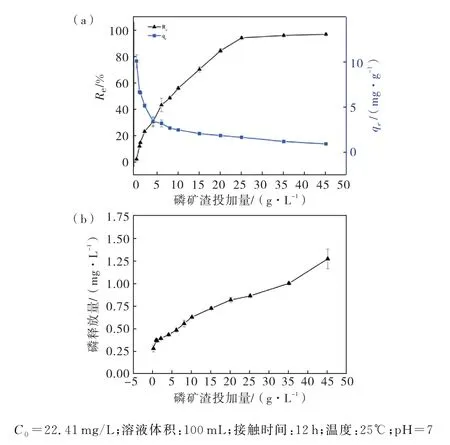
图3 不同使用量下磷矿渣对Cd(Ⅱ)吸附(a)和磷的释放量(b)的影响
p H 值是控制金属离子吸附行为的主要参数之一,影响吸附剂的表面性质[16].p H 值的改变也可以改变磷矿渣表面的zeta电位从而改变磷矿渣的水解程度和带电状态[17].在实验p H 值范围内,水溶液中磷矿渣表面的zeta电位皆为负值,且随着p H 值的增加,磷矿渣zeta电位的绝对值逐渐增加(图4(a)).这说明在溶液中磷矿渣表面是带负电的,随p H 值的增加,磷矿渣表面OH-增多.Cd(Ⅱ)的吸附量随着溶液初始p H 值的增加而逐渐增加(图4(b)).

图4 不同初始p H 值水溶液中磷矿渣的zeta电位(a)和不同初始p H 值镉溶液中磷矿渣对Cd(Ⅱ)吸附量的影响(b)
可见,磷矿渣对Cd(Ⅱ)的吸附效果受到溶液初始p H 值的影响.当溶液初始p H 为3时,Cd(Ⅱ)的吸附量为1.67 mg/L,溶液颜色变为绿色,并有硫化氢气体放出.可能是在较低的p H 条件下,磷矿渣含有的FeS 发生复分解反应.当溶液初始p H<6 时,Cd(Ⅱ)的吸附量增加较为缓慢,因为当p H 较低时,H+占据了磷矿渣表面的部分吸附位点,从而抑制了磷矿渣吸附Cd(Ⅱ)的离子交换和表面络合作用.当p H>6时磷矿渣的吸附量迅速增加,可能是zeta电位降低,OH-增加引起静电平衡斥力降低,吸附剂表面与金属离子之间的斥力减小,从而提高了吸附能力.当溶液初始p H 为9时,加入磷矿渣絮凝成团.根据Cd(OH)2的Ksp(25℃),可以计算出溶液的p H达到8.22时,Cd(Ⅱ)与OH-开始发生沉淀,沉淀粒子与Al3+水解生成的胶体状氢氧化铝通过粒子间形成架桥作用从而聚集在一起形成沉淀[18].
2.4 吸附动力学特性
接触时间对吸附效果的影响如图5(a)所示,磷矿渣对Cd(Ⅱ)的吸附量在60 min内吸附速率较高,这是因为反应初期溶液中Cd(Ⅱ)质量浓度较大,磷矿渣表面官能团数量和有效位点较多,两者相互结合的驱动力大.在吸附进行60 min后,Cd(Ⅱ)质量浓度降低,表面官能团和有效位点大部分被占据,吸附速率降低,吸附容量趋于稳定达到饱和.
为了更好地了解磷矿渣吸附Cd(Ⅱ)的机制,采用准一级和准二级动力学模型对实验数据进行拟合分析,研究磷矿渣吸附Cd(Ⅱ)的动力学特性,采用颗粒内扩散模型确定扩散阻力对吸附过程的影响.磷矿渣对Cd(Ⅱ)的吸附动力学模型拟合结果如图5(b)和5(c)所示,模型拟合参数的值见表2.

图5 磷矿渣吸附Cd(Ⅱ)动力学特性图
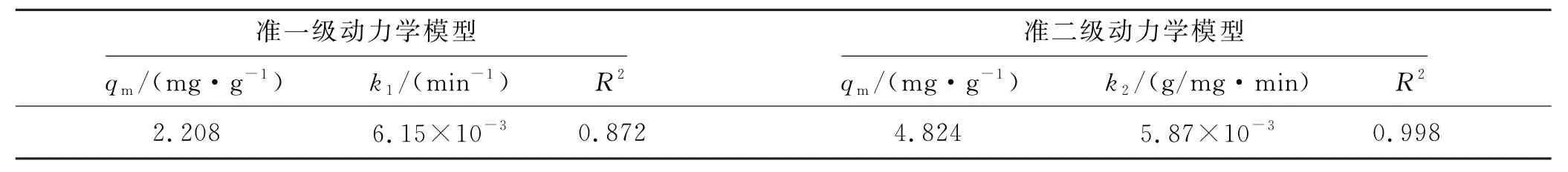
表2 磷矿渣对Cd(Ⅱ)吸附的动力学拟合参数
结果显示,准二级动力模型可以较好地描述磷矿渣对Cd(Ⅱ)的吸附过程(R2=0.998),表明磷矿渣对Cd(Ⅱ)的吸附过程是化学吸附[19].颗粒内扩散模型拟合结果(图5(c)),拟合曲线可分为两个阶段,且都不经过原点,表明内扩散不是控制吸附的唯一方式[20].第1段是指Cd(Ⅱ)从溶液表面转移到磷矿渣表面的表面扩散过程,吸附速率较快.第2段是在磷矿渣颗粒内部扩散过程,吸附速率慢,表明Cd(Ⅱ)在磷矿渣内部扩散在吸附过程中是限制吸附速率的过程.
2.5 吸附等温线
随着初始Cd(Ⅱ)离子溶液浓度的增加,磷矿渣对Cd(Ⅱ)离子的吸附量逐渐增大(图6(a)),且最大吸附量随温度升高而增加.去除率随初始Cd(Ⅱ)离子溶液质量浓度增加而增加(图6(b)),当初始Cd(Ⅱ)中溶液质量浓度为2.08 mg/L 时,磷矿渣用量为2 g/L 时Cd(Ⅱ)的去除率达到了99.81%(45℃)、99.71%(35℃、25℃),处理后溶液中Cd(Ⅱ)的质量浓度为0.004 0 mg/L(45℃)、0.006 0 mg/L(35℃、25℃).由此可知,在45℃的温度下,2 g/L 的磷矿渣用量可以将Cd(Ⅱ)溶液(2.08 mg/L)中的镉降低到国家《地表水环境质量标准》(GB3838-2002)Ⅱ类水质规定的限值(0.005 mg/L)以下,此时磷的释放不会导致二次污染问题.
在3种不同初始温度(25、35、45℃)下进行平衡等温线实验,采用Langmuir和Freundlich等温模型描述不同温度下Cd(Ⅱ)吸附平衡.Langmuir吸附等温模型假设均匀吸附剂表面的单层吸附,被吸附离子间无相互作用.Freundlich吸附等温模型是一个具有多重假设的经验关系式,非均匀表面吸附剂的多层吸附[11].吸附等温模型(图6(c)、(d)),吸附等温模型拟合参数见表3.结果显示,Langmuir等温模型更符合吸附过程(R2>0.99),且Langmuir模型中的qm与实验值更相近,这表明磷在磷矿渣吸附Cd(Ⅱ)的过程中,以磷矿渣表面单分子层吸附为主,表面活性位点分布比较均匀.Langmuir等温吸附模型的分离因子RL=1/(1+kLC0)是判断反应是否可以顺利进行的重要参数[21],如图6(e)所示,0<RL<1,表明吸附为有利吸附,且RL随初始溶液浓度增加而减小,表明增加初始浓度有利于吸附.
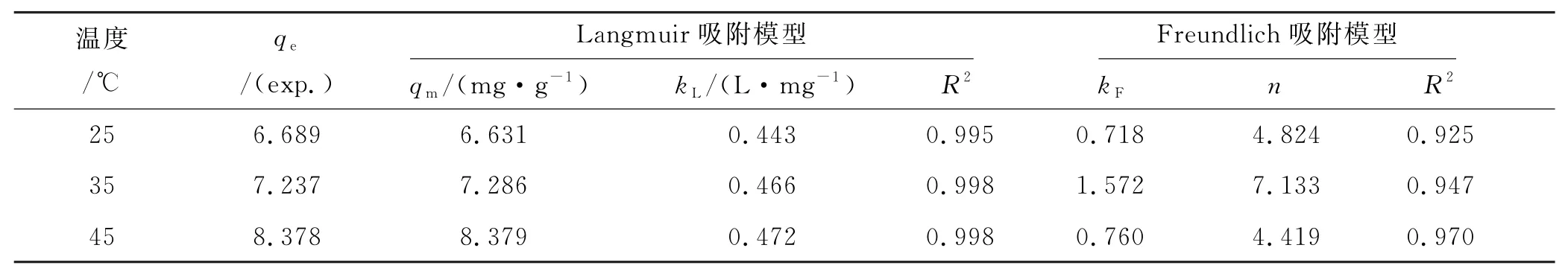
表3 磷矿渣对Cd(Ⅱ)的等温吸附模型的拟合参数

图6 吸附等温线研究图
2.6 吸附热力学分析
对热力学吸附过程研究,不同温度下的热力学参数值见表4.

表4 磷矿渣对Cd(Ⅱ)的吸附热力学参数
ΔGθ为负值说明吸附过程是自发的.随着温度升高,ΔGθ的绝对值增大,说明温度的升高有利于吸附.ΔHθ为正值表明吸附过程是吸热的.这与温度升高有利于吸附的结果一致.ΔSθ为正值表明吸附增加了溶液系统的自由度,Cd(Ⅱ)比较容易吸附在磷矿渣的固体/溶液界面.
3 结 论
以磷矿渣为吸附材料,研究了磷矿渣对水中Cd(Ⅱ)吸附特性.结果表明,磷矿渣对Cd(Ⅱ)的吸附机制可能包括离子交换和沉淀等.磷渣量的增加可以增加Cd(Ⅱ)的去除率,最大可达96.62%.溶液初始浓度和p H 值的增加均可增加磷矿渣对Cd(Ⅱ)的吸附量,且p H 对磷矿渣对Cd(Ⅱ)的吸附量的影响较大,当溶液初始p H>6时时磷矿渣对Cd(Ⅱ)的吸附量迅速增加,p H 达到9时,磷矿渣絮凝成团形成沉淀.准二级动力模型可以较好地描述磷矿渣对Cd(Ⅱ)的吸附过程(R2=0.998),表明磷矿渣对Cd(Ⅱ)的吸附是化学吸附.Langmuir等温线方程能较好地描述吸附过程,表明吸附以单层吸附为主.通过热力学研究表明,吸附是一个吸热自发的过程.磷矿渣使用量在2 g/L时,可以将Cd(Ⅱ)溶液(2.08 mg/L)中的镉降低到国家《地表水环境质量标准》(GB3838—2002)Ⅱ水质规定的限值(0.005 mg/L)以下,并且该使用量下的磷的释放不会造成二次污染.因此,磷矿渣在去除水溶中的Cd(Ⅱ)的方面具有较高的研究价值和应用潜力.

