玻璃体黄斑粘连对抗VEGF药物治疗视网膜分支静脉阻塞疗效的影响
刘思源,杨 义,王玉萍,张文芳
0引言
视网膜分支静脉阻塞(BRVO)是一种常见的视网膜血管疾病,视力下降多因继发黄斑水肿(ME)[1]。众多研究表明了抗血管内皮生长因子(VEGF)药物治疗BRVO继发ME的有效性[2-3]。近年来,学者们发现玻璃体黄斑粘连(VMA)在多种VEGF介导的视网膜疾病中发挥作用,如湿性年龄相关性黄斑变性(wARMD)、糖尿病视网膜病变(DR)、视网膜静脉阻塞(RVO)等[4-11]。一项关于wARMD患者抗VEGF治疗疗效的研究描述了VMA和视觉结果之间的关系,提示VMA是阻碍抗VEGF治疗的一种形态学特征[8]。而极少有研究报道VMA与抗VEGF治疗BRVO继发ME后视觉结果之间的关系。本研究旨在分析VMA是否影响BRVO患者抗VEGF治疗的疗效,以期为临床治疗提供参考。
1对象和方法
1.1对象回顾性病例研究。选取2017-01/2019-05在兰州大学第二医院眼科接受抗VEGF药物(康柏西普)治疗的BRVO患者110例110眼纳入本研究,其中男56例,女54例,年龄46~77(平均59.68±8.83)岁。纳入标准:(1)经眼底镜、荧光血管造影(FFA)及光学相干断层扫描(OCT)等检查,诊断为BRVO伴ME;(2)新发病例。排除标准:(1)治疗前已存在玻璃体黄斑界面异常(VMIA),根据OCT特征,VMIA分为玻璃体黄斑牵拉(VMT)和黄斑前膜(ERM),其影响黄斑的形态特征,可作为干扰因素影响视力预后;(2)治疗前或随访6mo期间行玻璃体切割术或玻璃体腔注射激素治疗;(3)伴后葡萄膜炎、年龄相关性黄斑变性、DR、高血压视网膜病变等其他眼底病变者;(4)屈光间质严重混浊,无法进行眼底检查者;(5)既往有青光眼或高眼压病史者。国际玻璃体牵引研究组对玻璃体黄斑粘连(VMA)的最新定义为:中央凹周围的玻璃体不同程度脱离而存在玻璃体黄斑部位附着,但不影响黄斑中央凹形态特征[12]。本研究基于患者初诊时OCT特征,根据VMA的定义,将纳入研究的患者分为存在VMA组(VMA+组)和无VMA组[VMA-组,初诊时OCT特征表现为在各扫描层面内均未发生玻璃体后脱离(PVD)或各扫描层面内存在不同程度PVD但无VMA],两组患者性别构成比、年龄、基线最佳矫正视力(BCVA)、黄斑中心凹厚度(CMT)、RVO类型等基线资料差异均无统计学意义(P>0.05,表1)。本研究遵循《赫尔辛基宣言》,并通过医院伦理委员会审核批准。
1.2方法
1.2.1治疗方法所有患者均对治疗方案知情同意,在首次诊断BRVO后采用1+PRN治疗方案,按照标准的无菌操作程序给予康柏西普玻璃体腔注射,以后每月复查,每次复诊进行BCVA、眼内压、裂隙灯生物显微镜、眼底镜、黄斑OCT检查,FFA检查仅用于怀疑病变进展或视网膜缺血的患者。玻璃体腔抗VEGF重复注射标准[13]:(1)视力较前次随访下降≥1行;(2)OCT显示CMT较前次随访增加≥100μm。重复治疗的注射药物及剂量同首次注射。
1.2.2随访观察所有患者首次注药后至少定期随访6mo,记录注射次数;检测两组患者BCVA,结果转换为最小分辨角对数(LogMAR)视力进行统计分析,并计算两组患者BCVA变化值(玻璃体腔注药后BCVA-基线时BCVA);采用OCT检测CMT,计算CMT的变化量(玻璃体腔注药后CMT-基线时CMT),根据OCT扫描结果评估玻璃体黄斑粘附状态(粘连范围直径<1 500μm为局灶性VMA,粘连范围直径>1 500μm为广泛性VMA)及黄斑部PVD发生情况,玻璃体后界膜与黄斑中心凹完全分离视为发生了黄斑部PVD。治疗前及随访过程中每次OCT检查扫描部位及轴位相同,并由1名临床医师和1名OCT技术人员分别阅片。
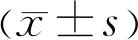
2结果
2.1玻璃体腔注射情况随访至首次注药后6mo,VMA+组患者平均进行玻璃体腔注射2.91±1.05次,VMA-组患者平均进行玻璃体腔注射3.08±1.22次,两组差异无统计学意义(t=0.107,P=0.915)。
2.2治疗后BCVA情况首次注药后第6mo时,VMA+组患者的BCVA为0.50(0.20,0.83)LogMAR,VMA-组患者的BCVA为0.65(0.40,1.00)LogMAR,与基线时相比较,两组患者BCVA均改善,差异均有统计学意义(ZVMA+组=-4.244,PVMA+组<0.001;ZVMA-组=-5.798,PVMA-组<0.001),且VMA+组患者BCVA变化值为-0.20(-0.33,-0.10)LogMAR,VMA-组患者BCVA变化值为-0.20(-0.30,-0.10)LogMAR,两组患者BCVA变化值相比较,差异有统计学意义(U=-2.044,P=0.041),表明VMA+组患者视力改善更明显。
2.3治疗后CMT情况首次注药后第6mo时,VMA+组患者CMT为235.00(175.75,297.50)μm,VMA-组患者CMT为230.00(189.00,340,25)μm,与基线时相比较,两组患者CMT均降低,差异均有统计学意义(ZVMA+组=-4.583,PVMA+组<0.001;ZVMA-组=-7.229,PVMA-组<0.001),且VMA+组患者CMT变化值为-250.00(-509.75,-86.50)μm,VMA-组患者CMT变化值为-269.50(-440.50,-89.50)μm,两组患者CMT变化值相比较,差异无统计学意义(U=-0.110,P=0.914)。
2.4 VMA+组患者黄斑部PVD发生情况随访6mo,VMA+组患者中3眼基线时为局灶性VMA的患眼均发生黄斑部PVD(100.0%),基线时为广泛性VMA的患者31眼中5眼发生了黄斑部PVD(16.1%),差异有统计学意义(P=0.009),表明局灶性粘连较广泛性粘连的患者更易发生黄斑部PVD。VMA+组患者发生黄斑部PVD者共8眼(其中3眼发生在首次注药后,4眼发生在第2次注药后,1眼发生在第4次注药后),未发生黄斑部PVD即持续存在VMA者26眼(其中3眼由广泛性粘连变为局灶性粘连,23眼玻璃体黄斑界面无变化),发生黄斑部PVD的患者年龄(56.13±11.15岁)与持续存在VMA的患者年龄(55.58±10.32岁)差异无统计学意义(t=0.126,P=0.900)。与基线时相比,发生黄斑部PVD的8眼首次注药后第6mo时BCVA变化值为-0.30(-0.83,-0.20)LogMAR,而持续存在VMA的26眼BCVA变化值为-0.20(-0.30,-0.10)LogMAR,差异无统计学意义(U=53.000,P=0.057);发生黄斑部PVD的8眼首次注药后第6mo时CMT变化值为-543.00(-1036.25,-146.50)μm,而持续存在VMA的26眼CMT变化值为-220.00(-443.00,-70.00)μm,差异无统计学意义(U=60.000,P=0.124),但基线时发生黄斑部PVD与持续存在VMA的患者CMT差异有统计学意义[756.00(454.20,1211.00)μmvs470.00(330.75,717.00)μm,U=49.000,P=0.041],提示基线时CMT更高者可能更易发生黄斑部PVD。图1所示为同一患者治疗前后OCT检查情况。

图1同一患者治疗前后OCT检查情况A:治疗前存在局灶性玻璃体后粘连;B:首次注药后2mo出现黄斑部玻璃体后脱离。
表1 两组患者基线资料的比较

组别眼数男/女(例)年龄( x±s,岁)BCVA[M(P25,P75),LogMAR]CMT[M(P25,P75),μm]RVO类型(缺血性/非缺血性,眼)VMA+组3413/2159.34±8.150.75(0.48,1.30)543.00(361.75,774.50)9/25VMA-组7643/3360.44±8.430.90(0.50,1.30)561.00(402.00,750.75)23/53 χ2/t/Z3.1630.647-0.927-0.5500.454P0.0990.5190.3540.5820.656
3讨论
近年来,VMA与VEGF相关的视网膜血管性疾病的关系受到了广泛关注,部分报道提示VMA在黄斑病变的发展中起到关键作用[4-11],可能对患者抗VEGF的疗效产生影响,这些报道多针对wARMD、DR等[14-15]。目前国内外很少有研究报道VMA对BRVO患者抗VEGF治疗疗效的影响。
本研究结果显示,基线时VMA+组与VMA-组患者的CMT和BCVA无统计学差异,表明VMA的存在并不影响BRVO继发黄斑水肿的严重程度。但Lee等[14]关于wARMD的研究认为VMA的持续存在加重了黄斑水肿程度,与本研究结果存在差异,分析可能是由于玻璃体后皮质(PVC)是细胞增生迁移及新生血管的生长支架[16],BRVO为急性起病,静脉阻塞后玻璃体腔内VEGF上调、细胞因子和趋化因子等炎性因子骤增是黄斑水肿的根本原因[17],而新生血管渗漏继发黄斑水肿不占主导地位,所以未观察到VMA对黄斑水肿程度的影响;wARMD病程较长,VMA持续存在对黄斑部微环境产生影响,新生血管反复生长并机化,反复破坏Bruch膜,易出现玻璃体黄斑界面的粘连,所以更易观察到VMA对wARMD黄斑水肿造成的影响[14]。
在本研究中,VMA+组与VMA-组患者使用抗VEGF药物注射治疗均获得了良好的临床效果,且VMA+组患者获得了更佳的BCVA增益。分析可能的原因是由于抗VEGF药物进入玻璃体腔内,VMA的形态特点可能更有利于药物积聚于黄斑中心凹,在病变部位持续产生作用,而VMA-组患者眼内药物相对弥散。同时,VMA+组患者玻璃体腔内药物清除率可能更低[7]。Terao等[18]研究也表明,VMA+组患者不仅BCVA增益更佳,且CMT降低也更多,且VMA的存在与BCVA的变化呈正相关,与CMT的变化呈负相关,其认为BRVO伴VMA对抗VEGF治疗更敏感。Singh等[17]研究表明,RVO患者玻璃体黄斑粘附状态与抗VEGF治疗结果之间无联系,这与我们的研究结果不同,可能与纳入标准不同且分组差异有关。李石磊等[19]研究发现,BRVO患者抗VEGF治疗6mo后VMA-组与VMA+组在BCVA和CMT均获得了显著的改善,VMA-组较VMA+组CMT改善更佳,其认为VMA可能会在一定程度上减弱抗VEGF治疗疗效,本研究与其研究结果的差异可能与纳入人群玻璃体黄斑界面特征不同有关,其研究纳入VMA+组的部分患者在随访过程中出现VMT,并有1例患者最终因黄斑中心牵拉明显需要手术治疗。本研究在纳入病例时排除了存在VMT和ERM的患者,纳入VMA+组的患者在6mo随访期间均未出现VMT。Azad等[20]报道,存在VMA的糖尿病黄斑水肿患者在抗VEGF注射治疗后BCVA有明显改善,CMT显著降低,排除VMT后,单独存在的VMA可能不会对治疗结果产生不利影响。Gao等[21]报道,wARMD患者抗VEGF治疗过程中,VMA或VMT的存在可能削弱了抗VEGF药物的作用,此类患者需要更多的强化治疗。Iacono等[22]研究对高度近视引起的脉络膜新生血管(CNV)进行雷珠单抗注射治疗,结果显示VMT、VMA、黄斑裂孔、ERM等玻璃体黄斑界面改变不会影响抗VEGF治疗疗效,存在VMA的患者可观察到视力改善。上述研究结果表明,在不同的疾病中,VMA可能对抗VEGF治疗产生不同的影响。
我们发现,首次玻璃体腔注射后第6mo时,VMA+组中发生黄斑部PVD的8眼BCVA改善较持续存在VMA的26眼更佳,但差异无统计学意义(P=0.057),提示PVD可能对视力预后产生良性影响。PVD发生后,可有效去除增加视网膜血管通透性的细胞因子、促进内源性VEGF从黄斑区消散以及增大氧的扩散系数,改善后极部视网膜供氧,高氧含量可降低黄斑区VEGF水平并引起视网膜血管收缩,玻璃体腔内氧含量的增加,还可减少血管渗漏,从而减少与BRVO相关的黄斑水肿[11]。Terao等[18]研究中VMA+组有4眼发展为PVD,由于样本量小,并未对PVD眼与持续存在VMA眼进行对照比较,但通过其描述可以发现,发生PVD患者的预后均较好。既往研究显示,与未发生PVD的患者相比,发生PVD的BRVO患者新生血管形成和黄斑水肿的发生率更低,PVD发生后可能减少了视网膜或视盘新生血管形成,从而有利于疾病的预后,研究者认为玻璃体是牵拉Müller细胞导致持续黄斑水肿的原因,也是将药理学因素传递到视网膜的介质[23-25],其中的确切机制尚不清楚,但这也可以解释存在VMA的患者在早期抗VEGF治疗后有较好的视觉收益,同时也提醒我们对于BRVO患者需要早诊断、早治疗。Arai等[11]研究结果表明,BRVO患者在玻璃体切除术中行人工PVD后不仅能有效减少黄斑水肿,还可提高视力。由于样本量有限,随访时间较短,本研究未分析BRVO患者发生PVD后抗VEGF治疗的远期效果,这有待于进一步研究,但是从短期结果来看,PVD对BRVO患者抗VEGF治疗的预后可能是增益的。
本研究纳入VMA+组的患者中,基线时为局灶性VMA的3眼均发生黄斑部PVD(100.0%),基线时为广泛性VMA的患者31眼中5眼发生了黄斑部PVD(16.1%),表明与广泛性VMA患者相比,局灶性VMA患者更有可能在疾病过程中出现PVD。在Khanduja等[26]和董琪等[27]研究中也观察到了类似的结果。此外,发生黄斑部PVD与持续存在VMA的患者相比,发生黄斑部PVD者基线CMT更高(P=0.041),提示基线时CMT值较大者可能更容易发生PVD,可能与抗VEGF治疗后黄斑水肿快速消退有关,当然也存在黄斑裂孔形成的可能[28],但在本研究随访期内并未观察到黄斑牵拉或撕裂等并发症。
综上所述,BRVO患者合并VMA时抗VEGF治疗后视力改善的潜力更大,故VMA的存在不妨碍抗VEGF治疗BRVO的疗效,提示我们在临床治疗中,关于BRVO治疗方案的选择、预后的评估中,应关注玻璃体黄斑界面的解剖特征。但由于本研究纳入样本量较小,且随访时间相对较短,如要进一步明确VMA对BRVO患者抗VEGF疗效的影响,则需要更大的样本量和更长的随访时间进行观察。
- 国际眼科杂志的其它文章
- Serum vitamin D in Indian children with vernal keratoconjunctivitis
- 汉族与哈萨克族PACG患者房水及小梁网中TGF-β2的表达与滤过泡形成的研究
- 基于Nrf2/Keap1/ARE通路研究槲皮素对小鼠年龄相关性黄斑变性的保护作用
- Deep anterior lamellar keratoplasty versus penetrating keratoplasty in the treatment of stromal corneal dystrophies
- 五种方法测量近视患者中央角膜厚度的研究
- 常见泪腺上皮性肿瘤中EGFL7的表达及其与血管生成和细胞增殖活性的相关性研究

