冬瓜多糖的提取及其生物活性的研究
詹亦贝,周楷旋,汪铭轩,胡 菲
(湖北理工学院 化学与化工学院,湖北 黄石 435003)
随着科学技术的进步与发展,国内外大量的科研人员对多糖这类生物活性物质进行了提取、分离纯化、生物活性及作用机理等各方面的研究,证实了其具有免疫调节[1]、抗肿瘤[2]、抗氧化[3]、抑菌性[4]、降血脂[5]、护肝[6]等多方面生理功能。植物多糖对于人体内产生的自由基具有很好的清除效力,并且可通过改变细胞膜、壁的结构和功能,抑制微生物的生长[4]。另外,研究表明抗肿瘤药物一般是直接杀死细胞,而多糖对于正常细胞表现出无毒性,香菇多糖通过影响一些关键酶的活性或调节免疫系统,从而加强化疗药对肿瘤的作用[7]。
冬瓜属葫芦科,一年生草本,是传统食品,因其外观和颜色,又被称之为白瓜、枕瓜等。冬瓜原产于中国,全国各地均有种植,属于生活中常见蔬菜之一,其显著特点是产量高、无脂、低钠、碳水化合物含量高;具有清热利水、消肿之功效,对动脉硬化、水肿膨胀、肝硬化、肝腹水、冠心病、高血压、肾炎,甚至是糖尿病等慢性疾病,都有相对良好的治疗作用[8-9]。总之,冬瓜是价廉物美的蔬菜,同时也是功能食品原料。目前对冬瓜水溶性多糖的研究报道较少。鉴于多糖具有许多生理功能,本文以水作为提取剂来提取冬瓜多糖并优化提取工艺,探索了冬瓜多糖的抗氧化性和抑菌性,为冬瓜多糖在食品和医药等行业的开发与利用提供了一定的理论基础。
1 材料和方法
1.1 材料与试剂
材料:本地市售冬瓜;供试菌:大肠杆菌;枯草芽孢杆菌;金黄色葡萄球菌;酵母;黑曲霉;葡萄糖;苯酚;胰蛋白胨酵母提取物;三羟甲基氨基甲烷(天津市天力化学试剂有限公司)。
1.2 仪器与设备
AR2140电子天平,奥豪斯仪器有限公司;SHZ-D(Ⅲ)循环水真空泵,巩义予华仪器有限公司;BC-R203旋转蒸发仪,上海贝凯生物化工设备有限公司;H1850离心机,湖南湘仪实验室仪器开发有限公司;UV1800紫外分光光度计,日本岛津公司;LDZX-50KBS立式压力蒸汽灭菌器,上海申安医疗器械厂;KYC-1112恒温培养摇床,上海福玛实验设备有限公司。
1.3 试验方法
1.3.1冬瓜预处理
取市售的新鲜冬瓜,洗净,去1~2 mm皮,弃瓜瓤,乙醇浸洗5 min,切块,-20 ℃冰冻过夜,研磨成泥状。
1.3.2冬瓜多糖的提取及其工艺优化
本试验用水作为提取剂提取冬瓜多糖并用乙醇沉淀,首先利用单因素试验法分别研究提取温度、提取时间和料液比3种因素对冬瓜多糖提取率的影响,然后根据Box-Benhnken的中心组合试验设计原理,选取提取时间、提取温度和料液比进行三因素三水平的响应面分析试验[10-11],对提取冬瓜多糖的这3种因素进行工艺优化,最终确定冬瓜多糖的最佳提取工艺参数。
1.3.3Sevag法纯化多糖
采用Savag法去除冬瓜粗多糖中的蛋白[12],配制氯仿-正丁醇(5∶1体积比)的Sevag试剂,冬瓜粗多糖溶液与Sevag试剂按5∶1比例混合,室温充分振摇30 min,离心取上清液;用此方法将上清液再处理5~6次直至无蛋白乳化层,纯化后的冬瓜多糖使用乙醇沉淀再低温烘干备用。
1.3.4冬瓜多糖含量的测定
采用苯酚-硫酸法[13]利用紫外分光光度计测定冬瓜多糖的吸光度,以葡萄糖的浓度(mg/mL)为横坐标,以溶液吸光度为纵坐标,绘制葡萄糖溶液标准曲线,计算回归方程为:y=9.62522x+0.0513,相关系数R2=0.9927,按照回归方程计算多糖的含量。
1.3.5抗氧化性试验
1.3.5.1羟基自由基清除率的测定
羟基自由基清除率的测定参考Lu等[14-15]的方法,并有所改动。体系内经过一系列化学反应,得到复合物在510 nm处有强烈吸收峰。反应体系:1.0 mL的10 mM的水杨酸乙醇溶液和1.0 mL的冬瓜多糖溶液,混合均匀后,加入1.0 mL的FeSO4(10 mM)溶液,震荡1~2 min,再加入4 mL的300 μM的H2O2,37 ℃水浴30 min,冷却至室温,在510 nm下测其吸光度A1;A0为不加冬瓜多糖的吸光度;A2为H2O2溶液改用H2O并加入冬瓜多糖的吸光度。由于维生素C(Vc)具有良好的抗氧化性,因此选用Vc作阳性对照。
(1)
1.3.5.2DPPH自由基清除率的测定
DPPH自由基清除率的测定参考Blois等[15-16]的方法,并加以改动。体系内经过一系列化学反应,得到复合物在517 nm处有强烈吸收峰。反应体系:2 mL冬瓜多糖溶液和去离子水3.6 mL,再加入0.4 mL的DPPH自由基的乙醇溶液(0.4 mM),震荡数分钟,25 ℃水浴30 min。取出后在517 nm下测其吸光度A3;A4为DPPH自由基改用乙醇并加入冬瓜多糖的吸光度;A0为不加冬瓜多糖的吸光度,并用Vc作阳性对照。
(2)
1.3.6抑菌性试验
1.3.6.1供试菌种的活化及菌液的制备
预先将5种供试菌种接入LB液体培养基(约1%的含菌量),置于适宜条件下活化过夜,加入生理盐水稀释10~100倍,摇匀后,制得浓度为106~108CFU/mL的菌液,备用。
1.3.6.2冬瓜多糖抑菌能力测定
采用琼脂扩散滤纸片法和光电比浊法[17-18]测定冬瓜多糖的抑菌能力,将定性滤纸加工裁剪成15 mm左右的圆形滤纸片,灭菌,置于不同浓度的冬瓜多糖溶液中浸泡20 min,自然晾干,备用。倒入固体培养基,待固体培养基冷却凝固后,分别加入100 μL菌液,涂布均匀,室温下,静置生长15 min,水平贴上已处理的滤纸片,滤纸片间隔1 cm左右,并以浸泡过灭菌水的滤纸片作为对照,测其抑菌圈的直径。
取3个150 mL的锥形瓶分别加入39 mL已灭菌的通用液体培养基,待冷却后再分别加入10 mL生理盐水和已灭菌的冬瓜多糖溶液(50 mg/mL),然后将配置好的金黄色葡萄球菌悬液分别取1 mL加入这3个锥形瓶。在接下来的28 h内,共取样液18次。每次取完样液点后重新将锥形瓶放回恒温摇床上振荡,立刻测其吸光度,绘制其生长曲线。
2 结果讨论
2.1 单因素试验
2.1.1提取温度对冬瓜多糖提取率的影响
提取温度对冬瓜多糖提取率的影响如图1所示。当提取温度为70 ℃时,冬瓜多糖的提取率为0.65%;随着温度的升高,冬瓜多糖的提取率也逐渐升高,当提取温度达到90 ℃时,提取率达到最大值0.854%;当温度达到100 ℃时,提取率有所下降。这可能是由于温度过高,破坏了冬瓜多糖的组织结构,导致部分冬瓜多糖分解,因此其提取率有所下降。
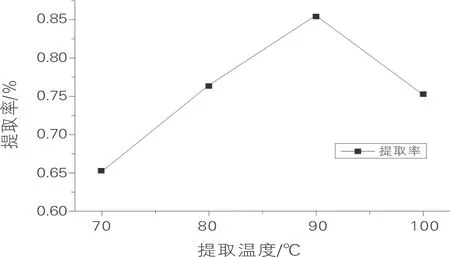
图1 提取温度对冬瓜多糖提取率的影响
2.1.2提取时间对冬瓜多糖提取率的影响
提取时间对冬瓜多糖提取率的影响如图2所示。当提取时间为1.5 h时,冬瓜多糖的提取率为0.63%;随着时间的增加,冬瓜多糖的提取率也逐渐升高,当提取时间达到2 h,冬瓜多糖的提取率达到最大值0.754%;当时间达到2.5 h,多糖提取率下降至0.74%;当时间达到3 h,提取率继续下降。试验结果显示,提取时间在2 h时冬瓜多糖的提取率达到最高,长时间的加热可能会使多糖的部分链断裂,从而使多糖链变短导致后续用乙醇沉淀出来的多糖变少,最终导致提取率降低。

图2 提取时间对冬瓜多糖提取率的影响
2.1.3料液比对冬瓜多糖提取率的影响
料液比对冬瓜多糖提取率的影响如图3所示。当料液比为5∶1时,冬瓜多糖的提取率为0.67%;当料液比为2∶1时,冬瓜多糖提取率达到最大值0.851%;当料液比为1∶1时,冬瓜多糖提取率下降至0.78%。这可能是提取剂的用量改变了胞内外的浓度差,促进胞内多糖扩散,然而冬瓜原材料本身含有大量的水,所以提取最适的料液比为2∶1。

图3 料液比对冬瓜多糖提取率的影响
2.2 响应面法优化工艺
2.2.1冬瓜多糖提取试验方案和因素水平
根据单因素试验结果,选取提取时间(A)、提取温度(B)、料液比(C)这3个因素,采用三因素三水平的Box-Behnken试验设计法。响应面分析因素与水平见表1。

表1 响应面分析因素与水平
2.2.2响应面分析
以提取温度、料液比、提取时间为变量,以冬瓜多糖提取率为响应值,以-1,0,1分别代表变量的水平,响应面试验设计方案及结果见表2。所得数据经Design Expert 8.0.6软件进行多元线性回归分析,得回归方程:
Y=-9.3208+0.9A+0.20853B+0.2731C-2.4822×10-3AB+0.0327AC-9×10-5BC-0.10851A2-1.17471×10-3B2-0.08396C2。

表2 响应面试验设计方案及结果
模型回归系数显著性检验结果见表3。多元回归方程中各提取因素(自变量)对冬瓜多糖提取率(响应值)影响的显著性是由P值来判定,一次项B和二次项C2是显著,二次项A2是极其显著,各提取因素对冬瓜多糖提取率的影响是多元线性关系而并非简单的线性关系。根据F值的大小推断,3个提取因素对冬瓜多糖提取率的影响排序为:提取温度(B)>料液比(C)>提取时间(A)。
根据响应面优化设计方案,所得试验数据经Design Expert 8.0.6软件分析计算,不同提取因素对冬瓜多糖提取率的影响如图4所示。通过对回归方程求导和用Design Expert 8.0.6软件进行分析计算,最终确定冬瓜多糖的最佳提取工艺参数为:提取时间2.23 h、提取温度86.32 ℃、提取料液比2.05∶1,在该条件下冬瓜多糖的提取率为0.959 2%。按最佳提取工艺提取多糖,3次平行组试验的结果表明最佳提取率平均值为0.963 3%,与响应面分析预测值接近,即该方程与实际情况拟合较好,因此响应面法适用于冬瓜多糖的提取工艺优化。

表3 模型回归系数显著性检验结果
注:*P<0.05,差异显著;**P<0.01,差异极显著。

(a) 提取时间和提取温度 (b) 提取时间和料液比 (c) 提取温度和料液比
2.3 冬瓜多糖的生物活性研究
2.3.1冬瓜多糖的抗氧化性研究
按照1.3.5.1的方法测定冬瓜多糖和Vc对羟基自由基的清除效果如图5所示。冬瓜多糖对羟基自由基的清除效果没有Vc显著,IC50(半数清除率)为0.913 mg/mL,比Vc的0.401 mg/mL要高。

图5 冬瓜多糖和Vc对羟基自由基的清除效果
冬瓜多糖和Vc对DPPH自由基的清除效果如图6所示。冬瓜多糖对DPPH自由基的清除效果优于Vc,其IC50为0.221 mg/mL。

图6 冬瓜多糖和Vc对DPPH自由基的清除效果
2.3.2冬瓜多糖的抑菌性研究
2.3.2.1冬瓜多糖对5种供试菌的抑菌效果
15 mg/mL的冬瓜多糖对5种供试菌种的抑菌圈直径见表4。冬瓜多糖对金黄色葡萄球菌的抑菌效果最佳,在15 mg/mL时其抑菌圈直径可达到1.83 cm;对大肠杆菌和枯草芽孢杆菌的抑制效果则次之,相对于黑曲霉和酵母则不表现抑菌性。

表4 冬瓜多糖对5种供试菌种的抑菌圈直径 cm
注:表中数据为3次重复试验的平均值;“-”表示没有抑菌圈。
2.3.2.2冬瓜多糖对细菌生长的影响
采用光电比浊法动态测定冬瓜多糖对大肠杆菌和金黄色葡萄球菌生长的影响。对照组为未添加冬瓜多糖的生理盐水。冬瓜多糖对大肠杆菌和金黄色葡萄球菌生长的影响分别如图7、图8所示。由图7和图8可见,冬瓜多糖对大肠杆菌和金黄色葡萄球菌的生长均有较强的抑制作用。

图7 冬瓜多糖对大肠杆菌生长的影响

图8 冬瓜多糖对金黄色葡萄球菌生长的影响
2.3.2.3冬瓜多糖的最低抑菌浓度
以金黄色葡萄球菌为例,用琼脂扩散滤纸片法,以抑菌圈直径为指标判定冬瓜多糖样品的抑菌效果,对每种测试菌作3个平行样,取平均值。不同浓度的冬瓜多糖对金黄色葡萄球菌的抑菌效果见表5。由表5可看出冬瓜多糖对金黄色葡萄球菌的抑菌效果十分明显,最低抑菌浓度为5 mg/mL。
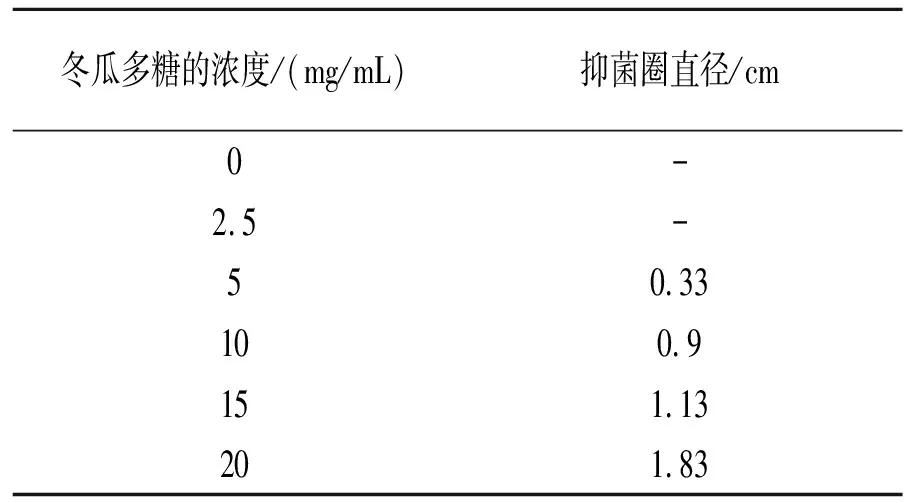
表5 不同浓度的冬瓜多糖对金黄色葡萄球菌的抑菌效果
注:表中数据为3次重复试验的平均值;“-”表示没有抑菌圈。
3 结论与展望
本研究采用水提醇沉法提取冬瓜多糖。为进一步优化提取多糖工艺,本试验探索了提取时间、提取温度、提取料液比3个因素对冬瓜多糖提取率的影响。通过单因素试验和响应面分析法对提取工艺进行优化,冬瓜多糖提取率的影响因素排序为:提取温度>料液比>提取时间;冬瓜多糖的最佳提取工艺参数为:提取时间2.23 h、提取温度86.32 ℃、提取料液比2.05∶1,在该条件下冬瓜多糖的提取率为0.96%。优化后的提取工艺省时且节能,是一种稳定可行的良好方法。
冬瓜多糖在体外清除自由基方面显示较强的能力,冬瓜多糖对羟基自由基具有一定的清除效果,但与Vc的清除效果相比则相对较弱;对DPPH自由基具有很好的清除效果,且清除效果较Vc略强,同时也表明冬瓜多糖对不同的自由基具有不同抗氧化作用效果。多糖在生物体内的抗氧化性与在体外的抗氧化性的作用机制是截然不同的,在体内的抗氧化作用机制十分复杂,除了体内自由基的猝灭途径外,还会通过调节生物体体内抗氧化酶的活性或补充外源性抗氧化剂来参与作用[19],因此,后续研究可以进一步探索冬瓜多糖在生物体内抗氧化活性及其机理。
多糖对不同微生物的生长有着不同程度的影响,冬瓜多糖浓度为15 mg/mL时对黑曲霉和酵母均无明显抑制效果,冬瓜多糖对大肠杆菌、金黄色葡萄球菌及枯草芽孢杆菌都有较强的抑制作用,以金黄色葡萄球菌最为显著,其最低抑菌浓度(MIC)为5 mg/mL。对冬瓜多糖的其他生物活性如抗肿瘤、免疫调节等还有待进一步研究。本研究为冬瓜多糖在食品和医药等行业的开发与利用提供了一定的理论基础。

