浒苔多糖的分离纯化及其结构和抗氧化活性研究
王晔,娄永江,龚芳芳,陈淑敏,张玉琦,刘英丹,孟天宇,李勇勇
(宁波大学,浙江 宁波,315211)
浒苔(Enteromorphaprolifera)俗称苔条,广泛生长于江苏、浙江等东南沿海地区,是一种重要的经济海藻[1]。浒苔的营养价值很高,其脂肪含量低,蛋白质、纤维素及微量元素等含量丰富,还拥有独特的风味,深受人们的喜爱[2]。随着人们对浒苔研究的深入,浒苔已经被广泛地应用于工业、农业、医药和食品等行业[3]。
多糖(polysaccharides, PS)是由单糖通过糖苷键的线性以及分支连接而成,是构成生命活动的重要大分子化合物。在传统用途中,多糖主要用于化工医药基料、食品的乳化剂和增稠剂等[4]。随着分子生物学的发展,研究人员发现多糖还具有增强机体免疫力、抗氧化、防衰老、抗肿瘤、护肝和降血糖的作用[5]。而多糖的抗氧化作用是实现防衰老、抗肿瘤、护肝和降血糖等功效的重要途经之一,主要是通过直接清除生物、化学和物理来源的多种活性氧(reactive oxygen species, ROS),如DPPH 自由基,羟自由基和超氧阴离子等来实现的[6-7]。
虽然目前研究者对海藻中的化学组分进行过研究,并且发现了一系列新型的化合物,但并没有对生理活性物质深入系统的研究。本文通过正交实验设计,优化浒苔多糖(Enteromorphaproliferapolysaccharide,EPP)的提取工艺,并对浒苔多糖进行分离纯化和结构表征,并对浒苔多糖的不同组分进行氧化活性研究和对比,以期为浒苔多糖的开发利用提供参考依据。
1 材料与方法
1.1 材料与试剂
浒苔采自浙江宁波象山。
牛血清蛋白(BSA)、考马斯亮蓝G-250:分析纯, 阿拉丁试剂公司;氯仿、正丁醇、苯酚、浓H2SO4、NaCl、HCl,分析纯。DEAE-52纤维素,景航科技有限公司。
1.2 仪器与设备
YC-2低温层析柜,北京亚泰仪器科隆有限公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;HX-10-50DG台式压盖多歧管冷冻干燥机,上海沪析实业有限公司; NICOLET 6700智能型傅立叶红外光谱仪(FTIR)热电(上海)科技有限公司;1515凝胶渗透色谱仪,美国Waters公司;T6新锐可见分光光度计,北京普析通用仪器有限责任公司。
1.3 实验方法
1.3.1 多糖的提取工艺流程
将浒苔用超纯水冲洗干净后置于105 ℃干燥箱中烘干至恒重,粉碎过目密封后放入干燥器中备用。称取不同目数的浒苔粉5 g,加入一定量的超纯水混匀,在不同时间、温度下超声波辅助提取,6 000 r/min离心10 min。取上清液浓缩至50 mL,将浓缩后的上清液和Sevege试剂[V(氯仿)∶V(正丁醇)=4∶1的混合溶液,现配现用]倒入分液漏斗中,剧烈振荡15 min,静置30 min,将有机溶剂层和蛋白质层弃去,重复以上操作直至没有蛋白质层出现。用旋转蒸发仪除去氯仿,透析72 h,冷冻干燥得到浒苔粗多糖。
1.3.2 单因素实验
准确称取10~20目、20~30目、30~40目、40~60目、60~80目的浒苔样品5 g,在恒定条件(液料比为40∶1、浸提温度60 ℃,浸提时间为60 min)下超声(200 W)辅助提取,以考察不同目数对ESP得率的影响;根据上述方法固定其他因素:温度(40、50、60、70、80 ℃)、时间(30、60、90、120、150 min)、液料比(10∶1、20∶1、30∶1、40∶1、50∶1),分别测得对粗多糖得率的影响。多糖得率计算如公式(1)所示:

(1)
1.3.3 正交实验
在单因素得基础之上,采用L9(34)对单因素进行正交实验设计。
1.3.4 多糖的分离纯化
称取40 mg的浒苔粗多糖,溶于5 mL的超纯水中,上样到DEAE-52纤维素层析柱(1.6 cm×60 cm),依次用不同浓度的NaCl溶液(0、0.75、1.5、2.25、3 mol/L)洗脱,8 min收集1管,收集50管,以苯酚-硫酸显色法测定每管洗脱液的吸光度并记录。合并主要吸收峰的洗脱液,浓缩后在超纯水中透析除去NaCl,冷冻干燥得精多糖。
1.3.5 浒苔多糖中总糖和蛋白质含量的测定
苯酚-硫酸法测总糖[8],Bradford 法测定多糖中蛋白质[9]。
1.4 浒苔粗多糖氧化活性的测定
1.4.1 羟自由基清除能力的测定
参照YANG等[10]的方法,在体积比为1∶1的100 μL 0.3 mol/L的5,5′-二甲基-1-吡啶-氧化物和10 mmol/L的FeSO4混合溶液中加入多糖待测液,配制液质量浓度为0、0.4、0.8、1.2、1.6、2 mg/mL,然后加入50 μL 10 mmol/L的H2O2溶液,最后将反应混合液吸入毛细血管中,反应2.5 min后用Brucker A320光谱仪记录ESR光谱图。羟自由基清除率计算如公式(2)所示:
(2)
式中:H0,空白组ESR图谱第二峰信号强度;HX,实验组ESR图谱第二峰信号强度。
1.4.2 DPPH自由基清除能力的测定
参照HU等[11]的方法,将2 mL的质量浓度为0、0.2、0.4、0.6、0.8、1、1.2 mg/mL的待测溶液与2 mL 0.2 mmol/L的DPPH溶液在室温下避光混合摇匀,静置30 min。在517 nm处测定吸光度(A试样)。按照以上操作,分别测定A空白(空白为样品与无水乙醇各2 mL混合液)和A对照(对照为DPPH和无水乙醇各2 mL混合液)的吸光度。DPPH自由基清除率计算如公式(3)所示:
(3)
式中:A0、A试样、A对照分别为空白、试样和对照组的吸光度。
1.4.3 超氧阴离子清除力的测定
参考腾浩等[12]的方法,将0.5 mL质量浓度为0、0.2、0.4、0.6、0.8、1、1.2 mg/mL多糖样品溶液、4.5 mL的Tris-HCl缓冲液和0.1 mL 3 mmol/L的邻苯三酚溶液加入到10 mL的试管中,25 ℃水浴加热反应4 min。迅速加入HCl溶液终止反应,并在317 nm处测的吸光度,30 s间隔测1次,连续测3 min。不同组分的VC溶液为阳性对照,空白组为0.5 mL超纯水与4.5 mL Tris-HCl混合液;阴性对照组用超纯水代替多糖溶液,每组平行3次,取平均值。超氧阴离子清除率计算如公式(4)所示:
(4)
式中:A0和A1分别为样品溶液和阴性对照组的的吸光度。
1.5 红外光谱分析
在红外线灯下,将2 mg冻干浒苔粗多糖和分离组分和150 mg KBr用玛瑙研钵研磨至粒度小于2 μm,装入模具内制成透明薄片,然后置于FTIR光谱仪样品槽中,按照设定条件进行测定。测定前,为消除 KBr 的背景吸收,将纯KBr压片置于参考光路中。扫描范围为 400~4 000 cm-1,分辨率为 4 cm-1。同时做空白对照。
1.6 浒苔多糖纯度和分子质量的测定
准确称取2 mg浒苔多糖,配制成质量浓度为2 mg/L多糖溶液,用高效凝胶渗透色谱法(gel permeation chromtography,GPC)测定多糖分子质量。
2 结果与分析
2.1 单因素结果分析
2.1.1 浒苔粉碎目数对多糖得率的影响
在液料比为40 ∶1、浸提温度60 ℃、浸提时间60 min和超声辅助的条件下,测定浒苔粉目数对浒苔多糖提取的影响,目数设定为:10~20目、20~30目、30~40目、40~60目、60~80目。结果如图1所示。由图1可知,浒苔多糖得率随着目数的变小,呈现出先升高后降低的趋势,在30~40目时达到最大值13.31%,且各组浒苔多糖得率差异性显著。有研究表明,浒苔是由单层细胞围成管状或粘连为带状的鲜绿色藻类,细胞呈圆形,直径在30~60 μm。目数过大,浒苔粉碎不完全,细胞壁没有被破坏,与浸提剂的接触面积太小,从而导致浒苔多糖得率较低;目数过大,浒苔多糖的得率开始下降,可能是因为浸提操作过程中存在一定损失。

图1 浒苔粉碎目数对浒苔多糖得率的影响
Fig.1 Effect of mesh number on polysaccharide yield ofEnteromorphaprolifera
注;不同小写字母表示差异显著(P<0.05)(下同)
2.1.2 浸提时间对多糖得率的影响
在液料比40∶1、浸提温度60 ℃和目数40~60条件下,测定浸提时间对浒苔多糖得率的影响,时间设定为30、60、90、120、150 min,结果如图2所示。不同时间组的浒苔多糖得率存在显著性差异,随着浸提时间的延长,多糖得率不断增加,在90 min时达到最大值8.91%,当超过90 min时,多糖得率开始下降。热水浸提多糖是一个缓慢的过程,时间过短多糖溶解不够完全,而时间过长时,多糖的结构可能开始降解或被破坏,导致多糖得率降低[13-14]。
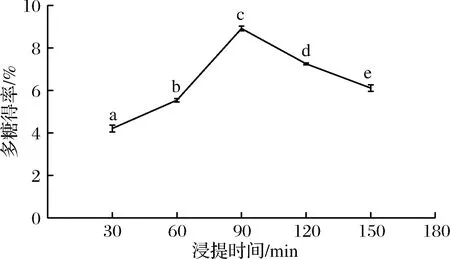
图2 浸提时间对浒苔多糖得率的影响
Fig.2 Effect of time on polysaccharide yield ofEnteromorphaprolifera
2.1.3 浸提温度对多糖得率的影响
在液料比为40∶1、浸提时间90 min和目数40~60目条件下,测定浸提温度对多糖得率的影响,温度设定为40、50、60、70、80 ℃,结果如图3所示。随着温度的升高多糖得率呈现上升的趋势,在超过60 ℃以后,多糖得率趋向于稳定,60、70 ℃多糖得率差异性不显著。这可能是因为当温度达到60 ℃以后,水溶性多糖的浸提比较完全。

图3 浸提温度对浒苔多糖得率的影响
Fig.3 Effect of temperature on polysaccharide yield ofEnteromorphaprolifera
2.1.4 液料比对多糖得率的影响
在浸提温度60 ℃、浸提时间90 min和目数40~60条件下,测得液料比对浒苔多糖得率的影响,液料比设定为:10∶1、20∶1、30∶1、40∶1和50∶1,结果如图4所示。液料比在30∶1时多糖的得率达到最大值12.32%。当液料比继续变大时,多糖得率开始下降,这可能是因为浸提液比过高,减弱了超声波对多糖提取的辅助作用,同时导致实验的操作难度加大从而样品损失率升高[15-16]。

图4 液料比对浒苔多糖得率的影响
Fig.4 Effect of liquid material ratio on polysaccharide yield ofEnteromorphaprolifera
2.2 多糖提取工艺的正交实验及结果分析
多糖提取工艺正交实验设计如表1所示,正交实验结果如表2所示。由表2可知各因素对浒苔多糖得率的影响程度为:A>C>B>D,即浒苔粉的目数>浸提温度>浸提时间>液料比。由表2的正交实验结果可知,浒苔多糖的提取最佳工艺组合为:A1B2C2D2,即在浒苔粉目数为30~40目、浸提时间90 min、浸提温度60 ℃和液料比为30∶1条件下,浒苔多糖达到最佳提取率16.34%。

表1 正交实验设计因素水平表Table 1 Response surface design factor level
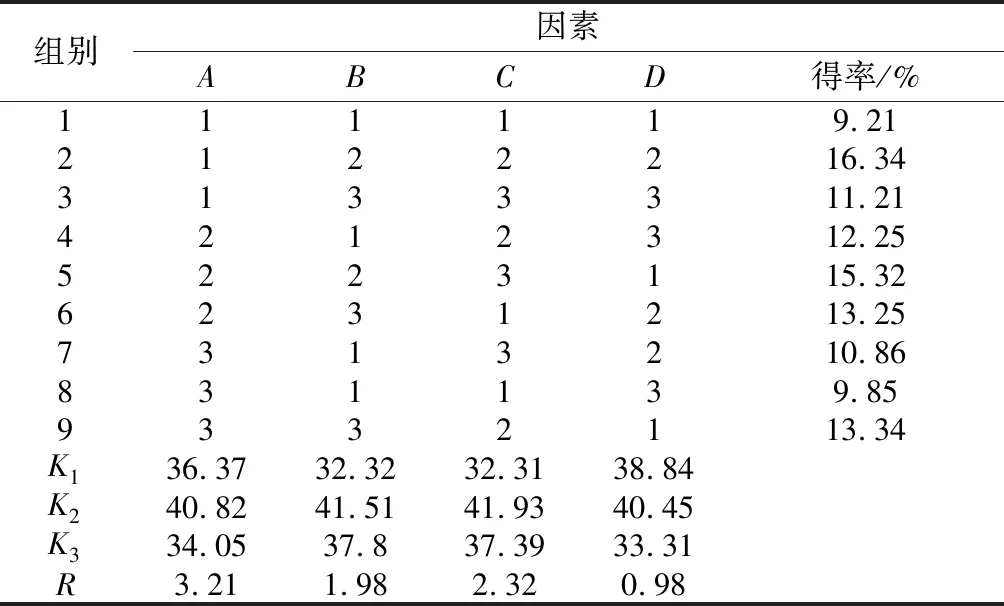
表2 正交实验结果Table 2 Orthogonal experiment results
2.3 浒苔多糖的DEAE-52纤维素柱层析结果分析
经热水浸提法提取的浒苔多糖为粗多糖,为了进一步测定和分析不同组分多糖的结构和抗氧化活性,对浒苔粗多糖进行分离纯化。称取40 mg冻干的浒苔粗多糖样品溶于5 mL的超纯水中,上样至DEAE-52离子交换柱,然后用0、0.75、1.5、2.25、3 mol/L的NaCl溶液进行洗脱,并测定洗脱液吸光度,经多次实验得出3个组分,分别命名为EPP-1、EPP-2、EPP-3。
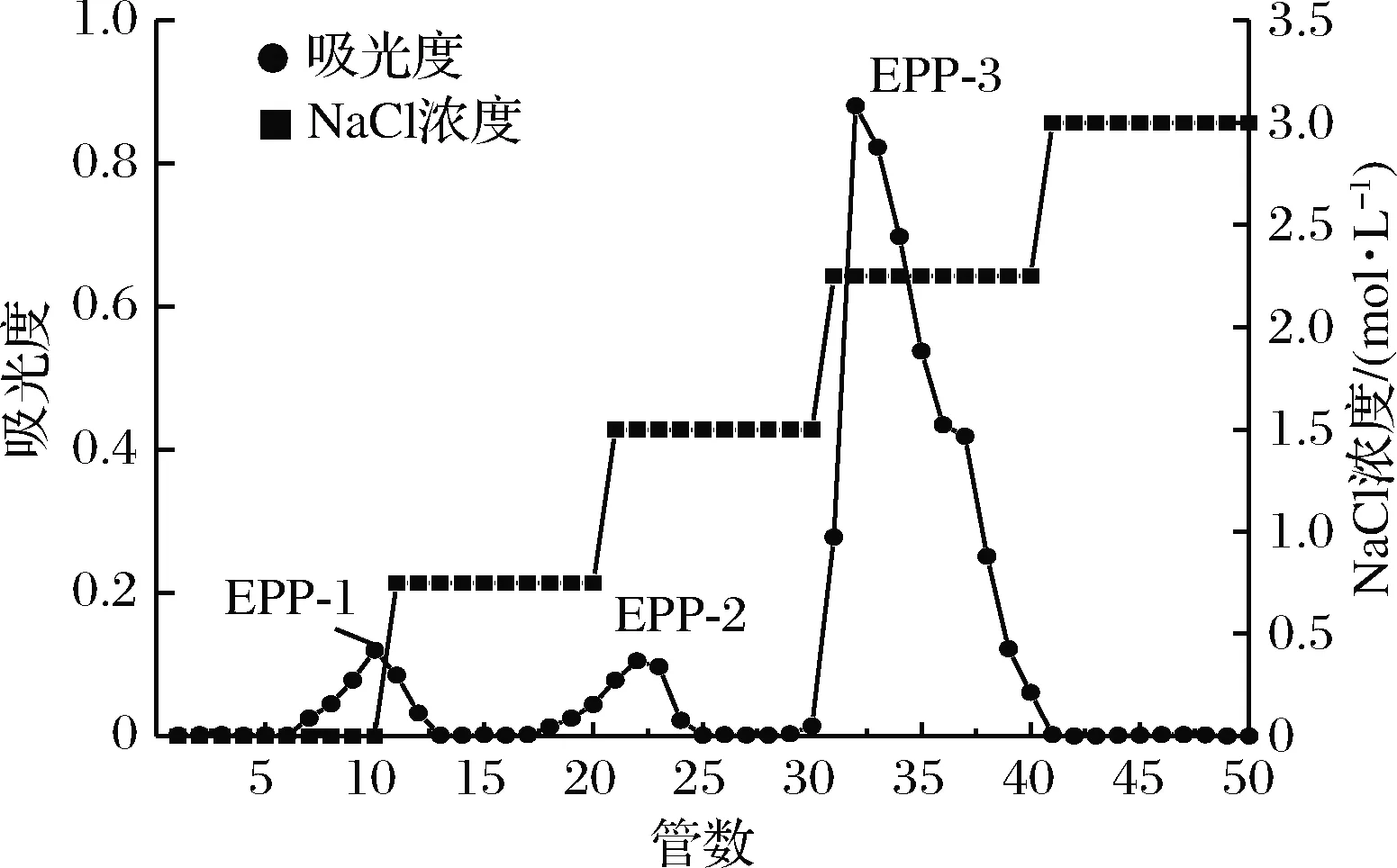
图5 浒苔多糖的DEAE-52层析分离图谱
Fig.5 DEAE-52 chromatogram ofEnteromorphaproliferapolysaccharides
2.4 浒苔多糖中总糖和蛋白的测定
采用苯酚-硫酸法测定多糖中总糖得含量,线性回归方程为:y=8.249x+0.002 1,R2=0.997。将测得的不同组分的吸光度带入公式计算总糖含量:EPP、EPP-1、EPP-2、EPP-3分别为35%、60.25%、59.87%和80.12%。对比发现纯化前后的总糖含量相差较大,说明纯化后去除了大部分杂质,纯化效果较好。采用考马斯亮蓝方法测定多糖中得蛋白质含量,用牛血清作为标准物质,得到回归方程:y=0.8114x+0.001 2,R2=0.998。计算EPP、EPP-1、EPP-2、EPP-3的蛋白含量分别为8%、0.01%、1.9%和0.05%。对比纯化前后的蛋白含量可以发现,经纯化后,蛋白含量接近于零,去除效果明显,说明本实验纯化后得到的多糖基本无蛋白残存。
2.5 浒苔多糖抗氧化活性研究
本研究以VC为阳性对照,通过测定DEAE-52层析柱分离纯化得到的浒苔多糖(EPP、EPP-1、EPP-2、EPP-3)清除羟自由基、DPPH自由基、超氧阴离子的能力来分析浒苔多糖的抗氧化能力。
2.5.1 羟自由基清除能力的测定结果
图6所示为浒苔粗多糖和3个多糖分离纯化组分(EPP-1、EPP-2、EPP-3)对羟自由基清除率的测定结果。在实验浓度范围内,多糖羟自由基清除率随着浓度的升高而增强,说明浒苔多糖的清除率可能有浓度依赖性,均对羟自由基有一定的清除能力,并且不同浓度之间差异性显著(P<0.05)。羟自由基清除率最高的为粗多糖,在浓度为2 mg/mL达到62.31%,其次为EPP-3,清除能力接近于粗多糖。这与宁可[17]研究结果一致。可能是因为多糖纯化过程中将具有清除能力的杂质去除或是透析不完全影响了浒苔多糖的清除能力。
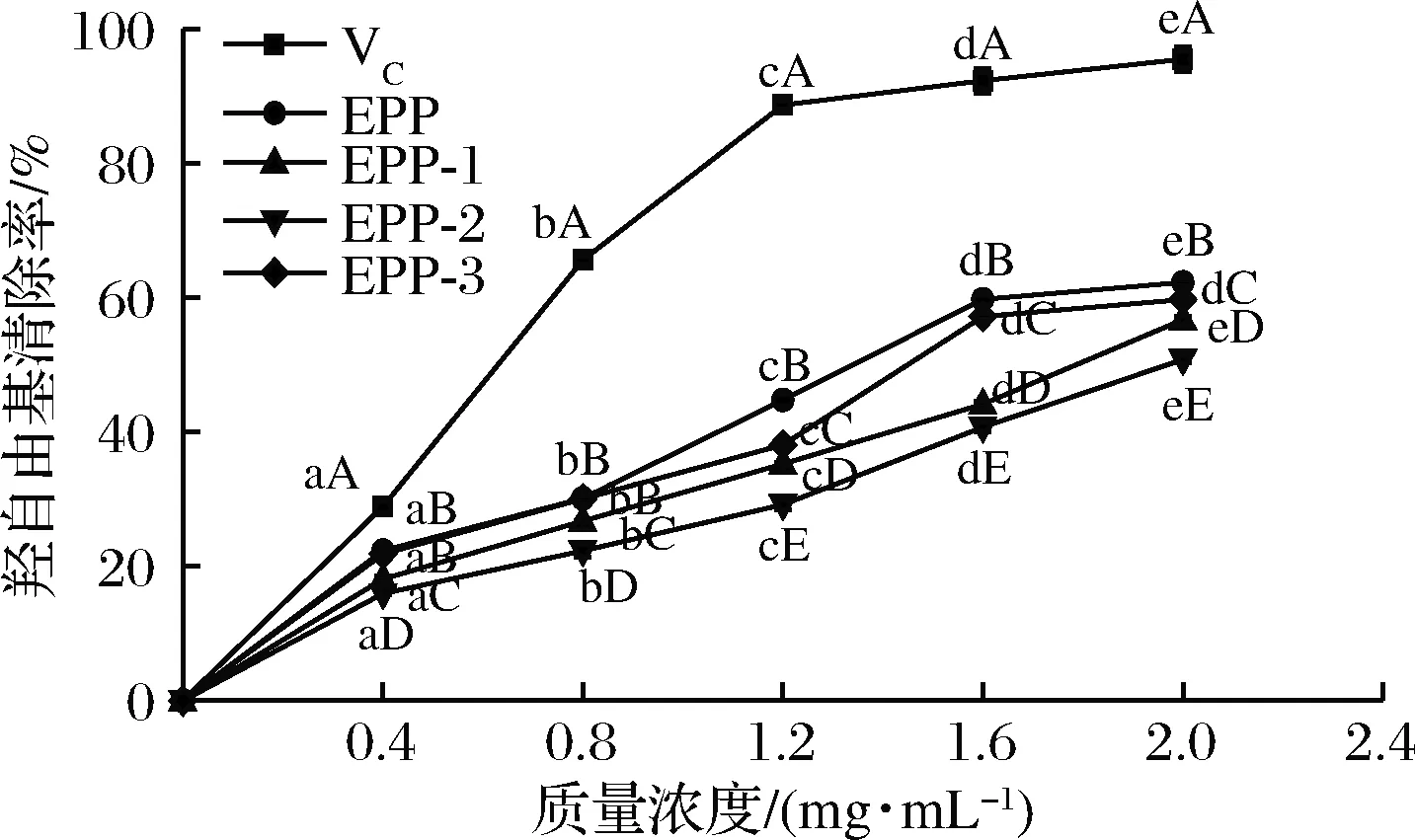
图6 浒苔多糖对羟自由基的清除能力
Fig.6 scavenging capacity ofEntomorphaproliferapolysaccharides to hydroxy radicals
注:图中不同小写字母表示同一组分不同浓度之间差异显著(P<0.05), 不同大写字母表示同一浓度不同组分之间差异显著(P<0.05)(下同)
2.5.2 超氧阴离子清除率的测定结果
图7所示为浒苔粗多糖和3个多糖分离纯化组分(EPP-1、EPP-2、EPP-3)对超氧阴离子清除率的测定结果。不同组分的超氧阴离子清除能力呈浓度依赖性,随着多糖质量浓度的升高,清除能力增强。不同组分之间差异性显著(P<0.05),在实验浓度范围内,当浓度大于0.4 mg/mL时,EPP的超氧阴离子清除能力明显的优于其他3组,在1 mg/mL时,清除能力达到了4组最高28.74%。
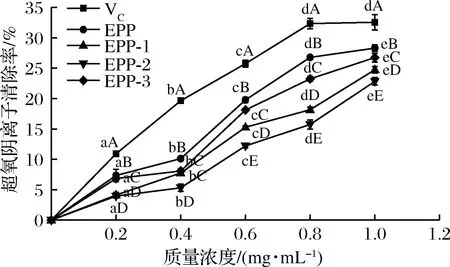
图7 浒苔多糖对超氧阴离子的清除能力
Fig.7 scavenging capacity ofEntomorphaproliferapolysaccharides to superoxide anion
2.5.3 DPPH自由基清除率的测定结果
图8所示为浒苔粗多糖和3个多糖分离纯化组分(EPP-1、EPP-2、EPP-3)对DPPH自由基的清除能力测定结果。结果表明,在实验浓度范围内,各提取组分对DPPH自由基的清除能力随着浓度的增加而增强,差异性显著(P<0.05)。实验浓度范围内,DPPH自由基清除率最强的是EPP,但在低浓度(0.2、0.4 mg/mL)和高浓度(1.0 mg/mL)时与EPP-3差异不显著,EPP-1和EPP-2的清除能力低于EPP和EPP-3,但两者之间的差异性不显著。

图8 浒苔多糖对DPPH自由基的清除能力
Fig.8 scavenging capacity ofEnteromorphaproliferapolysaccharides to DPPH free radical
2.7 浒苔多糖的红外光谱分析

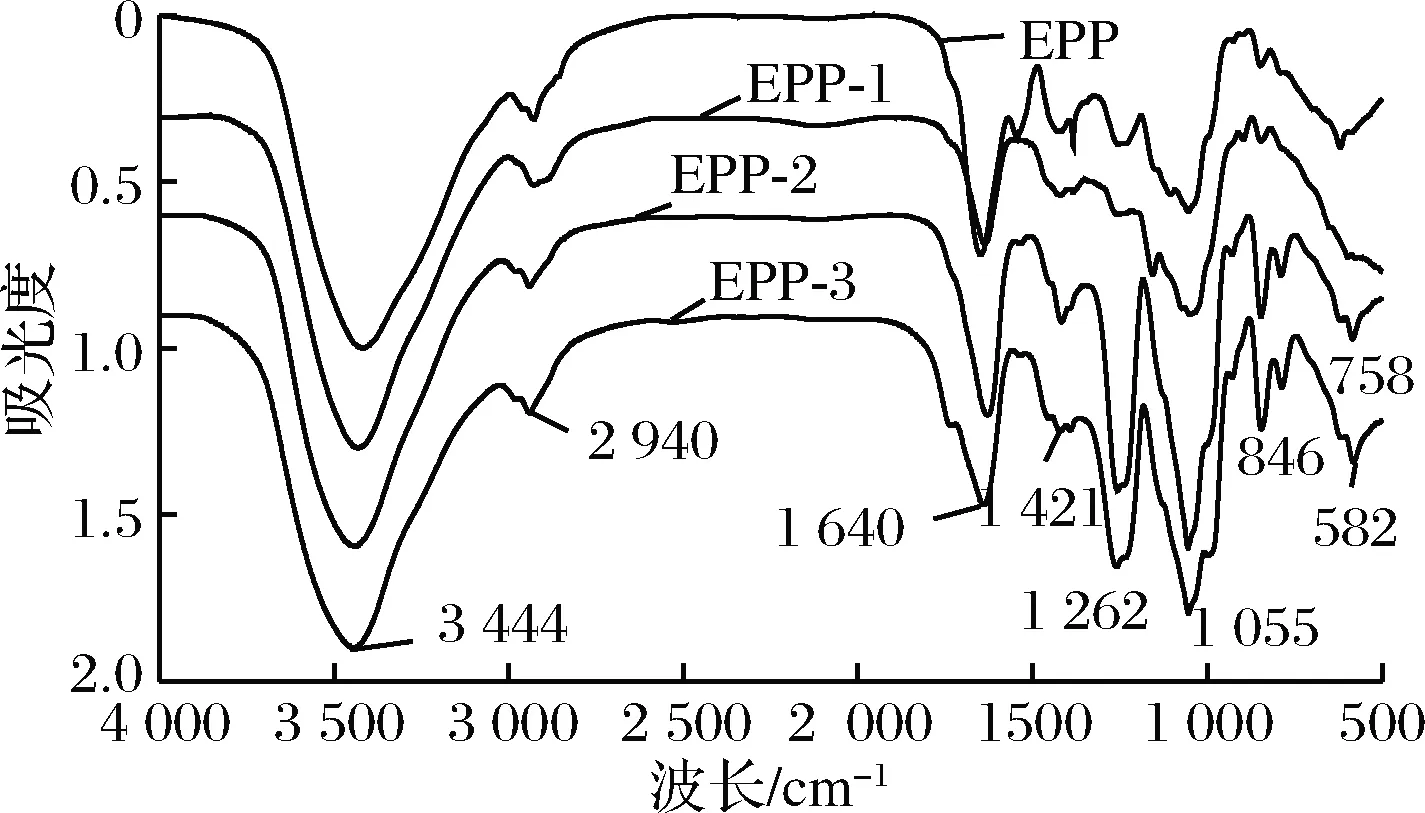
图9 浒苔多糖的红外光谱图
Fig.9 infrared spectrum ofEnteromorphaproliferapolysaccharides
2.8 分子质量和纯度分析
如表3所示为GPC检测的EPP-1、EPP-2和EPP-3的分子质量大小以及纯度。EPP-1、EPP-2、EPP-3的平均分子质量分别为121、164、162 ku,其中EPP-1的分子质量最小,这可能是导致红外光谱图吸收峰较弱的原因。从分散系数PI来看,3组的分散系数1.21、1.43、1.05均小于2,这说明3个组分的纯度较高,分子质量分布均匀。

表3 浒苔多糖的GPC测定结果Table 3 GPC results of Enteromorpha prolifera polysaccharides
如图10所示,EPP-1、EPP-2、EPP-3三个组分的多糖组成都是对称、均一的峰[23]。

图10 浒苔多糖的GPC谱图
Fig.10 GPC spectrum ofEnteromorphaproliferapolysaccharides
3 结论
本研究采用超声波辅助的正交实验优化了浒苔多糖的提取工艺,通过DEAE-52纤维素柱对其进行分离纯化得到EPP-1、EPP-2和EPP-3三个组分,并对3个组分的体外化学抗氧化活性以及结构进行了研究。结果表明,3个组分对羟自由基、DPPH自由基和超氧阴离子均具有一定的清除能力,下一步将继续对浒苔多糖体外细胞抗氧化活性进行研究;通过红外分析可知,EPP-1、EPP-2和EPP-3均为吡喃多糖,EPP-2可能是含有β-D-吡喃葡萄糖和蛋白质复合的酸性多糖,EPP-3为含有β-D-吡喃葡萄糖的酸性多糖。通过对浒苔多糖结构和抗氧化活性的研究,可为浒苔多糖具体结构的进一步研究和开发利用提供一定的科学依据。

