微创冠状动脉旁路移植术的远期疗效分析
徐 洪,朱鹏雄,周衍再,裘佳培,刘 俊,赵 强
上海交通大学医学院附属瑞金医院心脏外科,上海200025
经正中切口冠状动脉旁路移植术(coronary artery bypass grafting,CABG)、 微 创 冠 状 动 脉 旁 路 移 植术(minimally invasive direct coronary artery bypass,MIDCAB)和经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)是治疗严重左前降支(left anterior descending,LAD)近段狭窄的常用治疗方案。虽然外科手术治疗以及介入治疗都被相关指南推荐用于LAD 近段病变的治疗[1-3],但由于介入治疗的创伤更小,患者倾向于选择PCI[4]。
MIDCAB 无需正中胸骨切口、主动脉操作及体外循环,但又能达到与传统手术相当的桥血管通畅率,因而逐渐受到关注并易于被患者接受。但由于MIDCAB对术者的技术及经验要求较高,许多临床中心仍未将MIDCAB 作为处理单纯LAD 病变的首选方案[5]。在本中心,MIDCAB 既用于单纯LAD 病变的治疗,又作为冠状动脉杂交术(hybrid coronary revascularization,HCR)的一部分进行应用。本研究总结了本中心10 年来MIDCAB治疗冠状动脉粥样硬化性心脏病的经验及随访结果,以评估MIDCAB 的远期疗效。
1 资料与方法
1.1 病例及分组
收集2009 年2 月—2019 年5 月在上海交通大学医学院附属瑞金医院行MIDCAB 的患者的病例资料。排除标准:①非冠状动脉粥样硬化性心脏病患者。②再次行CABG 术的患者。纳入患者可分为非完全再血管化(incomplete revascularization,IR) 与 完 全 再 血 管 化(complete revascularization,CR)2 种,其中CR 患者又分为行单纯MIDCAB 或行HCR 2 种。故将患者分为3 组,分别为IR+最佳药物治疗(optimal medical therapy,OMT)组、MIDCAB(CR)组及HCR(CR)组。MIDCAB(CR)组的患者为单支病变,而HCR(CR)组及IR+OMT 组的患者为多支病变。
1.2 观察终点及随访方法
观察终点包括围术期终点与远期临床终点。围术期定义为术后30 d 内。围术期终点包括术后死亡、心肌梗死(围术期心肌梗死指5 型心肌梗死[6])、卒中、靶血管再次血运重建、胸部切口愈合不良、住院天数及主要心脑血管不良事件(major adverse cardiovascular and cerebrovascular events,MACCE),其中MACCE 包括死亡、心肌梗死、卒中、靶血管再次血运重建的复合临床终点。远期临床终点包括MACCE、死亡、心肌梗死、卒中、再次血运重建。
对患者进行电话随访,向患者说明随访结果将用于临床研究,并获得患者知情同意。随访内容包括死亡、心肌梗死、卒中、再次血运重建及其发生时间。术后每满1 年行电话随访1 次。在本研究中,对于未满术后1 年的患者及距离最近一次随访超过1 个月的患者均行补充电话 随访。
1.3 统计学分析
应用SPSS 22.0 软件进行统计学分析。满足正态分布的连续性变量用±s 表示,不满足正态分布的连续性变量用M(Q1,Q3)表示。3 组间比较采用ANOVA 检验或Kruskal-Wallis 检验,2 组间比较采用t 检验或Wilcoxon法。分类变量用百分比表示,采用χ2检验、校正χ2检验及Fisher 精确概率法进行比较。通过Kaplan-Meier(K-M)曲线分析免于MACCE 的生存情况,使用Log-rank 检验评价K-M 曲线的差异。进行3 组比较时,P<0.05 表示差异有统计学意义;进行2 组比较时,采用Dunn-Bonferroni 法进行事后检验,调整显著性水平为P<0.016 7。
2 结果
2.1 患者基线数据
2009 年2 月—2019 年5 月 共 有425 例 患 者 接 受MIDCAB 手术,其中体外循环手术1 例,急诊手术1 例,多支冠状动脉旁路移植术11 例。358 例患者直视下获取桥血管(其中354 例经左胸前外侧切口,1 例因暴露LAD困难而横断胸骨,1 例经右胸切口,1 例经左第四肋间后外侧切口,1 例经胸骨下段小切口),67 例在机器人辅助下获取桥血管。86 例患者为IR,339 例患者为CR(169例为单纯MIDCAB,170 例为HCR)。
共完成桥血管441 根,其中乳内动脉桥422 根,大隐静脉桥19 根。412 根吻合到LAD,17 根吻合到对角支,1 根吻合到中间支,1 根吻合到左回旋支主干,5 根吻合到钝缘支,1 根吻合到RCA 主干,3 根吻合到后降支, 1 根吻合到后外侧支。
MIDCAB(CR)组患者的男性占比、年龄及美国纽约心脏病协会(New York Heart Association,NYHA)心功能分级低于IR+OMT 组及HCR(CR)组(均P=0.000);MIDCAB(CR)组既往罹患糖尿病(P=0.018)、慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)(P=0.049)、外 周 血 管 病(P=0.029)、脑 血 管意外(P=0.002)、心肌梗死(P=0.029)的患者比例低于IR+OMT 组及HCR(CR)组;MIDCAB(CR)组患者的术前射血分数(ejection fraction,EF)、肌钙蛋白I(cardiac troponin I,cTnI)水平也明显优于其他2 组(均P=0.000)。各组患者基线数据见表1。
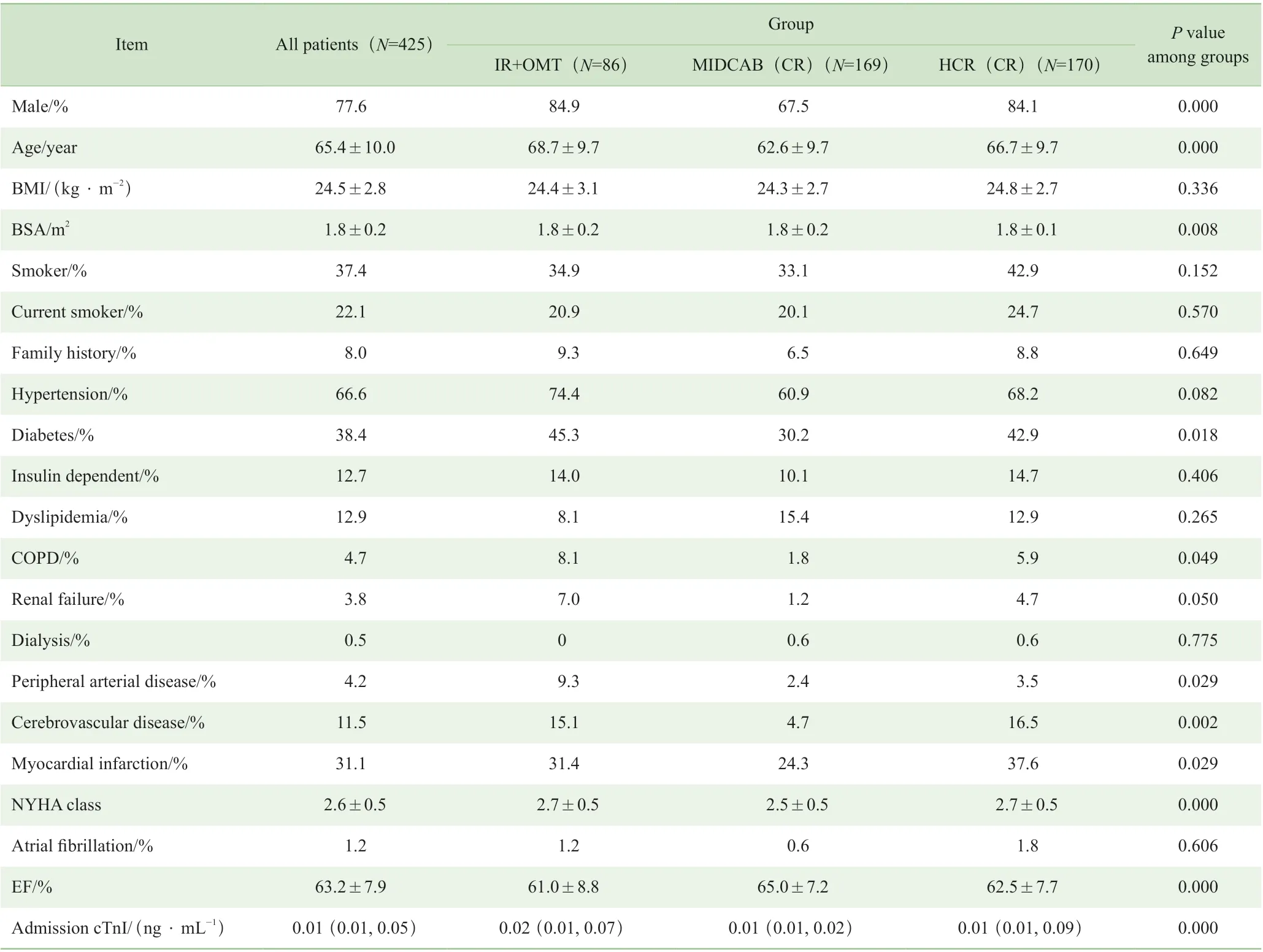
表1 各组患者基线数据比较Tab 1 Comparison of baseline data of patients among the groups
2.2 围术期结果
患者的平均住院时间为17.5 d。围术期死亡7 例,其中围术期心肌梗死死亡5 例,大面积脑梗死死亡1 例,重症肺部感染死亡1 例。IR+OMT 组死亡6 例,包括5 例围术期心肌梗死和1 例大面积脑梗死,死亡率明显高于其他2 组(均P=0.000)。完成CR 的患者围术期死亡率为0.3%。IR+OMT 组围术期心肌梗死及MACCE 发生率显著高于其他2 组(均P=0.000)。此外,IR+OMT 组术后48 h cTnI 水平也显著升高(P=0.011)。HCR(CR)组住院时间明显长于其他2 组(均P=0.000)。各组患者围术期临床结果见表2。
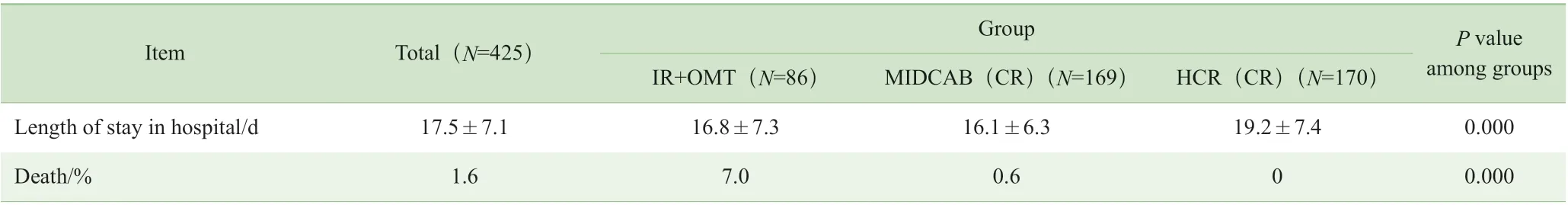
表2 各组患者围术期临床结果比较Tab 2 Comparison of perioperative clinical results among the groups

Continued Tab
2.3 远期随访结果
中位随访时间为39.9 个月(18.2 ~81.1 个月),随访率为89.6%。IR+OMT 组远期死亡(P=0.000)、心肌梗死(P=0.002)及MACCE(P=0.005)的发生率均显著高于MIDCAB(CR)组及HCR(CR)组。HCR(CR)组各项远期终点的发生率均高于MIDCAB(CR)组,但组间差异无统计学意义(P>0.05)。各组患者远期随访结果见表3。

表3 各组患者远期随访结果比较Tab 3 Comparison of follow-up results of patients among the groups
K-M 曲线分析结果显示,患者1 年、5 年及10 年生存率分别为96.7%(95%CI 94.9%~98.5%)、92.9%(95%CI 89.8%~96.0%)和80.9%(95%CI 73.1%~88.7%);而患者1 年、5 年及10 年免于MACCE 的生存率分别为90.7%(95%CI 88.0% ~93.4%)、83.6%(95%CI 79.5% ~87.7%)和70.5%(95%CI 62.1% ~78.9%)( 表4, 图1A、2A)。3 组比较结果显示,IR+OMT 组的远期生存率(图1B)及远期免于MACCE 的生存率(图2B)均显著低于MIDCAB(CR)组(P=0.000,P=0.001)及HCR(CR)组(P=0.001,P=0.002)。
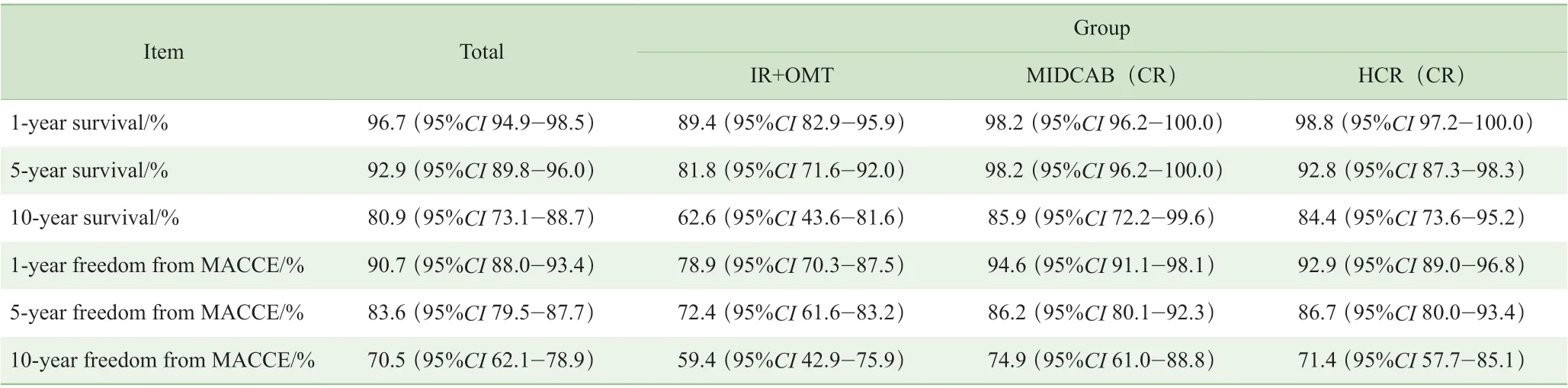
表4 K-M 曲线估算患者1 年、5 年及10 年生存率和免于MACCE 生存率Tab 4 1-year, 5-year and 10-year survival and freedom from MACCE estimated by K-M curves
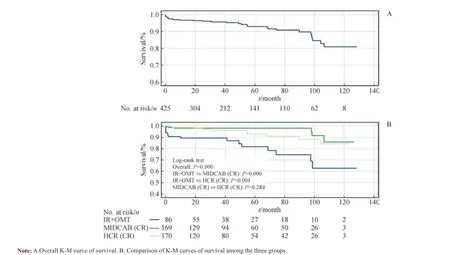
图1 患者K-M 生存曲线Fig 1 K-M curves of survival of patients
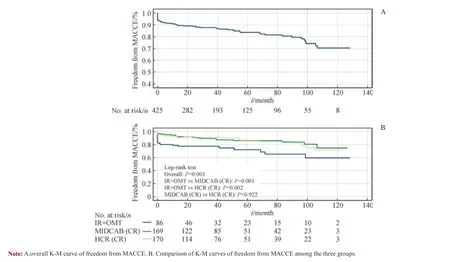
图2 患者免于MACCE 生存的K-M 曲线Fig 2 K-M curves of freedom from MACCE of patients
3 讨论
冠状动脉血运重建术后患者的生存和无不良事件生存与左乳内动脉(left internal mammary artery,LIMA) -LAD桥血管的通畅显著相关[7]。由于胸骨切开与体外循环(cardio-pulmonary bypass,CPB)给患者带来的巨大创伤,患者更倾向选择PCI 进行血运重建[8]。但是,单纯PCI 治疗患者的远期通畅率较低,再次血运重建的发生率较高[9-11]。 MIDCAB 应用于临床后,外科医师在避免胸骨切开和CPB 的同时,能完成高质量的LIMA-LAD 桥。MIDCAB的手术难度较高,学习曲线较传统CABG 长;然而,既往的研究[12]显示学习曲线不影响临床结果,只影响获取LIMA 的手术时间。
本研究的围术期死亡率为1.6%,低于相关文献[13]报道的单纯非体外冠状动脉旁路移植术(off-pump coronary artery bypass,OPCAB)围术期死亡率(2.6%)。但各组间的差异明显,IR+OMT 组的围术期死亡率高达7.0%;而完成CR的339 例患者中,仅有1 例患者因重症肺部感染在围术期死亡。IR+OMT 组死亡的6 例患者中,有5 例患者成功完成MIDCAB 术后,在等待PCI 的过程中突发围术期心肌梗死而死亡。从基线数据上看,IR+OMT 组的术前情况最差,并显著劣于MIDCAB(CR)组。上述结果提示,对于术前情况较差,冠状动脉病变复杂的患者,应以一期完成CR 为首要目标,传统CABG 术及OPCAB 术可能是更好的选择,对冠状动脉杂交术则应谨慎选择。对于无法耐受正中开胸手术的患者,应同期或尽早分期完成CR,避免患者在等待过程中发生意外。IR+OMT 组较高的围术期MACCE 发生率以及术后48 h cTnI 水平,也与上述结果相对应。
从住院时间上看,HCR(CR)组最长,平均住院时间为19.2 d。本中心的HCR 均为分期完成,需要心内科与心外科协同合作,大部分HCR(CR)组患者先完成MIDCAB 术,再行PCI。这种HCR 策略的优势在于患者可以在LAD 得到保护情况下完成PCI,安全性更高,同时也可以在PCI 时完成对桥血管的评估[14]。此外,先行MIDCAB 更有利于抗血小板治疗的实施。相比于同期行HCR 以及先行PCI 的HCR 策略,先行MIDCAB 患者围术期出血以及支架内血栓形成的风险更低[15];但这种策略容易延长患者的住院时间。更为紧密的心内科与心外科合作以及复合型心脏外科医师的培养,可能会缩短分期HCR 患者的住院时间。
本研究的中位随访时间为33.9 个月,随访率接近90%。K-M 曲线估算的10 年生存率达到80.9%,10 年免于MACCE 的生存率达到70.5%,并不劣于Holzhey 等[16]报道的结果(10 年生存率77.6%,10 年免于MACCE 的生存率70.9%)。从3 组间的比较结果来看,完成CR 的2组患者,在死亡、心肌梗死、MACCE 的发生率上均显著优于IR+OMT 组患者,K-M 分析的结果也同样支持这一发现。根据目前的指南推荐,在对冠状动脉粥样硬化性心脏病患者行血运重建时,无论采用CABG 还是PCI,均应以尽可能完成CR 为目标[4]。结合本研究的结果,这一原则在MIDCAB 及HCR 中同样适用。对于冠状动脉病变复杂且仅通过HCR 难以完成CR 的患者,行正中开胸的传统CABG 或OPCAB 可能是更好的选择。HCR(CR)组虽然在基线数据上劣于MIDCAB(CR)组,但2 组在各随访终点上均无显著差异,这也从侧面反映了CR 对于冠状动脉粥样硬化性心脏病患者远期疗效的重要性。
参·考·文·献
[1] Benedetto U, Raja SG, Soliman RF, et al. Minimally invasive direct coronary artery bypass improves late survival compared with drug-eluting stents in isolated proximal left anterior descending artery disease: a 10-year follow-up, single-center, propensity score analysis[J]. J Thorac Cardiovasc Surg, 2014, 148(4): 1316-1322.
[2] Blazek S, Holzhey D, Jungert C, et al. Comparison of bare-metal stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: 10-year follow-up of a randomized trial[J]. JACC Cardiovasc Interv, 2013, 6(1): 20-26.
[3] Blazek S, Rossbach C, Borger MA, et al. Comparison of sirolimus-eluting stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: 7-year follow-up of a randomized trial[J]. JACC Cardiovasc Interv, 2015, 8(1): 30-38.
[4] Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization[J]. Eur Heart J, 2019, 40(2): 87-165.
[5] Reddy RC. Minimally invasive direct coronary artery bypass: technical considerations[J]. Semin Thorac Cardiovasc Surg, 2011, 23(3): 216-219.
[6] Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018)[J]. J Am Coll Cardiol, 2018, 72(18): 2231-2264.
[7] Loop FD. Internal-thoracic-artery grafts. Biologically better coronary arteries[J]. N Engl J Med, 1996, 334(4): 263-265.
[8] Thiele H, Oettel S, Jacobs S, et al. Comparison of bare-metal stenting with minimally invasive bypass surgery for stenosis of the left anterior descending coronary artery: a 5-year follow-up[J]. Circulation, 2005, 112(22): 3445-3450.
[9] Kapoor JR, Gienger AL, Ardehali R, et al. Isolated disease of the proximal left anterior descending artery comparing the effectiveness of percutaneous coronary interventions and coronary artery bypass surgery[J]. JACC Cardiovasc Interv, 2008, 1(5): 483-491.
[10] Roguin A, Camenzind E, Kerner A, et al. Long-term outcomes of stenting the proximal left anterior descending artery in the PROTECT trial[J]. JACC Cardiovasc Interv, 2017, 10(6): 548-556.
[11] Hannan EL, Zhong Y, Walford G, et al. Coronary artery bypass graft surgery versus drug-eluting stents for patients with isolated proximal left anterior descending disease[J]. J Am Coll Cardiol, 2014, 64(25): 2717-2726.
[12] Repossini A, Moriggia S, Cianci V, et al. The LAST operation is safe and effective: MIDCABG clinical and angiographic evaluation[J]. Ann Thorac Surg, 2000, 70(1): 74-78.
[13] Kinoshita T, Asai T, Suzuki T, et al. Off-pump bilateral versus single skeletonized internal thoracic artery grafting in high-risk patients[J]. Circulation, 2011, 124(11): S130-S134.
[14] Mack MJ, Brown DL, Sankaran A. Minimally invasive coronary bypass for protected left main coronary stenosis angioplasty[J]. Ann Thorac Surg, 1997, 64(2): 545-546.
[15] Gosev I, Leacche M. Hybrid coronary revascularization: the future of coronary artery bypass surgery or an unfulfilled promise?[J]. Circulation, 2014, 130(11): 869-871.
[16] Holzhey DM, Cornely JP, Rastan AJ, et al. Review of a 13-year single-center experience with minimally invasive direct coronary artery bypass as the primary surgical treatment of coronary artery disease[J]. Heart Surg Forum, 2012, 15(2): E61-E68.

