18F-FDG PET/CT 引导下穿刺活检在腹膜增厚性疾病良恶性鉴别中的应用
王海岩,尤志雯,寿 毅,孟庆元,陈慧倩,赵 军
同济大学附属东方医院核医学科,上海 200120
腹膜病变可以由多种疾病引起,影像学表现相对复杂,临床常规检查及影像学检查对其病因及良恶性的诊断价值有限,活检病理是最快速、有效的明确诊断的方法。目前临床常用的活检病理方法有超声、CT 引导下经皮穿刺活检,腹腔镜下腹膜活检,腹部小切口活检等。近年来,CT 引导下穿刺活检已逐渐成为一种成熟且临床应用广泛的技术。正电子发射计算机断层/X 线计算机体层摄影(positron emission tomography/computed tomography,PET/CT)不仅可以对病变进行全身的评估,而且可以很直观地呈现出腹膜病变代谢最活跃的部位。PET/CT 引导下经皮腹膜穿刺活检为穿刺部位选择提供了可靠的依据,提高了活检的准确性[1-2]。本研究回顾性分析行18F-氟脱氧葡萄糖(18F-flurodeoxyglucose,18F-FDG)PET/CT 引导下经皮腹膜穿刺活检的10 例患者的病例资料,探讨该方法的临床应用价值。
1 资料与方法
1.1 病例资料
收集2017 年12 月—2018 年12 月在同济大学附属东方医院住院的10 例患者的病例资料,其中男4 例,女6例,年龄45 ~74 岁。病例入组标准:①腹膜实性增厚伴18F-FDG 代谢增高。②无明确原发灶,腹膜增厚为唯一影像学可显示病变;或腹膜增厚与原发病灶18F-FDG 代谢水平相仿,但原发灶取病理标本风险较大或过程复杂,如需行外科手术等。排除标准:①存在不能纠正的凝血功能异常。②缺乏安全的穿刺路径。③大量腹水患者(如果能配合术后穿刺处高位并耐受局部加压包扎,则为相对禁忌证)。
体检发现糖类抗原-125(carbohydrate antigen 125,CA-125)增高2 例,胸部CT 检查见腹膜增厚1 例,临床表现为腹痛、腹胀、腹水7 例。所有患者均空腹6 h 以上,静脉注射18F-FDG 5.55 ~6.66 MBq/kg,安静休息并充分水化1 h 后行18F-FDG PET/CT 检查;图像显示腹膜饼状增厚或结节状增厚,伴有18F-FDG 代谢异常增高;排除穿刺禁忌证后,行PET/CT 引导下经皮腹膜穿刺活检。所有病例均随访其治疗方法及转归。
1.2 仪器与设备
PET/CT 检查仪器为联影PET/CT(uMI 510,上海联影医疗科技有限公司)。图像为3D 方式采集数据,2 ~3 min/床, 有序子集期望值最大化(OSEM)重建图像。采用标准摄取最大值(SUVmax)≥2.5 为阳性高代谢区标准。腹膜穿刺活检使用联影PET/CT(uMI 510)中的16 层CT 扫描,扫描参数包括管电压100 kV、管电流80 mA、层厚5 mm、螺距1.062 5。采用美国BARD 公司生产的活检针、活检枪(16G 或18G),取材长度16 ~22 mm。
1.3 穿刺前准备
患者术前行血常规、凝血功能、肝肾功能、心电图等常规检查,与患者或其家属签署手术知情同意书,告知患者手术过程并行呼吸屏气训练,取得患者充分理解及配合。
1.4 穿刺方法
患者首先行18F-FDG PET/CT 检查,对病变进行全身评估后,选取腹膜病变18F-FDG 代谢活性最高的部位作为拟取活检的靶区。
根据病灶位置和大小选择合适体位,在预选出的穿刺区固定金属定位器,再次行CT 扫描,以金属定位线与拟穿刺层面的交叉点为最佳穿刺点,设计穿刺路径(一般选择距离腹膜病变最短且避开腹腔内血管、肠管的路径),计算进针角度、深度。以穿刺点为中心常规消毒、铺洞巾,2%利多卡因5 mL 逐层麻醉至腹膜,麻醉满意后应用16G 或18G 同轴穿刺针从选定穿刺点,按照既定角度、路径、深度进针,再次行CT 扫描确定穿刺针是否到目标靶区。如穿刺位置不理想,可以根据CT 扫描调整直至到达目前靶区。拔出同轴针芯置换活检枪取材。每例患者常规取材2 ~3 条,标本经10%甲醛溶液固定后送检病理。穿刺完成后,伤口按压包扎,复查局部CT,观察有无出血、气腹等并发症。
2 结果
2.1 穿刺活检手术完成情况
10 例患者均顺利完成腹膜穿刺活检手术。所有病例均一次性穿刺取材成功,并获得病理诊断。10 例18F-FDG PET/CT 引导下腹膜穿刺活检病例临床资料及转归情况见表1。根据PET/CT 图像选定穿刺靶区,其中大网膜6 例、肝周腹膜2 例、肠系膜1 例、右侧结肠膀胱腹膜1 例。穿刺病理结果显示:弥漫大B 细胞淋巴瘤3 例,腹膜转移癌4 例,腹膜假黏液瘤、结核和炎症各1 例。穿刺活检准确率为100%。除1 例高龄患者未行治疗,其余9 例均进行了疾病的对症治疗。随访至2019 年12 月,5 例患者死亡,生存期为2 ~16 个月,其余5 例患者临床评价为完全缓解。图1 为2 例典型病例的PET/CT 图像及穿刺活检路径。
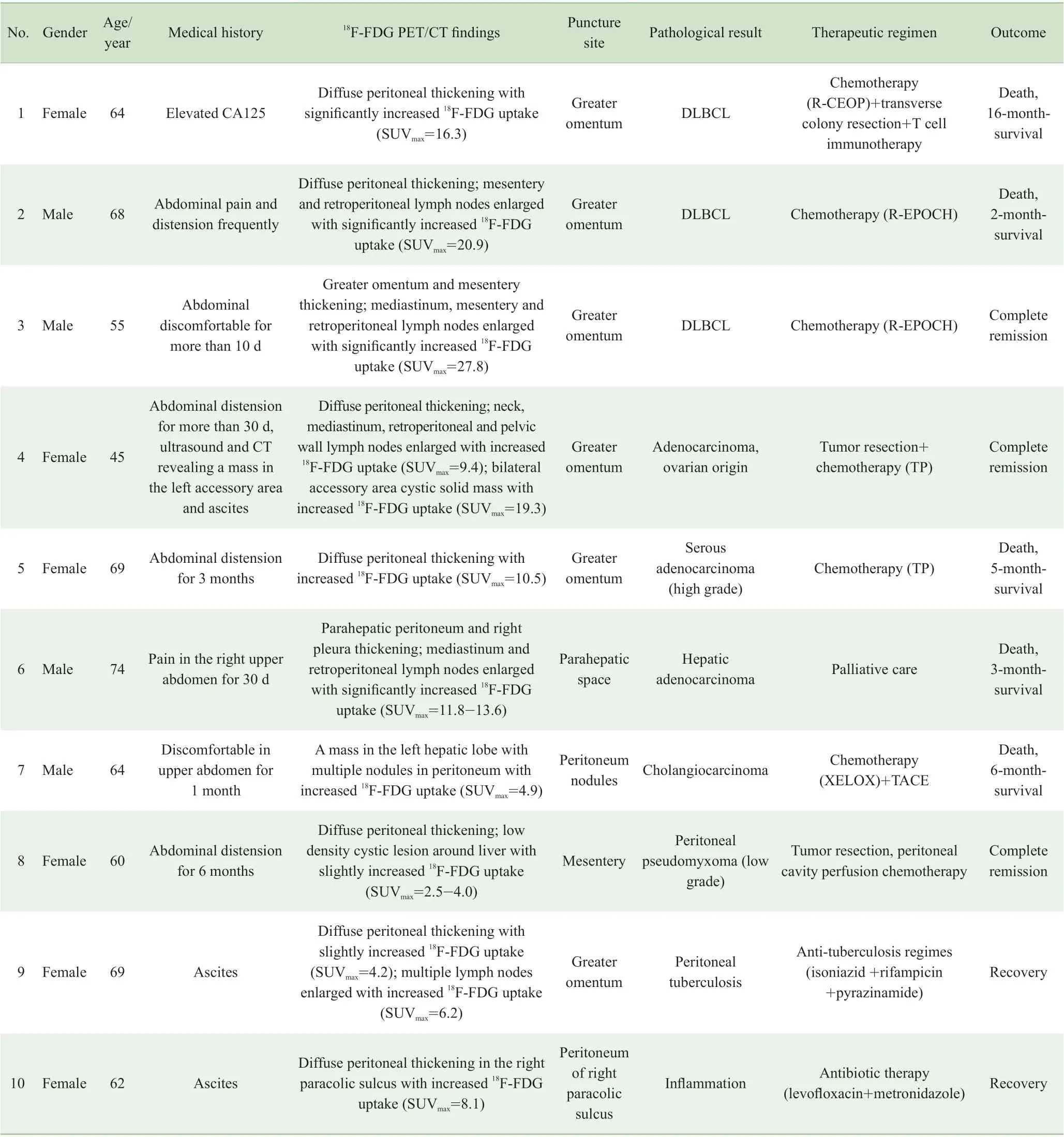
表1 10 例18F-FDG PET/CT 引导下腹膜穿刺活检病例临床资料及转归Tab 1 Clinical data of 10 cases of 18F-FDG PET/CT guided peritoneal biopsy
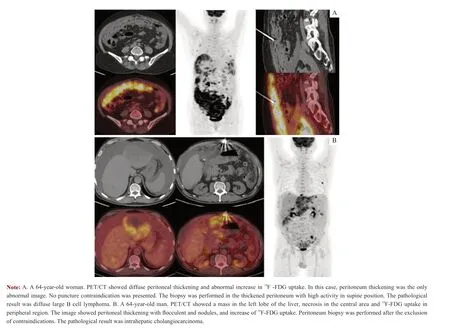
图1 2 例典型病例的PET/CT 图像及穿刺活检路径Fig 1 PET/CT findings and biopsy routes of two typical cases
2.2 术后并发症
本组病例术后均未发生并发症。活检时患者感到疼痛,但均能耐受,数小时后自行缓解。1 例患者因大量腹水,穿刺术后嘱患者半卧位12 ~24 h,无腹水渗漏发生。
2.3 治疗方案的选择
本组3 例淋巴瘤病例,在获得明确病理及免疫组织化学结果后,行化学治疗(化疗);2 例卵巢癌,其中1 例先行肿瘤减灭术后再行化疗,1 例行化疗;2 例肝脏肿瘤,其中1 例行化疗结合肝脏介入治疗,1 例因患者高龄行内科保守治疗;1 例腹膜假黏液瘤先经腹腔镜行肿瘤减灭术,再行腹腔灌注化疗;1 例腹膜结核患者转专科医院接受抗结核治疗;1 例腹膜炎症患者,对症抗炎后痊愈出院。
3 讨论
腹膜是由丰富的脂肪、血管、淋巴结及结缔组织组成,具有吸收和保护功能,感染性、炎症性、肿瘤性和创伤性等疾病常累及腹膜[3]。单纯的影像学检查对腹膜病变诊断效能有限,腹水脱落细胞学、肿瘤标志物等实验室检查方法的特异度较低,因此明确病理诊断对指导治疗有重要意义。随着免疫组织化学方法的广泛应用,通过免疫组织化学分析可以辨别组织来源,这对病理活检取材来说是一个概念上的飞跃,可以根据病变选择最安全、最简便的部位取材,而不是局限于原发部位。
本组1 例淋巴瘤、1 例卵巢癌腹膜转移、1 例腹膜假黏液瘤、1 例腹膜炎症患者中,腹膜增厚是唯一可见的病变,这时能够通过腹膜活检获得病理诊断尤为重要;但是,准确选择腹膜活检的部位是诊断的关键。18F-FDG PET/CT 全身显像,可以直观显示18F-FDG 代谢增高的腹膜增厚区域,从而准确指导腹膜活检的部位。以往常行腹腔镜检查,直视下见腹膜表面成簇或散在分布的结节,活检确诊率较高;但该技术需在手术室进行,手术过程复杂,手术风险高、费用高,且需全身静脉麻醉,手术时间长,不易被患者接受。超声引导下行经皮穿刺腹膜活检可对穿刺全过程进行实时动态监视,可避免损伤重要脏器及血管;但对结节样增厚或者较深位置的腹膜,超声检查容易受肠气干扰,难以区分腹膜与肠管,在临床应用中具有一定局限性。CT 引导下经皮穿刺活检被广泛认为是一种安全、简便的诊断方法[4-5]。本组4 例患者在结束PET/CT检查后,同机对PET/CT 融合图像显示的腹膜病变取材,操作方便、定位准确[6-7],获得了确切的病理诊断结果。
对于淋巴瘤患者的确诊,传统首选浅表淋巴结切除标本病理活检。本组2 例淋巴瘤病例,PET/CT 全身显像均未见明显浅表淋巴结18F-FDG 代谢增高,仅表现为腹膜增厚及腹腔、腹膜后肿大淋巴结18F-FDG 代谢增高。从18F-FDG 代谢水平来看,腹膜病变的SUVmax值与腹腔、腹膜后淋巴结病变SUVmax值相当,甚至有些部位SUVmax值高于淋巴结病变;从操作角度来说,腹腔或腹膜后淋巴结相对位置较深,腹腔结构复杂,此时的腹膜病变相对表浅,解剖结构简单,更容易获得病理标本。
本组有2 例肝脏来源的恶性肿瘤。众所周知,肝脏穿刺是临床应用比较成熟的技术[8]。但本组2 例中,其中1 例肝样腺癌,PET/CT 显示以肝包膜、右侧胸壁及胸膜增厚为主,此时的病变不能确定是肝脏原发,所以选择病灶最明显、18F-FDG 代谢最高的位置取材。另1 例肝脏肿瘤,PET/CT 示肝左叶软组织肿块,由于肝左叶体积相对较小,肿块占据整个肝左叶,肿块中央区坏死,无肿瘤活性组织可以取材,周边18F-FDG 代谢异常增高区邻近肝包膜,穿刺风险大,有肝包膜损伤、肝瘘、肝门部血管损伤的风险;另外,肝左叶周围大量积液,穿刺术后腹水渗漏、腹腔种植的风险增高;肝左叶周边腹膜絮状增厚,18F-FDG 代谢增高,影像学上可以明确为肝肿瘤的腹膜转移;比较肝脏病变和腹膜病变,选择腹膜取材更安全、更简便,且PET/CT 明确显示了18F-FDG 代谢的高活性区,保证了取材的准确性。
卵巢癌的病理诊断通常依据手术病理、腹水病理、腹腔镜探查活检、妇科后穹隆穿刺等。本组1 例病例PET/CT 除可见双侧附件区占位外,大网膜广泛饼状增厚,全身广泛淋巴结转移;此时,PET/CT 一站式操作,在完成PET/CT 检查后立刻行腹膜穿刺病理活检,可以极大地缩短诊断周期,简化患者的门诊就诊流程及降低门诊费用,具有良好的临床价值和社会价值。
另外,腹膜病变形态多样、位置各异,应根据病变的解剖位置和18F-FDG 代谢活性设计相应的穿刺路径。首先,选择穿刺靶区时,应该根据18F-FDG 代谢活性程度,选择最高临床分期的病灶进行活检[9]。穿刺路径应该避开大血管和重要脏器[10]。腹部最常见的穿刺路径遮挡为肠管,如果不能避开肠管,应在穿透腹膜后改用钝头针芯,缓慢进针,可以推挤开穿刺路径上的肠管。另外,对于腹膜病变,多数患者伴大量腹水,有穿刺后腹水渗漏的报道[8]。对于这类患者,应该选择合适的穿刺时期,穿透腹壁肌肉邻近腹膜时,可以参照胸腔穿刺的方法,嘱患者呼吸配合,确保腹壁与腹膜穿刺点不在一条直线上;术后,可以嘱患者体位配合,如半卧位或侧卧位等;另外,考虑到腹壁脂肪层较薄、常规无菌纱布密封性能低,可以使用弹力绷带绕腹壁1 周或固定加压24 h 以降低渗漏概率。
本研究是一项回顾性研究,样本量较小,但本组病理类型涵盖较多,相对而言具有一定的代表意义。我们认为,对于腹膜增厚患者,18F-FDG PET/CT 引导下穿刺活检具有取材准确、安全、快速、微创、有效、可重复的特点,能为临床直接提供可靠的病理学依据,实现疾病精准病理诊断的一站式服务,对疾病的进一步诊疗具有指导价值。
参·考·文·献
[1] 中华医学会核医学分会分子影像介导精确诊断工作委员会. PET/CT 引导下微创经皮生物靶区活组织检查术专家共识[J]. 中华核医学与分子影像杂志, 2016, 36(6): 542-545.
[2] Fei B, Schuster DM. PET molecular imaging-directed biopsy: a review[J]. Am J Roentgenol, 2017, 209(2): 255-269.
[3] Tirkes T, Sandrasegaran K, Patel AA, et al. Peritoneal and retroperitoneal anatomy and its relevance for cross-sectional imaging[J]. Radiographics, 2012, 32(2): 437-451.
[4] Babaei Jandaghi A, Lebady M, Zamani AA, et al. A randomised clinical trial to compare coaxial and noncoaxial techniques in percutaneous core needle biopsy of renal parenchyma[J]. Cardiovasc Intervent Radiol, 2017, 40(1): 106- 111.
[5] Cerci JJ, Tabacchi E, Bogoni M, et al. Comparison of CT and PET/CT for biopsy guidance in oncological patients[J]. Eur J Nucl Med Mol Imaging, 2017, 44(8): 1269-1274.
[6] Wu MH, Xiao LF, Liu HW, et al. PET/CT-guided versus CT-guided percutaneous core biopsies in the diagnosis of bone tumors and tumor-like lesions: which is the better choice?[J]. Cancer Imaging, 2019, 19(1): 69-80.
[7] Cazzato RL, Garnon J, Shaygi B, et al. PET/CT-guided interventions: indications, advantages, disadvantages and the state of the art[J]. Minim Invasive Ther Allied Technol, 2017, 27(1): 27-32.
[8] Chen I, Lorentzen T, Linnemann D, et al. Seeding after ultrasound-guided percutaneous biopsy of liver metastases in patients with colorectal or breast cancer[J]. Acta Oncol, 2016, 55(5): 638-643.
[9] Guo W, Hao B, Chen HJ, et al. PET/CT-guided percutaneous biopsy of FDGavid metastatic bone lesions in patients with advanced lung cancer: a safe and effective technique[J]. Eur J Nucl Med Mol Imaging, 2017, 44(1): 25-32.
[10] Vadvala HV, Furtado VF, Kambadakone A, et al. Image-guided percutaneous omental and mesenteric biopsy: assessment of technical success rate and diagnostic yield[J]. J Vasc Interv Radiol, 2017, 28(11): 1569-1576.

