低强度脉冲聚焦超声治疗膝骨关节炎的安全性和有效性
贾 朗,谭波涛,陈锦云
1. 重庆医科大学附属第二医院康复医学科,重庆 400010;2. 超声医学工程国家重点实验室,重庆医科大学生物医学工程学院,重庆 400016
膝骨关节炎(knee osteoarthritis,KOA)是中老年人群中常见的关节疾患[1],主要临床表现为受累关节疼痛且逐渐加重,进而出现功能障碍,该病进展至后期可引起关节畸形,严重影响患者的日常生活与工作[2-3]。对早中期症状较轻的患者而言,非甾体抗炎药(non-steroid antiinflammatory drug,NSAID)治疗、关节腔内注射药物治疗、物理治疗等非手术治疗手段是治疗KOA 的重要手段。随着疾病进展,KOA 晚期则需要关节置换术等大型、昂贵的手术治疗。因此,KOA 应予早期积极治疗。
超声波作为重要的物理因子治疗KOA 的历史已有60余年。传统采用频率较高、声强较高的非聚焦超声,以连续的能量输出方式,作用于关节周围软组织,其主要通过温热效应发挥作用。然而,超声治疗KOA 的临床效果备受质疑,国际骨关节炎研究学会发布的2014 版指南也将治疗超声判定为疗效“不确定”[4-5]。由于KOA 病变的核心在于退变的关节软骨,而软骨位置较深,较高频率的非聚焦超声穿透能力差,在传播过程中能量发生衰减,超声能量极少进入到关节间隙内,难以直接作用于关节软骨,这可能是导致治疗效果不确定的原因之一。本研究拟采用穿透性更好的低强度脉冲聚焦超声(focused low-intensity pulsed ultrasound,FLIPUS)治疗早中期KOA 患者,通过临床随机对照试验(randomized controlled trial,RCT)评价FLIPUS 临床治疗KOA 的安全性及有效性。
1 对象与方法
1.1 研究对象
选取2018 年8 月至2019 年8 月,重庆医科大学附属第二医院康复医学科就诊并确诊为KOA 患者共100 例。纳入标准:①符合美国风湿病学会于1995 年制定的KOA 诊断标准[6]。②患者年龄≥40 岁,性别不限。③符合放射学病情分级标准(Kellgren & Lawrence 法) 1 ~3 级。④6 个月内未使用过皮质激素类药物。⑤2 周内未使用非甾体抗炎药、透明质酸钠、全身慢作用药等相关治疗方案者。⑥签署受试者知情同意书。排除标准:①风湿和类风湿关节炎、感染性关节炎、痛风性关节炎等其他关节疾患。②膝关节局部皮肤破溃、皮肤感染、严重手术或外伤性瘢痕、关节局部恶性肿瘤及关节置换术患者。③其他原因引起的关节疼痛及功能障碍的患者。④伴有活动性消化道溃疡及出血,严重肝、肾功能不全,凝血功能障碍或有出血倾向的患者。⑤患有严重器质性心脏病,如心肌梗死、心力衰竭、严重心律失常、心脏起搏器植入的患者,及未经治疗或药物不能控制的高血压患者。⑥合并严重神经、精神疾病不能配合医师治疗的患者。⑦合并全身胶原结缔组织疾病患者,如系统性红斑狼疮等。⑧无法理解问卷调查的患者。本研究通过重庆医科大学伦理委员会评审[2014 年审(2014005)号],已在世界卫生组织国际临床试验注册平台——中国临床试验注册中心完成注册(注册号ChiCTR-IPR-14005748)。研究符合医学伦理学要求,被批准进入临床试验。
1.2 研究设备和药品
FLIPUS 采用CZG200 型超声关节治疗仪(重庆融海超声医学研究中心有限公司),仪器配置有4 个可移动调节间距的治疗超声换能器(治疗头),同时发射超声波。换能器频率0.6 MHz,重复频率300 Hz,额定输出声功率0.6 W,治疗头焦平面距离28 mm。
药物采用双氯芬酸钠缓释片,北京诺华制药有限公司生产,剂量为75 mg/片。
1.3 研究方法
1.3.1 研究设计和分组 本研究设计采用单中心随机对照临床试验。采用随机数字表法随机分配受试者至试验组及对照组,2 组比例1:1。其中,A 组为试验组,接受FLIPUS治疗。B 组为对照组,口服双氯芬酸钠缓释片治疗。根据查阅文献后得知双氯芬酸钠缓释片治疗骨关节炎的有效率为76.67%[7],估计FLIPUS 有效率可达到90%。当显著性水平α=0.05,β=0.10,通过公式计算可得:每组所需样本量N=45;在受试者中可能有中途失访及各种原因终止的患者,故须增加10%~15%的样本量,校正样本含量N=50,即每组50 例患者,故确定2 组患者样本量为100 例[8]。
1.3.2 随机方法 采用计算机软件生成含100 个数字的随机数字表,患者就诊序号对应100 个随机数字,奇数进入A 组,偶数进入B 组。若其中一组病例数已经达到50 例,则余下的全部归入另一组。
1.3.3 分配隐藏、盲法设计及实施 由研究者招募受试者,施行单盲法。患者知情同意后由第三方拆封后按照分配方案实施治疗。采取2 个层次的盲法。第一,盲评价者。评价者由非本次研究人员参与,其本身不清楚分组情况及其意义,并减少与受试者进行不必要的交流。第二,盲统计者。统计者不知晓分组情况及其意义。
1.3.4 治疗方案 根据患者膝关节大小调整4 个超声治疗头的位置,使之分别对应双膝关节内外膝眼及内外侧关节缝隙。治疗采用固定法,治疗档选用康复模式,开启功率源,每次治疗20 min,设备自动计时。
A 组采用FLIPUS 治疗,每日1 次,每次20 min,10 次1 个疗程。B 组口服双氯芬酸钠缓释片75 mg,每日1 次,连续服用10 d。
在整个研究期内,2 组受试者均要求不服用其他非甾体抗炎药、透明质酸钠、氨基葡萄糖等药物,不接受其他物理治疗。
1.4 疗效评价指标
1.4.1 关节疼痛程度判断 采用视觉模拟评分法(visual analogue scale,VAS)评价20 m 步行疼痛程度。让患者根据实际疼痛程度在直尺上做记号,表示疼痛评分。
1.4.2 受累膝关节结构及功能评价 采用西安大略和麦克马斯特大学骨关节炎调查量表(Western Ontario McMaster Universities Osteoarthritis Index,WOMAC)评价关节结构及功能状态。从关节功能、关节僵硬程度和关节疼痛3 个方面共24 个项目评估KOA 的严重程度。分数记录时可以使用VAS 尺度或5 级(0 ~4)尺度。
1.4.3 受累膝关节病情严重程度评价 采用勒凯纳指数(Lequesne index,LI)从受累关节的休息痛、运动痛、压痛、行走能力、晨僵及肿胀6 个方面评价KOA 患者关节疼痛及关节功能受限的情况。LI 总分为0 ~23 分,得分越高,说明病变程度越重。
1.4.4 膝关节活动度测定 采用膝关节伸展 - 屈曲角度测定膝关节活动度(knee range of motion,KROM)。患者俯卧位,量角器轴心位于腓骨小头,股骨长轴与固定臂保持平行,腓骨长轴与移动臂保持平行。记录患者膝关节最大伸展角度及最大屈曲角度,最大屈曲角度与最大伸展角度之差为KROM。
1.4.5 步行速度测定 采用10 m 最大步行速度(maximum walking speed,MWS)测定步行速度。让患者以最快速度行走10 m 距离,用秒表记录步行时间并精确到0.1 s,共测试3 次取平均值,并以m/min 描述MWS 评测值。
1.4.6 不良事件 记录与超声和药物相关不良事件,包括:治疗区域疼痛,皮肤红斑,灼伤,髌下小腿内侧面及足内侧缘的皮肤感觉障碍,头痛,眩晕,皮疹,荨麻疹,药物热,血小板减少症或出现原因不明的青肿或出血,肝、肾功能异常,恶心,呕吐,腹痛,腹泻,消化不良,食欲减退,消化道溃疡,消化道出血,呕血,便血等。
1.4.7 观察时点和评价内容 治疗前,治疗第3 日、第6 日、第10 日,采用VAS、WOMAC、LI 评价患者疼痛及关节功能障碍改善情况。治疗前、治疗第10 日,采用KROM、MWS 评价关节功能改善情况。治疗前,治疗结束后4 周、12 周,采用VAS、LI 评价远期疗效。
1.5 统计学方法
运用SPSS 19.0 软件进行统计学分析。正态分布定量资料以±s 表示,组间比较采用独立样本t 检验,各组内治疗前后不同时间点资料对比采用单因素重复测量方差分析或配对t 检验;非正态分布定量资料以中位数(四分位距)[M(interquartile range,IQR)]表示,组间比较采用Mann-Whitney U 检验,各组内治疗前后不同时间点资料对比采用符号秩检验;定性资料以频数(百分比)表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
2 结果
从2018 年8 月至2019 年8 月,根据纳入标准和排除标准共纳入患者100 例。因消化道不良事件脱落2 例,脱落率2%;因违背治疗方案剔除1 例,剔除率1%;最终共计纳入97 例患者,按照研究方案完成治疗和随访。
2.1 患者一般资料
97 例患者中男性26 例,女性71 例,2 组的性别、年龄、体质量指数(body mass index,BMI)、病程、血压、血糖及Kellgren & Lawrence 病情分级差异均无统计学意义(均P>0.05)(表1)。

表1 2 组KOA 患者的一般资料Tab 1 Demographic characteristics of the two groups
2.2 患者基线资料
2 组患者治疗前WOMAC 评分、VAS 评分、LI 评分、KROM、MWS 比较差异均无统计学意义(均P>0.05)(表2)。
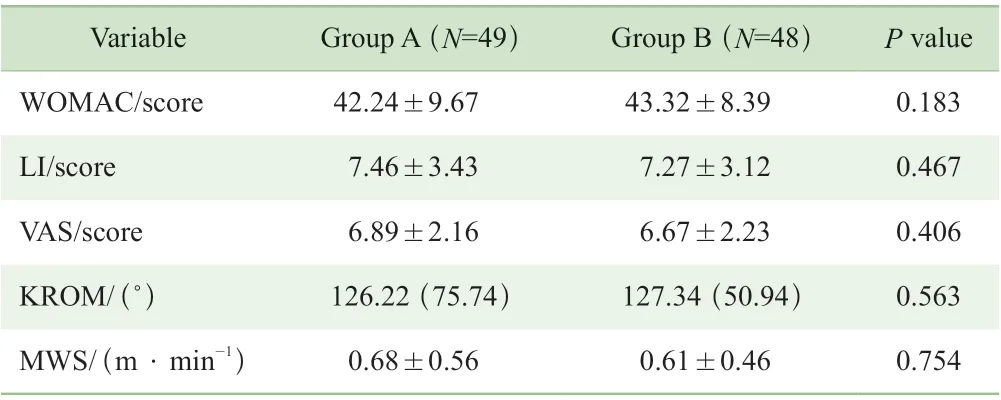
表2 治疗前WOMAC 评分、LI 评分、VAS 评分、KROM 及MWS 组间对比Tab 2 Comparisons of WOMAC scores, LI scores, VAS scores, KROM and MWS between the two groups before intervention
2.3 疗效评价
2.3.1 关节疼痛评分比较 治疗第3 日、第6 日、第10日VAS 评价结果显示,2 组VAS 评分均逐渐降低,组内治疗前后比较差异有统计学意义(均P=0.000)。治疗第6日及第10 日,A 组VAS 评分低于B 组,2 组比较差异有统计学意义(P=0.021,P=0.000)(表3)。
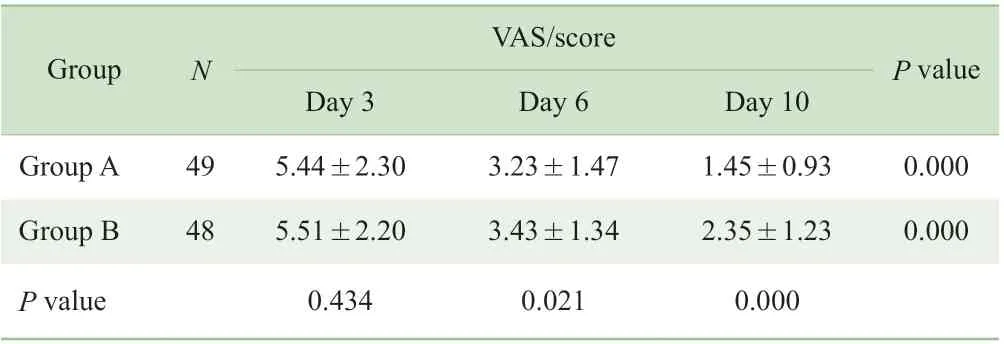
表3 2 组各疗效评价时间点VAS 评分比较Tab 3 VAS scores of the two groups at different time points
2.3.2 受累膝关节结构及功能评价 治疗第3 日、第6日、第10 日的WOMAC 评价结果显示,2 组WOMAC 评分均逐渐降低,组内治疗前后比较差异有统计学意义(均P=0.000)。治疗第6 日及第10 日,A 组WOMAC 评分低于B 组,2 组比较差异有统计学意义(P=0.005,P=0.001)(表4)。
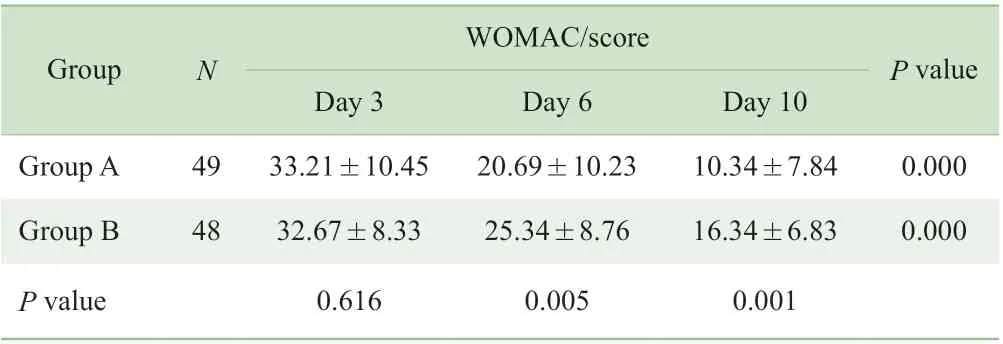
表4 2 组各疗效评价时间点WOMAC 评分Tab 4 WOMAC scores of the two groups at different time points
2.3.3 受累膝关节病情严重程度评价 治疗第3 日、第6 日、第10 日的LI 评价结果显示,随着治疗时间延长, 2 组LI 评分均逐渐降低,差异有统计学意义(均P=0.000)。治疗第10 日,A 组LI 评分低于B 组,2 组比较差异有统计学意义(P=0.000)(表5)。
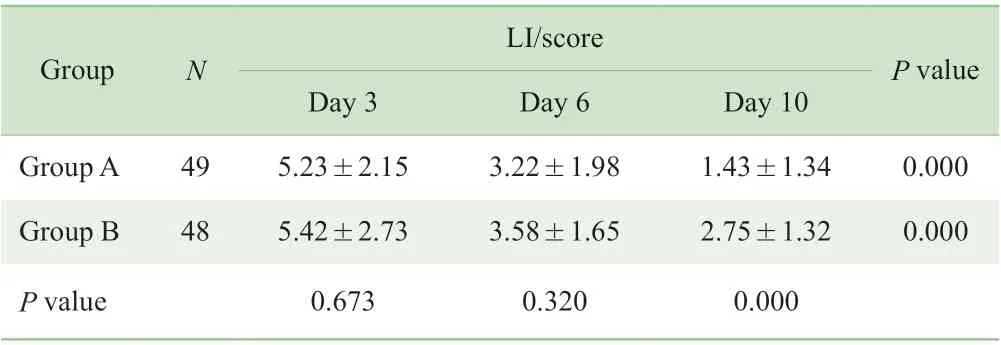
表5 2 组各疗效评价时间点LI 评分Tab 5 LI scores of the two groups at different time points
2.3.4 治疗前后KROM 变化情况 治疗第10 日2 组的KROM 水平均较基线水平有所增加,组内治疗前后比较差异有统计学意义(P=0.000)。治疗第10 日,A 组KROM大于B 组,但差异无统计学意义(P=0.064)(表6)。
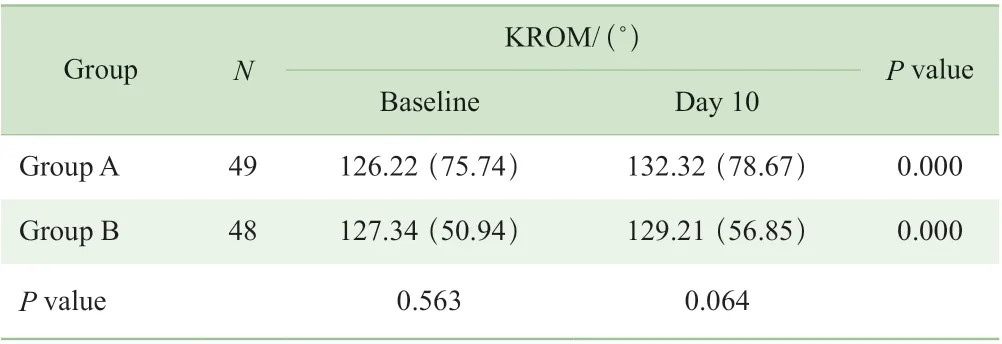
表6 2 组KROM 对比Tab 6 Comparisons of KROM between the two groups
2.3.5 治疗前后步行速度变化情况 治疗第10 日2 组的MWS 均较基线水平有所增加,组内治疗前后比较差异有统计学意义(P=0.000)。治疗第10 日,A 组MWS 大于B 组,差异有统计学意义(P=0.006)(表7)。

表7 2 组MWS 对比Tab 7 Comparisons of MWS between the two groups
2.3.6 远期疗效评价 治疗结束后4 周、12 周,通过电话或门诊就诊方式随访患者,采用VAS、LI 评价远期疗效。VAS 评价结果显示,随着治疗结束时间延长,2 组疼痛症状均呈加重趋势,但A 组VAS 评分均明显低于B 组(P=0.000,P=0.015)。LI 评价结果显示,随着治疗结束时间延长,2 组KOA 病情均呈加重趋势,但A 组LI 评分明显低于B 组(均P=0.000)(表8)。
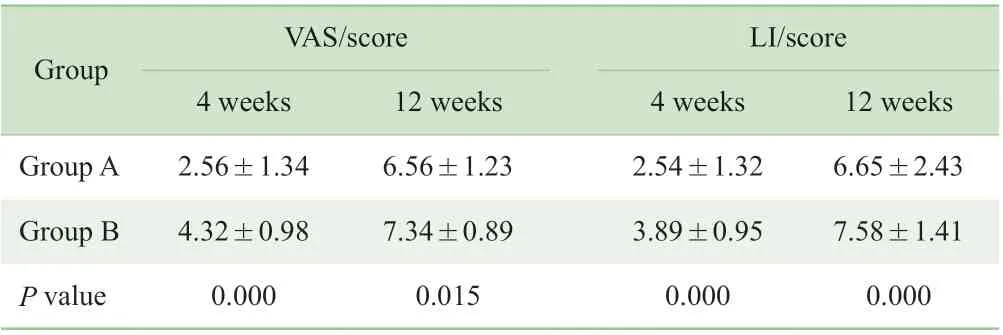
表8 治疗结束后4 周及12 周VAS、LI 评分Tab 8 VAS and LI scores 4 weeks and 12 weeks after intervention
2.4 安全性评价结果
按研究方案入组并接受治疗的99 例患者中,研究期内未发生危及生命、导致机体功能的永久性伤害或者机体结构的永久性损伤的严重不良事件,2 例患者因消化道不良事件退出研究。99 例患者中,不良事件发生率10.10%(10/99),其中A 组无不良事件发生;B 组10 例发生不良事件,发生率为20.00%,分别为眩晕1 例(2.00%),转氨酶升高 1 例(2.00%),上腹部疼痛、恶性呕吐等消化道症状8 例(16.00%)。所有不良事件均与服用双氯芬酸缓释片相关,与FLIPUS 治疗无关。
3 讨论
KOA的主要临床表现为关节疼痛及功能障碍,是影响人类健康和引起生理功能障碍的常见原因之一。2013 年, 美国骨科医师协会(American Academy of Orthopaedic Surgeons,AAOS)颁布了《膝关节骨关节炎循证医学指南》(第2 版),推荐肌力训练、低强度有氧运动、神经肌肉训练以及NSAID 等手段治疗症状性KOA 患者。同时,AAOS 制定该指南的工作组强调,明确膝关节骨关节炎的治疗仍需要更加深入的科学研究。
超声作为一种物理因子,与药物及手术治疗相比,具有无创、不良反应小等优点,早在1952 年即应用于KOA的治疗[9]。尽管有meta 分析[10]认为超声治疗可以缓解KOA 疼痛,改善膝关节功能,然而传统超声治疗KOA 的临床效果仍备受质疑[11-12]。因此需要从超声的生物学效应和物理参数入手,作进一步的研究及优化,以寻求更有效的超声参数用于治疗KOA。
超声具有良好的聚焦性、穿透性和能量沉积性;其在介质中传播,与生物组织相互作用可产生机械效应、温热效应及空化效应等生物学效应。首先,研究[13]表明,0.5 ~13.0 MHz 频段内的超声在生物组织内传播时,超声衰竭与超声频率大致呈线性关系,即频率越低,在生物组织中传播时超声衰减越少,穿透力越强。频率为1 MHz的超声穿透组织深度为3 ~5 cm[11]。Clement 等[14]的研究表明频率为0.74 MHz 超声可穿透颅骨。贾小林等[15]的研究也证实,0.6 MHz 的超声较1.0 MHz 和1.5 MHz 的超声能更好地促进关节软骨全层损伤的修复。周崑等[16]采用0.6 MHz 的超声波作用于关节软骨,证实该频率的超声波可以穿透关节软骨,通过机械作用促进葡萄糖等小分子物质向软骨内透入。其次,传统非聚焦超声治疗KOA 多采用的强度为1.0 ~2.5 W/cm2,频率为1.0 ~1.5 MHz[12,17-23], 以连续的能量输出方式进行治疗,作用机制是利用超声照射关节周围肌肉等软组织,利用超声的温热效应缓解关节疼痛[20-23]。虽然该治疗方法取得一定的效果,但病变的原发病灶,即关节软骨未得到有效的治疗,可能是导致临床疗效不确定的原因之一。
由于软骨处于关节内部,位置较深,传统较高频率的非聚焦超声穿透能力差,在传播过程中能量发生衰减,很少有超声能量进入到关节间隙内,难以直接作用于关节软骨。皮肤对超声能量刺激比较敏感,不能通过单纯提高超声能量达到治疗目的。Atkins 等[24]报道,多普勒成像模式下(3 MHz,290 mW/cm2)作用10 min,软组织升温仅0.21℃。本研究选择超声声强仅为120 mW/cm2,远低于多普勒超声声强,加之采用脉冲输出方式,其温热效应可以忽略不计。因此,本研究所采用的超声主要发挥其机械效应,而非温热效应。较低的超声能量不会引起治疗处皮肤的疼痛不适,同时较低频率的聚焦超声穿透能力较强,能量衰减小,能保证足够的超声能量直接作用退变软骨及软骨细胞的微环境,起到治疗作用。
由于观察到FLIPUS 治疗KOA 显著的临床效果,我们通过FLIPUS 干预新西兰兔KOA 模型,试图从软骨基质代谢、软骨细胞增殖与凋亡及软骨细胞生存微环境等角度进一步阐明FLIPUS 治疗KOA 的作用机制[13]。该研究结果表明:①FLIPUS 作用于关节软骨,能明显延缓KOA模型兔软骨基质的主要成分——Ⅱ型胶原及蛋白多糖的丢失,达到保护关节软骨,延缓KOA 自然病程的目的。②FLIPUS 在早期能有效地刺激软骨细胞增殖,并延缓软骨细胞凋亡;其主要通过减少软骨细胞凋亡维持有效软骨细胞数量,起到延缓软骨退变的目的。③FLIPUS 通过减少KOA 关节积液量,缓解关节内压力,加速积液中的一氧化氮、前列腺素E2 等炎症因子代谢从而缓解炎症反应,改善软骨细胞生存的微环境,延缓软骨细胞凋亡,保护关节软骨及恢复关节功能。
本研究结果表明,FLIPUS 在减轻疼痛、改善关节功能、减缓病情发展方面优于双氯芬酸钠缓释片。在安全性评价方面,FLIPUS 没有引起不良事件的发生。研究中发生的不良事件包括头痛、头晕、眩晕及胃肠道症状,均与服用双氯芬酸钠缓释片有关,与FLIPUS 治疗无关。以双氯芬酸钠为代表的NSAID 为AAOS 指南所推荐一线用药,其疗效确切,服用简便,费用较低廉。但是KOA 属于慢性退行性疾病,实际临床中往往需要为患者制定长期的治疗方案。众所周知,长期服用NSAID 会并发消化道出血、心血管疾病等不良事件。结合本试验研究结果,患者连续服用10 d 后,NSAID 相关不良事件的发生率达20.00%。随着服药时间延长,NSAID 相关不良事件的发生率还将升高,说明NSAID 并不适合KOA 患者长期服用。本研究结果表明,FLIPUS 使用的安全性明显优于NSAID。
本研究还存在以下不足之处:①FLIPUS 的疗程为10 d,根据双氯芬酸钠缓释片安全服用前提下的推荐疗程而设定。由于软骨代谢缓慢,治疗时间和治疗周期可能需要延长,其最优设置、患者的依从性和疗程的间隔等还需要进一步探索,以便制定最优治疗方案。②选择Kellgren & Lawrence 病情Ⅰ~Ⅲ级的KOA 患者作为研究对象,对各个分级的疗效差异尚未纳入分析研究。③未纳入Ⅳ级有手术指征的KOA 患者,对该类患者行FLIPUS 治疗的可行性需要进一步研究。④由于短期药物或超声等非手术治疗对KOA 的影像学改变并不明显,故本研究未纳入影像学疗效评价标准,在以后的研究中可甄选敏感影像学指标进行疗效评价。
综上所述,FLIPUS 能明显缓解KOA 患者的关节疼痛,改善膝关节功能,提高步行速度,在治疗中无不良事件发生。研究结果表明FLIPUS 治疗KOA 安全、有效,值得临床推广。
参·考·文·献
[1] Hamerman D. Aging and osteoarthritis: basic mechanisms[J]. J Am Geriatr Soc, 1993, 41(7): 760-770.
[2] Creamer P, Hochberg MC. Osteoarthritis[J]. Lancet, 1997, 350(9076): 503-508.
[3] McAlindon T, Dieppe P. The medical management of osteoarthritis of the knee: an inflammatory issue?[J]. Br J Rheumatol, 1990, 29(6): 471-473.
[4] Zhang W, Moskowitz RW, Nuki G, et al. OARSI recommendations for the management of hip and knee osteoarthritis, part Ⅰ: critical appraisal of existing treatment guidelines and systematic review of current research evidence[J]. Osteoarthritis Cartilage, 2007, 15(9): 981-1000.
[5] Zhang W, Moskowitz RW, Nuki G, et al. OARSI recommendations for the management of hip and knee osteoarthritis, part Ⅱ: OARSI evidence-based, expert consensus guidelines[J]. Osteoarthritis Cartilage, 2008, 16(2): 137-162.
[6] 王欢, 孙贺, 张耀南, 等. 中国40 岁以上人群原发性膝骨关节炎各间室患病状况调查[J]. 中华骨与关节外科杂志, 2019, 12(7): 528-532.
[7] Bjordal JM, Klovning A, Ljunggren AE, et al. Short-term efficacy of pharmacotherapeutic interventions in osteoarthritic knee pain: a meta-analysis of randomised placebo-controlled trials[J]. Eur J Pain, 2007, 11(2): 125- 138.
[8] 王杨, 李卫, 成小如, 等. 随机模拟法验证非劣效临床试验样本量计算公式[J]. 中国卫生统计, 2008, 25(1): 26-28.
[9] Preux TD. Ultrasonic wave therapy in osteoarthritis of the hip joint[J]. Br J Phys Med, 1952, 15(1): 14-19.
[10] Loyola-Sánchez A, Richardson J, MacIntyre NJ. Efficacy of ultrasound therapy for the management of knee osteoarthritis: a systematic review with metaanalysis[J]. Osteoarthritis Cartilage, 2010, 18(9): 1117-1126.
[11] Ulus Y, Tander B, Akyol Y, et al. Therapeutic ultrasound versus sham ultrasound for the management of patients with knee osteoarthritis: a randomized doubleblind controlled clinical study[J]. Int J Rheum Dis, 2012, 15(2): 197-206.
[12] Welch V, Brosseau L, Peterson J, et al. Therapeutic ultrasound for osteoarthritis of the knee[J]. Cochrane Database Syst Rev, 2001, 3(3): CD003132.
[13] Jia L, Chen JY, Wang Y, et al. Focused low-intensity pulsed ultrasound affects extracellular matrix degradation via decreasing chondrocyte apoptosis and inflammatory mediators in a surgically induced osteoarthritic rabbit model[J]. Ultrasound Med Biol, 2016, 42(1): 208-219.
[14] Clement GT, Hynynen K. A non-invasive method for focusing ultrasound through the human skull[J]. Phys Med Biol, 2002, 47(8): 1219-1236.
[15] 贾小林, 陈文直, 司海鹏, 等. 超声对兔关节软骨损伤的修复作用[J]. 中华创伤杂志, 2004, 20(2): 97-99.
[16] 周崑, 周伟, 陈文直, 等. 低强度脉冲超声对美蓝渗入正常兔膝关节软骨的作用[J]. 重庆医科大学学报, 2012, 37(2): 121-124.
[17] Huang MH, Lin YS, Lee CL, et al. Use of ultrasound to increase effectiveness of isokinetic exercise for knee osteoarthritis[J]. Arch Phys Med Rehabil, 2005, 86 (8): 1545-1551.
[18] Park K, Hoffmeister B, Han DK, et al. Therapeutic ultrasound effects on interleukin-1β stimulated cartilage construct in vitro[J]. Ultrasound Med Biol, 2007, 33(2): 286-295.
[19] Cakir S, Hepguler S, Ozturk C, et al. Efficacy of therapeutic ultrasound for the management of knee osteoarthritis: a randomized, controlled, and double-blind study[J]. Am J Phys Med Rehabil, 2014, 93(5): 405-412.
[20] Cetin N, Aytar A, Atalay A, et al. Comparing hot pack, short-wave diathermy, ultrasound, and TENS on isokinetic strength, pain, and functional status of women with osteoarthritic knees: a single-blind, randomized, controlled trial[J]. Am J Phys Med Rehabil, 2008, 87(6): 443-451.
[21] Falconer J, Hayes KW, Chang RW. Effect of ultrasound on mobility in osteoarthritis of the knee. A randomized clinical trial[J]. Arthritis Care Res, 1992, 5(1): 29-35.
[22] Ulus Y, Tander B, Akyol Y, et al. Therapeutic ultrasound versus sham ultrasound for the management of patients with knee osteoarthritis: a randomized double-blind controlled clinical study[J]. Int J Rheum Dis, 2012, 15(2): 197-206.
[23] Ozgönenel L, Aytekin E, Durmuşoglu G. A double-blind trial of clinical effects of therapeutic ultrasound in knee osteoarthritis[J]. Ultrasound Med Biol, 2009, 35(1): 44-49.
[24] Atkins TJ, Duck FA. Heating caused by selected pulsed Doppler and physiotherapy ultrasound beams measured using thermal test objects[J]. Eur J Ultrasound, 2003, 16(3): 243-252.

