右旋糖酐水解改善右旋糖酐分子量分布的研究
慕 娟,问清江,郑巧霞,孙晓宇,丁 浩
(陕西省微生物研究所, 陕西 西安 710043)
右旋糖酐(Dextran)具有增加血容量、改善微循环、防止弥散性血管内凝血的作用,主要用于治疗失血性休克,是目前公认的优良血浆代用品之一,是美国FDA最早批准使用的多糖药品。临床上应用的常有3种规格产品:右旋糖酐70、右旋糖酐40、右旋糖酐20。右旋糖酐的生产原理为:蔗糖经肠膜状明串珠菌(Leuconstocmesenteriodes)产生的右旋糖酐蔗糖酶(Dextransucrase;E.C.2.4.1.5)合成右旋糖酐(粗酐),粗酐进一步水解、分离纯化为药品右旋糖酐[1~2]。我国现有的右旋糖酐生产工艺中,右旋糖酐的水解采用盐酸水解,由于盐酸水解缺乏专一性,出现粗酐中的残留蔗糖与右旋糖酐竞争水解,随机性强,反应过程难控制,右旋糖酐分子量分布不集中,水解稳定性差,产品分子量分布受到极大的影响。从右旋糖酐40的分子量分布来看,我国的产品标准低于欧美国家(表1),不仅分子量的分布不集中,而且重均分子量下移;实际产品质量往往只能达到重均分子量的下限,否则就难以满足10%大分子≤120 000,10%小分子≥5 000。在右旋糖酐40制备工艺改进研究中发现,当发酵水平低下时,其他工艺条件不变的情况下,粗酐的盐酸水解结果异常,还原糖变化增加较大,但水解产物的重均分子量却没有相应的降低,反而高于发酵水平高,酸解还原糖变化小的水解产物的重均分子量。分析原因,粗酐中的残留蔗糖与右旋糖酐产生竞争水解,因此需要进一步研究。

表1 不同国家右旋糖酐40分子量分布[3~5]
右旋糖酐酶(Dextranase,EC 3.2.1.11)能够催化水解右旋糖酐(Dextran)分子中的α-1,6葡萄糖苷键,降解为小分子的右旋糖酐、异麦芽糖、异麦芽三糖、葡萄糖及少量的多聚糖。右旋糖酐酶水解右旋糖酐,具有专一性和高效性,可以提高水解效率;酶的底物特异性显示酶的亲和力随底物分子量的增加而增强,尤其是对分子量1000万以上的右旋糖酐的亲和力远远大于100万以下的右旋糖酐,这一特点有益于改善水解物的分子量分布[6]。笔者主要对蔗糖与右旋糖酐盐酸水解竞争、盐酸底物特异性等右旋糖酐酸解机理进行研究,同时进行右旋糖酐在酶解时是否有蔗糖竞争存在,右旋糖酐酶解条件等研究,最终实现改善右旋糖酐产品分子量分布的目标。
1 材料和方法
1.1 材料
1.1.1 试剂 葡萄糖(D-(+)-Glucose),Sigma 公司产品;蔗糖(AR),3,5-二硝基水杨酸(CP);浓盐酸(AR);其他试剂为市售分析纯。
1.1.2 右旋糖酐酶 (宁夏夏圣实业集团有限公司)。
1.1.3 右旋糖酐 (陕西省微生物研究所自制)。
1.1.4 仪器 722分光光度计(上海精密科学仪器有限公司);85-2数显恒温磁力搅拌器(杭州仪表电机有限公司);101型电热鼓风干燥箱(北京科伟永兴仪器有限公司); 2010A-HT高效液相色谱仪(苏州贝锐仪器科技有限公司)。
1.2 方法
1.2.1 蔗糖与右旋糖酐盐酸水解竞争性 取0.5 mL的0.3% HCl溶液加入到0.5 mL 1%的右旋糖酐(蔗糖)溶液中,95℃准确反应10 min,加入2 mL DNS终止反应,沸水浴2 min显色,然后流水冷却至室温,定容至10 mL;空白对照,0.5 mL 1%的右旋糖酐(蔗糖)溶液95℃准确保温10 min,先后加入2 mL DNS和0.5 mL 0.3% HCl溶液,沸水浴2 min显色,然后流水冷却至室温,定容至10 mL。以蒸馏水为对照测定540 nm的吸光值,样品和空白对照的吸光值之差根据葡萄糖标准曲线的回归方程得出反应液中的葡萄糖量,从而确定还原糖的变化。
1.2.2 右旋糖酐酶的专一性 将右旋糖酐酶用一定pH值的缓冲液适当稀释后,取0.5 mL的酶液加入到0.5 mL 1%的右旋糖酐(蔗糖)溶液中,50℃准确反应10 min,加入2 mL DNS终止反应,沸水浴2 min显色,然后流水冷却至室温,定容至10 mL;空白对照,0.5 mL 1%的右旋糖酐(蔗糖)溶液50℃准确保温10 min,先后加入2 mL DNS和0.5 mL的酶液,沸水浴2 min显色,然后流水冷却至室温,定容至10 mL。以蒸馏水为对照测定540 nm的吸光值,样品和空白对照的吸光值之差进行比较,以确定右旋糖酐酶的专一性。
1.2.3 不同分子量右旋糖酐盐酸水解特异性 分别以重均分子量T-10、T-40、T-70、T-500、T-1000、T-10000的右旋糖酐作为水解底物,按照1.2.1进行盐酸水解,测定还原糖的量确定还原糖的变化。
1.2.4 不同水解方法制备右旋糖酐40 主要有:
1.2.4.1 盐酸水解右旋糖酐制备右旋糖酐40。在盐酸浓度0.8%,粗酐6.0%,温度95℃,水解时间3.0 h条件下酸解右旋糖酐,水解结束加入1.0%的活性炭脱色40 min,抽滤收集滤液,乙醇分离纯化,沉淀75%乙醇洗涤,干燥粉碎为右旋糖酐40。
1.2.4.2 右旋糖酐酶酶解右旋糖酐制备右旋糖酐40。右旋糖酐酶在粗酐6.0%,酶浓度0.1 IU·mL-1,时间3.5 h,温度50℃条件下酶解右旋糖酐,酶解结束立即升温至95℃灭活,同时加入活性炭脱色(95℃保温30 min),其余同1.2.4.1。
1.2.5 还原糖测定(以葡萄糖糖计)[6~7]采用DNS法测定葡萄糖糖。葡萄糖糖标准曲线绘制:配制1 mg·mL-1葡萄糖标准溶液,分别量取0.30、0.35、0.40、0.45、0.50 mL葡萄糖标准溶液,用蒸馏水补齐1.0 mL,再加入2.0 mL DNS,沸水浴2 min,冷水浴水冷却后加蒸馏水至10 mL,在540 nm进行光吸收测定,绘制葡萄糖糖标准曲线,得出回归方程用于葡萄糖的测定。
酶解液等样品稀释一定倍数,取样品1.0 mL加入2.0 mL DNS煮沸2 min显色,然后冷水浴冷却至室温,定容至10.0 mL,以蒸馏水为对照,540 nm测定吸光值,根据回归方程得出样品中的葡萄糖糖含量。
1.2.6 分子量与分子量分布[3]取样品适量,加流动相溶解并稀释制成每1 mL约含10 mg的溶液,振摇,室温放置过夜作为供试品溶液。另取4~5个已知分子量的右旋糖酐对照品,依法检查(2015版《药典》二部附录VH),样品10%大分子部分重均分子量不得大于120 000,10%小分子部分重均分子量不得小于5 000。
2 结果与分析
2.1 蔗糖与右旋糖酐盐酸水解竞争性
右旋糖酐和蔗糖在盐酸浓度0.15%,温度95℃等相同条件下水解,测定水解液中的还原糖,结果见图1。蔗糖水解为果糖和葡萄糖,右旋糖酐断开一个糖苷键可以产生一个还原端,因此在水解一个糖苷键时,前者的还原糖是后者的两倍。从图1可以看出,蔗糖的水解结果远远高于右旋糖酐,前者是后者的17倍,考虑蔗糖水解双还原糖产生,蔗糖水解是右旋糖酐的8倍,说明同一盐酸水解条件下,蔗糖水解具有极强的竞争性,蔗糖残存较多的粗酐盐酸水解时会受到一定的影响。表2是在右旋糖酐40制备工艺改进研究中的现象,右旋糖酐发酵维持在一定水平时,发酵液经过板框过滤、陶瓷膜微滤及超滤等发酵液后处理为粗酐液,粗酐液盐酸水解后,水解液的还原糖含量与右旋糖酐的重均分子量呈现反向关系,还原糖越高,重均分子量越底。当发酵异常,发酵水平过低时,发酵液的后处理工艺条件不变的前提下,水解液还原糖含量出现较大的增加,但右旋糖酐的重均分子量没有下降而是升高。原因在于,发酵水平下降,发酵液蔗糖残存增大,后处理后的粗酐溶液中蔗糖残存同样增大,粗酐盐酸水解时就会发生蔗糖的竞争水解,还原糖增加较多,但右旋糖酐的水解大大折扣,重均分子增高。这就是长期以来困扰右旋糖酐原料药生产中分子量分布难以控制的原因,要想改变这一状况,需要在水解工艺上寻找新的出路。
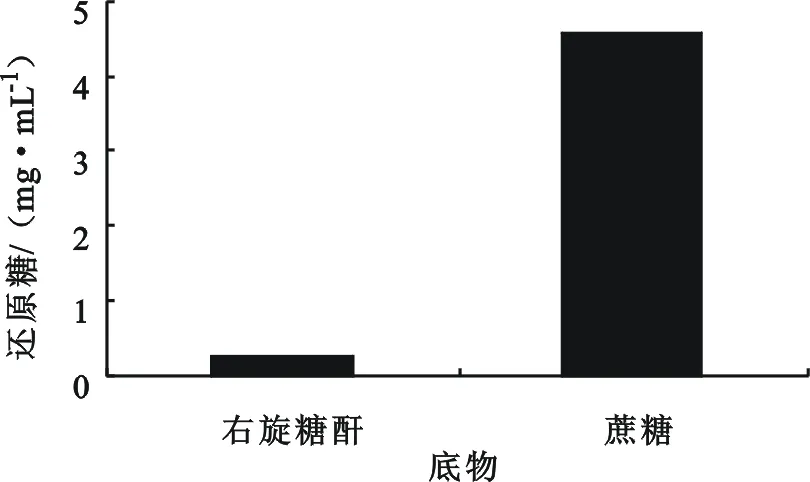
图1 蔗糖与右旋糖酐盐酸水解竞争性
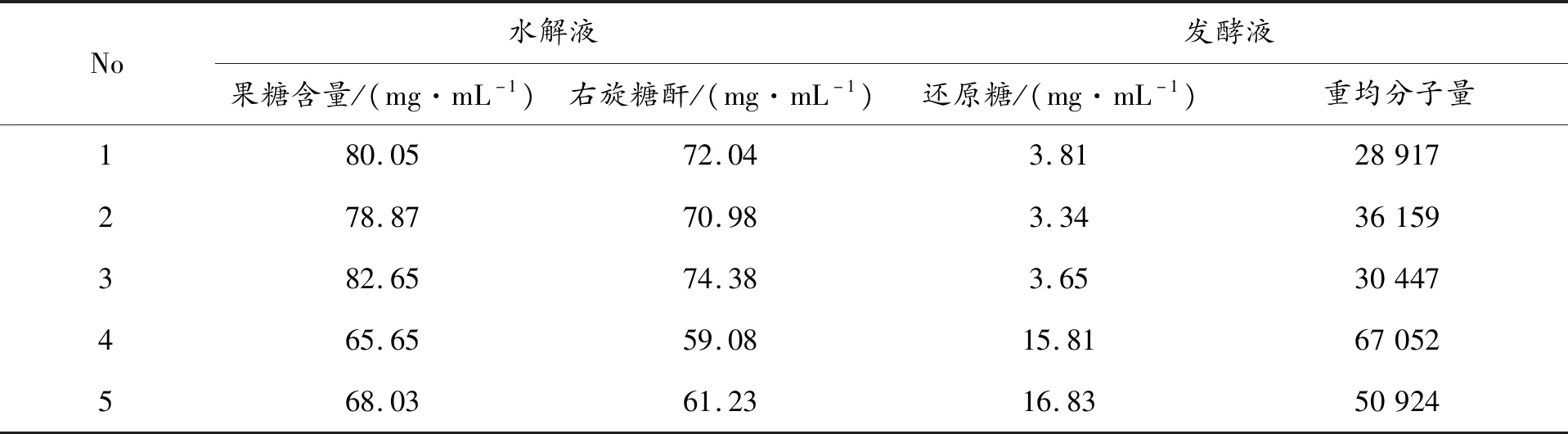
表2 右旋糖酐的盐酸水解
2.2 右旋糖酐酶的专一性
右旋糖酐和蔗糖在0.5%的底物浓度,pH5.0,0.16 IU·mL-1酶浓度,时间10 min,温度50℃的条件下酶解反应,进行还原糖测定(见图2)。结果表明右旋糖酐被右旋糖酐酶酶解,而蔗糖没有发生反应,与2.1中的盐酸水解完全不同,说明右旋糖酐酶具有高度的专一性,其可以选择性地降解右旋糖酐中的α-1,6葡萄糖苷键,对蔗糖中的糖苷键没有作用。右旋糖酐酶用于右旋糖酐的降解可以克服盐酸水解出现的非专一性降解,避免了粗酐中的蔗糖残留竞争水解,有利于右旋糖酐的水解条件的控制,保证了水解液分子量分布的稳定性,有利于后处理及不同分子量右旋糖酐的分离纯化。右旋糖酐的酶解结果也进一步予以说明(见表2)。虽然右旋糖酐发酵水平有所不同,但发酵液经过相同后处理用于右旋糖酐酶解,酶解液中还原糖的变化和重均分子量的大小的关系没有因发酵水平不同而异常,基本呈现相同的变化趋势:还原糖变化大,重均分子量则低。
2.3 不同分子量右旋糖酐盐酸水解特异性
在相同条件下对重均分子量不同的T-5,T-10,T-40,T-500,T-1000,T-2000和T-10000以上的右旋糖酐进行盐酸水解,测定其还原糖的变化(图3)。从T-5到T-2000还原糖无明显变化,基本保持在同一水平,T-10000远远高于其他。在同一盐酸水解环境中,T-10000的水解性强于其他,易于被水解;而T-5到T-2000水解性相当,被同步水解,大分子降解为小分子,小分子降解成更小分子,使得右旋糖酐水解液中的分子量分布过于分散而不均,不利于目标分子量右旋糖酐的分离纯化。而右旋糖酐酶的底物特异性表明,随着右旋糖酐分子量的增大,酶的亲和力增强,高分子量的易于降解,可以改善右旋糖酐酶解液分子量分布,易于低分子量右旋糖酐的制备[6]。
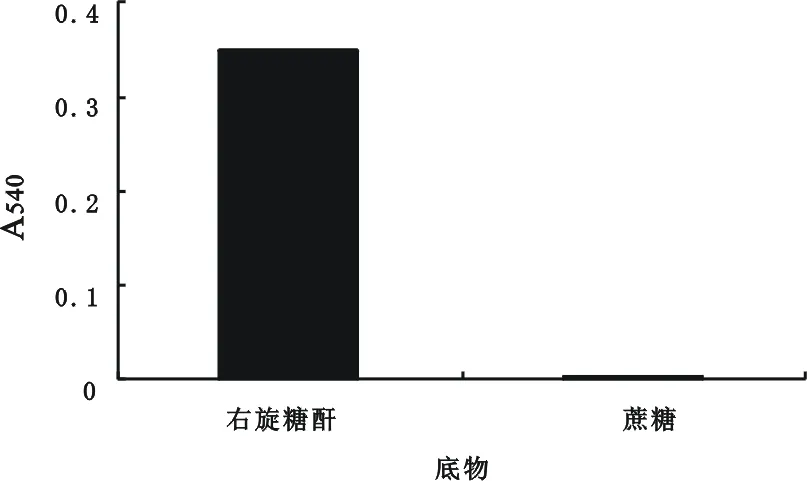
图2 右旋糖酐酶的专一性
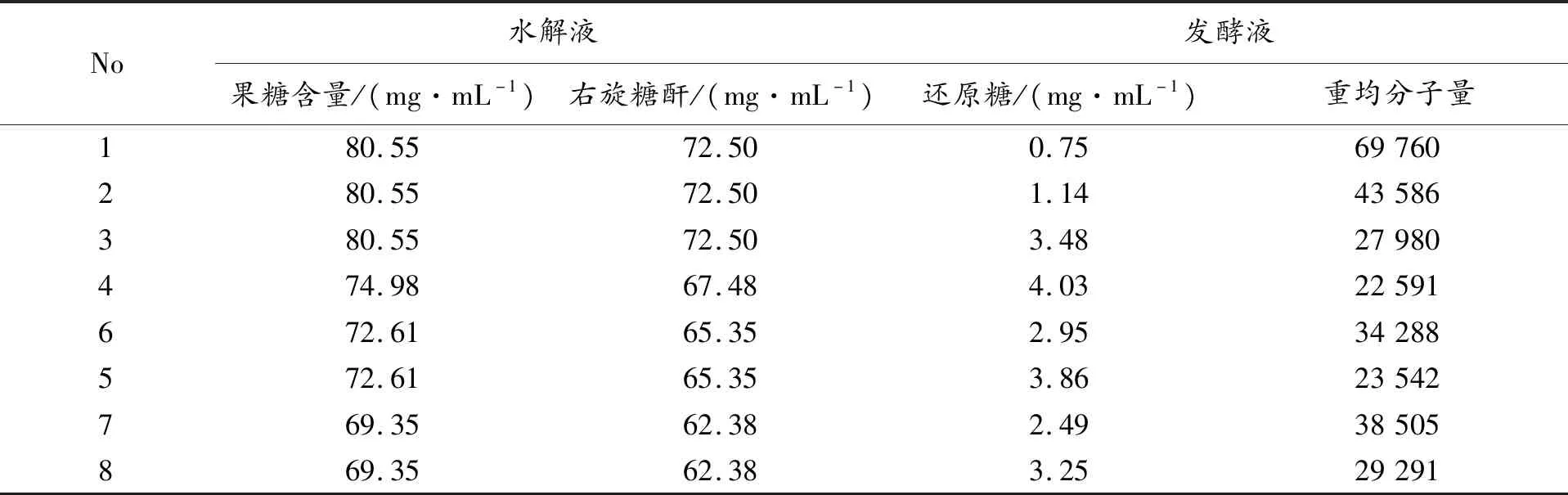
表3 右旋糖酐的酶解
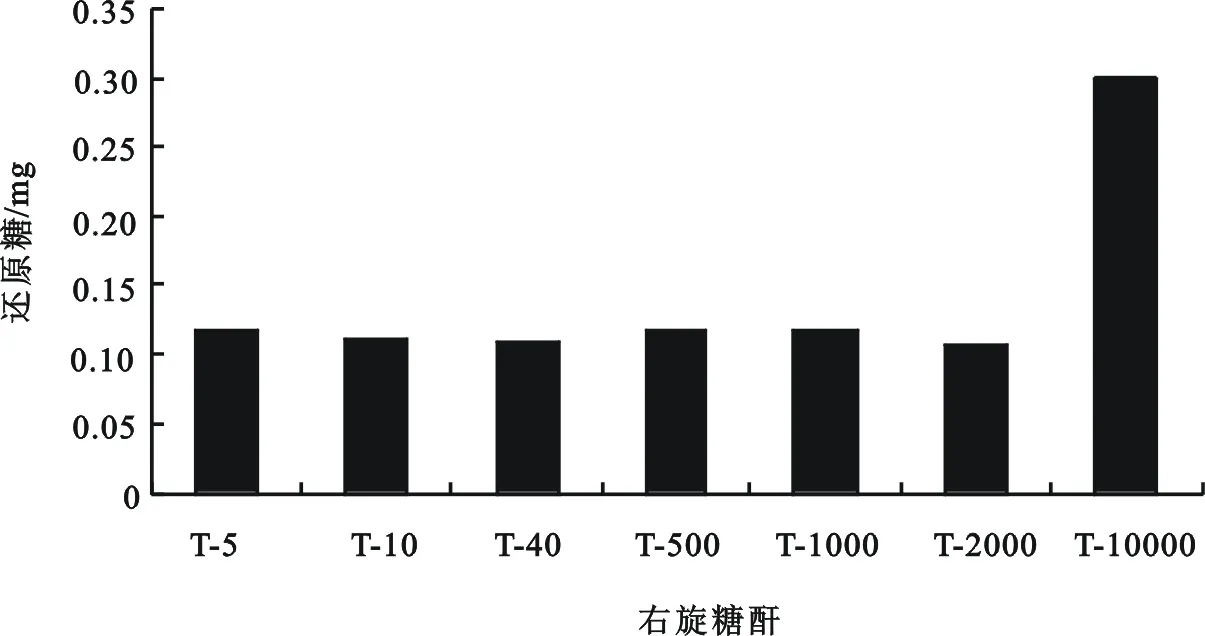
图3 不同分子量右旋糖酐盐酸水解特异性
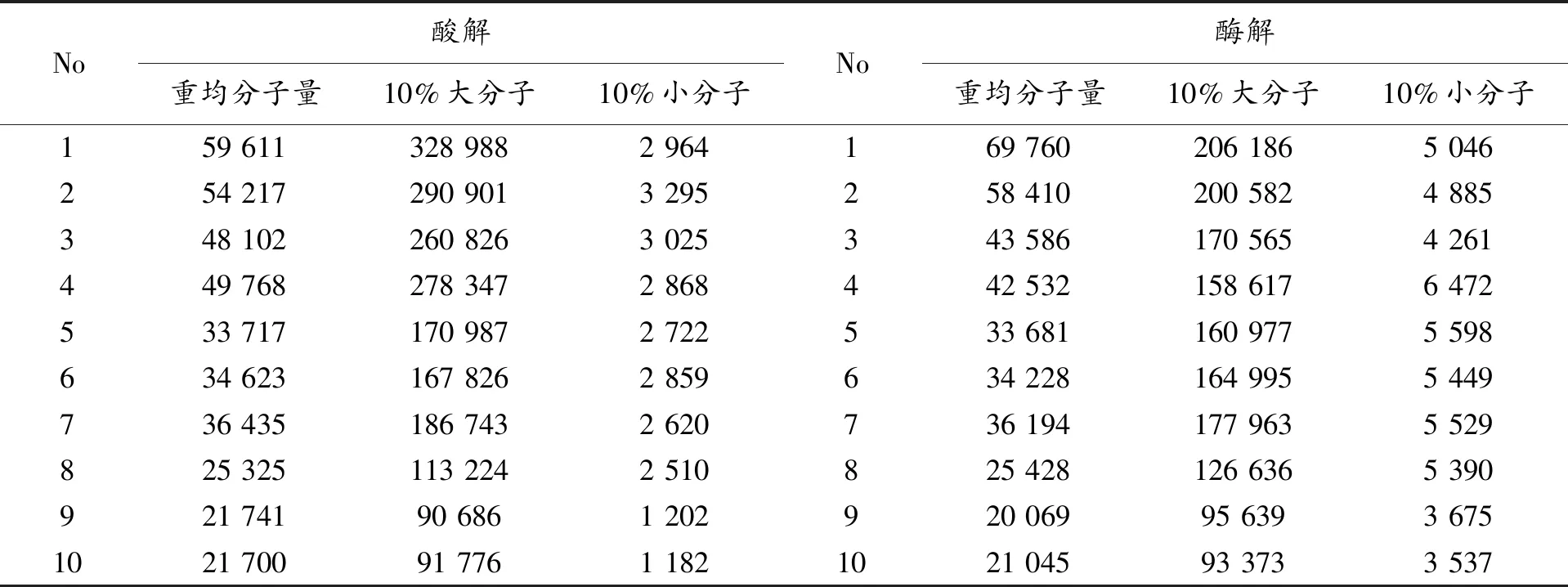
表4 右旋糖酐盐酸水解与右旋糖酐酶酶解比较
从右旋糖酐盐酸水解液和右旋糖酐酶解液分子量分布(表4)可以看出,在重均分子量40 000~70 000之间,重均分子量相当时,酸解10%大分子的分子量比酶解10%大分子的分子量高出100 000,10%小分子前者低于后者1 000,酶解分子量分布比酸解分子量分布相对集中,酶解可以改善分子量的分布;在在重均分子量20 000~40 000之间,重均分子量相当时,酸解和酶解10%大分子的分子量基本无差别,但酸解10%小分子的分子量比酶解10%小分子的分子量低2 000多,酶解分子量分布优于酸解分子量分布,酶解也改善了分子量的分布。总之,右旋糖酐酶酶解右旋糖酐可以改善分子量的分布,从而有益于通过降解高分子右旋糖酐制备低分子量右旋糖酐。
2.4 不同水解方法制右旋糖酐40
右旋糖酐分别用盐酸和右旋糖酐酶降解制备右旋糖酐40,结果见表5、表6。盐酸水解制备的右40分子量分布为,重均分子量33 000~36 000,10%大分子<120 000,10%小分子>5 000;右旋糖酐酶酶解制备的右旋糖酐分子量分布为,重均分子量38 000~42 000,10%大分子<110 000,10%小分子>7 000。前者达中国标准,后者改善了分子量分布,达到欧洲标准。但是盐酸水解右旋糖酐40的产率高于右旋糖酐酶解右旋糖酐40产率,最高差达7%,这就需要进一步优化右旋糖酐酶解制备右旋糖酐40等低分子右旋糖酐产品工艺条件,在提高产品质量的同时提高产率,使得酶解工艺能够替代酸解工艺用于右旋糖酐40等低分子右旋糖酐产品的生产。
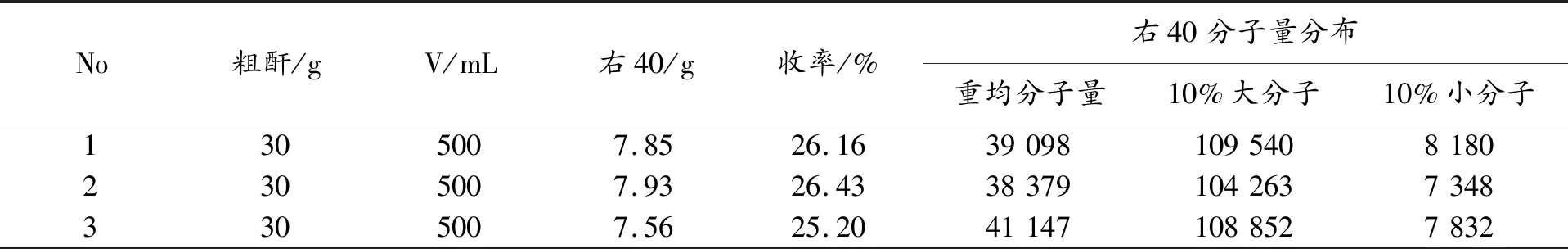
表6 右旋糖酐酶解制备右旋糖酐40
3 结论
在右旋糖酐40等原料药工艺改进研究中遇到右旋糖酐发酵水平有明显降低时,粗酐盐酸水解时的还原糖变化和右旋糖酐分子量分布关系异常,即还原糖变化超出正常数倍,而分子量没有降低,反而高于正常。分析原因可能是粗酐中的残留蔗糖也发生酸解,且蔗糖酸解竞争性强于右旋糖酐。蔗糖与右旋糖酐盐酸水解竞争性试验表明,同一盐酸水解条件下,蔗糖水解具有极强的竞争性,发酵水平下降,发酵液蔗糖残存增大,后处理后的粗酐溶液中蔗糖残存同样增大,粗酐盐酸水解时就会发生蔗糖的竞争水解,还原糖增加较多,但右旋糖酐的水解大大折扣,重均分子增高。这就是长期以来困扰右旋糖酐原料药生产中分子量分布难以控制的原因。用蔗糖和右旋糖酐进行了右旋糖酐酶专一性研究,结果表明右旋糖酐酶不降解蔗糖,可以专一性的降解右旋糖酐,右旋糖酐酶解结果表明,右旋糖酐发酵水平的变化对右旋糖酐酶酶解没有影响。不同分子量右旋糖酐盐酸水解特异性试验表明,在同一盐酸水解环境中,T-10000的水解性强于其他,易于被水解;而T-5到T-2000水解性相当,被同步水解,大分子降解为小分子,小分子降解成更小分子,使得右旋糖酐水解液中的分子量分布过于分散而不均,不利于目标分子量右旋糖酐的分离纯化。而右旋糖酐酶的底物特异性表明,随着右旋糖酐分子量的增大,酶的亲和力增强,高分子量的易于降解,可以改善右旋糖酐酶解液分子量分布,易于低分子量右旋糖酐的制备。分别采用盐酸水解和右旋糖酐酶酶解两种水解方法制备右旋糖酐40,结果表明,前者重均分子量低于后者,10%大分子大于后者,10%小分子小于后者,前者达到中国标准,后者达到欧洲标准。右旋糖酐酶解制备右旋糖酐40等原料药可以改善分子量分布。但是酶解制备右旋糖酐40的收率低于酸解,这就需要进一步研究酶解工艺条件,在提高产品质量的同时提高产率。再就是酶解引入酶蛋白,对于水解液后处理及产品的分离纯化提出新的要求,需要对工艺条件进一步研究。

