RNA干扰沉默胃癌细胞FasL表达的抗肿瘤免疫作用
何茂钦, 谭笑杏#, 阿合提别克·塔布斯, 马博, 李剑辉
在我国,胃癌的发病率、死亡率高居第2位,仅次于肺癌[1],也是全球癌症死亡主要病因之一[2]。近年来胃癌的治疗较以往已有很大的改进,但其5年总生存率低于25%,仍然不能令人满意[3]。胃癌发病原因尚未明确,已有学者发现胃癌细胞能够抑制NK细胞增殖,并诱导其凋亡,从而导致机体免疫功能异常[4]。肿瘤细胞的“反击”可能是恶性肿瘤疾病进展的原因。目前已知促进细胞凋亡的TNF超家族(如DR3、DR5、FasL、Fas),抑制细胞凋亡的有IAP家族(如Livin、Survivin)、Bcl⁃2家族、FLIP、NF⁃kB等。胃癌细胞能够高表达FasL、Liv⁃in、Survivin[5],从而逃避机体免疫。我们应用RNA干扰技术(RNA interferrence,RNAi)抑制胃癌细胞表达FasL,并将处理过的胃癌细胞与肿瘤特异性细胞毒T淋巴细胞(CTL)细胞共培养,探讨其中可能的作用机制。
1 材料与方法
1.1 实验材料
RPMI1640培养液、Hanks和PBS平衡液自行配制;丝裂霉素C(MMC)、促有丝分裂原ConA购自Sigma公司;淋巴细胞分离液由上海生化试剂二厂生产(比重1.077);T细胞分离和纯化柱(RTCC⁃5)和红细胞溶解试剂盒购自加拿大真达科技公司。Plasmid Mini Purification Kit,Lipofectamine,胎牛血清,聚凝胺购自Gibco公司,G418购自Promega,各限制性内切酶购自TaKaRa公司。IL⁃12P70和IFN⁃γELISA检测试剂盒购自晶美公司;细胞毒性分析试剂盒 Cyto Tox 96®Non⁃Radicative Cytotoxicity Assay Kit为Promega公司产品。mIL⁃12基因真核表达载体、DH5α大肠杆菌、PA317细胞、NIH3T3成纤维细胞,人外周血PBL取材自临床标本。
1.2 方法
1.2.1 胃癌细胞采集及Fas/FasL检测 取临床手术所切除胃癌组织标本(胃窦癌标本48例,胃体癌标本15例,Ⅰ期胃癌占10%,Ⅱ期占23%,Ⅲ期占67%,部分为新鲜手术标本,部分来源于组织标本库)。无菌条件下切取胃癌组织标本,经无菌Hanks液漂洗,用含1 g/L的Ⅰ型胶原酶、0.02 g/LⅡ型DNA酶和0.5 g/LⅠ型蛋白酶(Sigma Chemical Co,St.Louis,MO)的溶液消化肿瘤组织标本,获得细胞悬液。将上述细胞培养液制作细胞涂片,以S⁃P免疫组织化学染色方法,检测人胃癌细胞Fas/FasL蛋白的表达情况。
1.2.2 肿瘤特异性CD8+CTL提取、特异性T淋巴细胞的建立 淋巴细胞分离液常规分离胃癌患者外周抗凝血PBL,离心后吸取中间乳白色的淋巴细胞层。提取胃癌细胞膜表面抗原。96孔细胞培养板中加入单个或数个目标T细胞(有限稀释法),再分别加入一定数量的肿瘤上皮抗原、饲养细胞、ConA和IL⁃2。在5%CO2温箱中,37℃及95%湿度下培养1 h,将非贴壁细胞吸至离心管,再用37℃预温的完全(含血清)RPMI⁃1640液轻轻荡洗培养瓶,并将洗涤液亦收集到离心管中,在18~20℃下,离心10 min,弃上清,用5~10 mL完全RPMI⁃1640液重悬细胞,台盼蓝染色并计数活细胞,调整细胞浓度至0.5~1.0×107/mL。
1.2.3 构建siRNA载体并转染胃癌细胞后与CD8+CTL共培养 流式细胞仪检测胃癌细胞中FasL的表达,提取FasL⁃mRNA,设计并合成特异性引物。按文献报道方法合成FasL siRNA双链分子(FasL⁃shRNA),检测其基因沉默效应,序列经BLAST同源比较分析后显示与其他人类基因序列无同源性。构建携带上述shRNA的silencer质粒载体并通过转染体外培养的细胞检测其表达效率和抑制作用。构建携带上述shRNA的蔓病毒pLL3.7载体,同上述silencer质粒载体处理方法检测表达效率和抑制作用。转染前24 h,以1×105个/孔接种生长至对数期的目标细胞于6孔板,将已制备好的FasL⁃siRNA混合物加入6孔板,阴性对照组仅加入脂质体,空白对照组不做处理,转染参照LppofectamineTM2000说明,转染后培养。收集转染48 h的3组细胞,加入MTT溶液(5 mg/mL),确定靶细胞最佳浓度,即光密度值至少为培养基对照光密度值的2倍。然后加入培养基共同培养。培养3 d、5 d、7 d后,酶标仪测定各个孔的吸光度值(A值)。实验重复3次。
1.2.4 细胞侵袭能力及胃癌细胞凋亡率检测 实验前在Transwell小室中间的聚碳酸酯滤膜上铺上已预先稀释好的Matrigel胶。将生长至对数期的T细胞制备成不含血清的单细胞悬液100μL(约1×105个细胞),接种于Transwell小室的上室,Tran⁃swell小室下室的每孔中加入含血清的培养基500μL,培养箱中孵育24 h,取出小室,4%多聚甲醛固定15 min,0.1%的结晶紫染色10 min,PBS洗涤后将小室转移至24孔板,随机选择6~8个视野,倒置显微镜观察穿膜细胞数,取均值。实验重复3次。依赖Ca2+的磷脂结合蛋白Annexin V能够和PS(磷脂酸丝氨酸)高亲和结合。荧光素(FITC)标记的Annexin V被当作检测细胞膜表面PS的敏感探针,流式检测凋亡细胞。
2 结果
2.1 处理前后胃癌细胞表达FasL情况
免疫组化结果显示胃癌细胞有高表达FasL(图1),而低表达Fas,可诱导表达Fas受体的宿主淋巴细胞凋亡(图2),该机制可能参与了肿瘤的免疫逃逸,使肿瘤细胞逃避Fas/FasL系统介导的免疫清除作用。在导入FasL⁃siRNA(shRNA)后,流式细胞仪检测实验组胃癌细胞表达FasL量比较转染前呈明显下降,且实验组胃癌细胞在转染后比阴性对照组及空白对照组的FasL表达量均明显减少,差异存在统计学意义(P<0.05),阴性对照与空白对照组间比较无明显差异(P>0.05)。
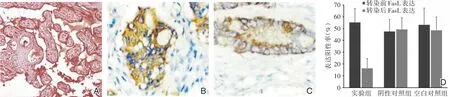
图1 人胃癌细胞Fas/FasL表达情况 A、B、C:DAB染色;D:转染前后各组胃癌细胞FasL表达情况
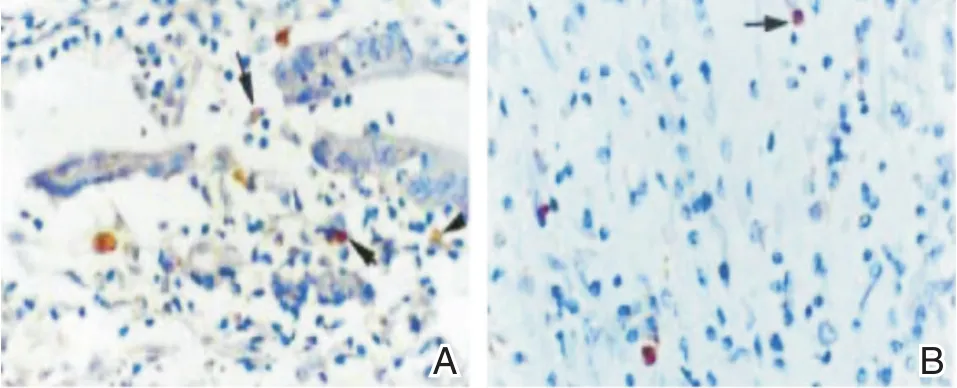
图2 FasL的宿主淋巴细胞凋亡 A:200×;B:100×
2.2 经肿瘤特异性抗原处理CTL对比
未免疫的淋巴细胞,呈球形或卵圆形,表面较光滑,有较多的颗粒和少量的微绒毛;经免疫的淋巴细胞则表现为不典型的异常形态:表面有皱褶和少量微绒毛,甚至可见到长长的“伪足”,形态上类似单核细胞;有时细胞表面呈绒毛状,有许多树突状突起,形态上类似树突状细胞(图3)。在酶联免疫检测仪上测得570 nm的OD值,显示经免疫后的淋巴细胞对不同浓度ConA的增殖能力。肿瘤抗原免疫(阳性)组与未免疫(阴性)组的增殖反应经统计比较,前者显著高于后者(P<0.05;n=10)。
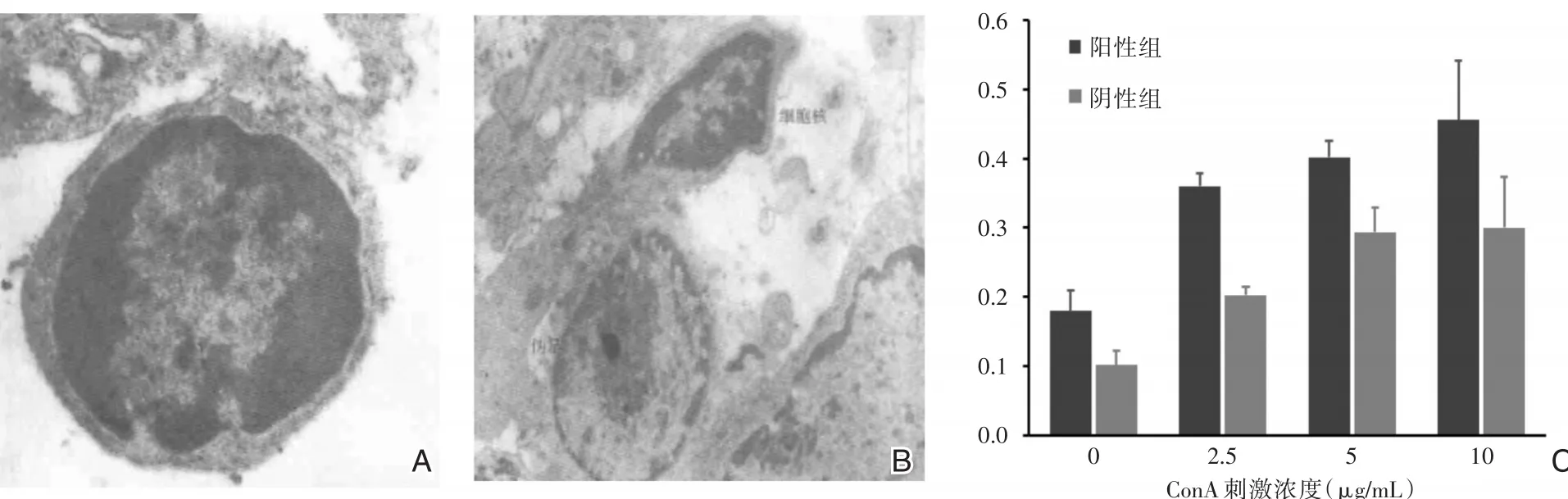
图3 电镜下观察经肿瘤免疫淋巴细胞超微结构改变 A:未免疫淋巴细胞表面少量的微绒毛;B:经免疫淋巴细胞表面可见“伪足”改变;C:肿瘤免疫后T细胞对不同浓度ConA的增殖能力
2.3 胃癌细胞与肿瘤特异性抗原处理CTL共培养结果
采用MTT法检测各组在培养3 d、5 d、7 d后的吸光度值(OD),分析淋巴细胞的生长情况,结果显示,培养5 d、7 d后实验组的培养孔计数显示肿瘤特异性CTL数量比阴性对照组及空白对照组明显增多,差异存在统计学意义(P<0.05)(见图4)。
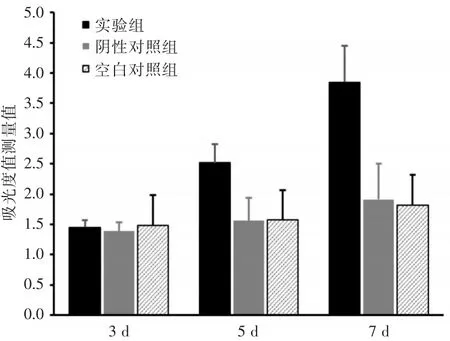
图4 各组淋巴细胞在各时间点吸光度值测量值
2.4 胃癌细胞侵袭能力及细胞凋亡率检测结果
侵袭试验亦显示RNA干扰沉默降低了胃癌细胞的侵袭能力,经肿瘤细胞抗原处理过的CTL对胃癌细胞的特异杀伤效果显著(图5)。流式细胞仪检测的各组细胞凋亡率结果显示,FasL⁃siR⁃NA的高表达能提高胃癌细胞凋亡率(图6)。
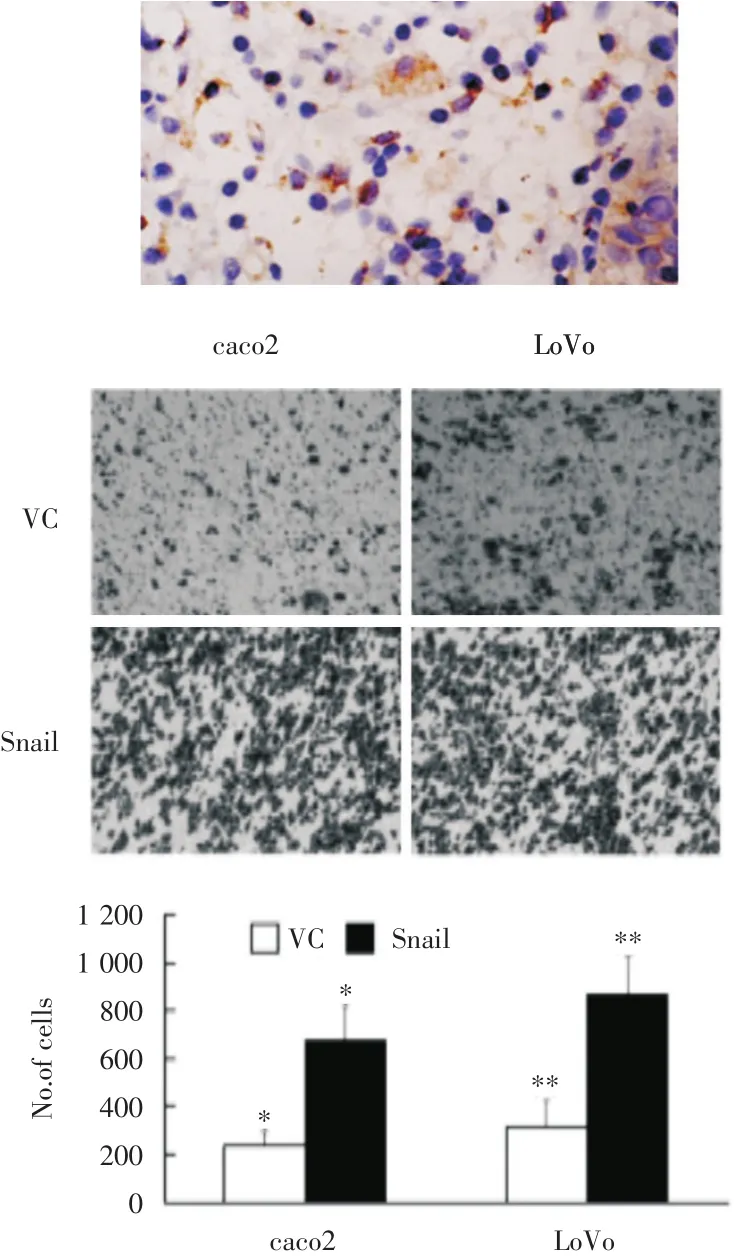
图5 CD8+CTL细胞和胃癌细胞的共培养侵袭试验显示RNA干扰沉默降低了胃癌细胞的侵袭能力 A:200×;B:00×;**/*,与VC比较,P<0.05

图6 高表达FasL⁃siRNA的胃癌细胞凋亡率升高,细胞呈双阳性(Annexin V+/PI+)
3 讨论
人体细胞增殖与凋亡异常,可能导致细胞恶性转化。细胞凋亡可通过内源性和外源性两个途径触发,Fas/FasL途径为外源性途径,即可通过Fas受体与FasL结合发生三聚化,进而使Fas胞浆段(死亡结构域,death domain)活化,使下游通路被激活。机体内多种组织和细胞均可组成或经激活诱导表达Fas,表达水平有较大变异,但以免疫系统的表达最丰富。FasL的表达较局限,主要存在于活化的T淋巴细胞、NK细胞、LAK细胞等免疫细胞的胞膜上。研究表明[6-8],通过干扰Fas/FasL通路能影响细胞凋亡,说明Fas/FasL系统在细胞凋亡过程中起着重要作用。
在肿瘤细胞中,Fas/FasL系统有调控细胞凋亡的作用,已成为肿瘤免疫治疗研究的热点。研究证实[9,10],在多种恶性肿瘤细胞中,Fas表达下降,FasL表达上调,使得淋巴细胞无法识别并激活肿瘤细胞表面的Fas,相反,恶性肿瘤细胞表达的FasL可识别并激活淋巴细胞表面的Fas启动凋亡程序。本实验亦观察到胃癌细胞高表达FasL,提示胃癌细胞可能是通过高表达FasL介导逃避机体的免疫监视。
RNAi的出现可以沉默胃癌细胞的FasL基因,下调胃癌细胞FasL的产生,或诱导Fas蛋白的高表达,消除或减弱肿瘤细胞对机体活性淋巴细胞的诱导凋亡作用,从而使机体对肿瘤的杀伤免疫潜能被激活。已有学者成功应用RNAi调控肿瘤细胞的FasL表达并促进细胞凋亡[11]。本实验我们用RNAi处理后的胃癌细胞,检测FasL⁃mRNA量较处理前下降,说明导入的FasL⁃siRNA能够抑制胃癌细胞表达FasL,在与肿瘤特异性CTL共培养后,胃癌细胞凋亡增加,证实应用RNAi能使胃癌细胞FasL表达下降,并使其不能识别激活CTL表面的 Fas配体,这与Toshiki等[12]学者研究结果一致,且侵袭试验亦显示RNA干扰沉默降低了胃癌细胞的侵袭能力。
现阶段对于siRNA的传递和导入方法仍需要进一步改善,对于多个siRNA同时导入体内或siR⁃NA与化疗药物同时导入体内产生的影响还需进一步研究。本实验只在体外验证RNAi能干扰胃癌细胞表达FasL,并使其不能逃避肿瘤特异性CTL的免疫清除,尚未在动物实验体内种植RNAi处理的胃癌细胞并跟踪其生长、浸润情况。因此,有关肿瘤细胞与免疫清除的相互作用仍需要后续进一步研究。

