利用CRISPR/Cas9技术敲除XPO1基因对胰腺癌细胞株生物学功能的影响
黄娴娴,李苑华,黄凤婷,张世能,庄燕妍
胰腺癌是最具侵袭性的癌症之一,在全球癌症 相关的死亡中排名第七。据Globocan 2018年的数据显示,胰腺癌在全球最常见的癌症排名第11位,因其早期症状隐匿,往往丧失手术机会,加之化疗效果不佳,其5年生存率仅为9%,形势仍十分严峻[1]。因此,探究新的治疗靶点和治疗策略成为亟待解决的问题。
真核生物的细胞核具有双层膜结构,核质转运是细胞内信号转导不可或缺的过程。大分子物质的跨膜转运需要核质转运受体的介导才能实现。核输出蛋白1(exportin⁃1,XPO1),又称为染色体区域稳定蛋白1(chromosome region maintenance,CRM1),是重要的核质转运蛋白之一,可识别并转运相对分子质量大于40 kDa(1 Da=0.9921 u)的RNAs及蛋白质的出核,包括多个生长调节蛋白及肿瘤抑制蛋白如P53、P21、FOXO、NF⁃kB等[2]。研究发现,XPO1 在肺癌[3]、卵巢癌[4]、血液肿瘤[5]、前列腺癌[6]、多发性骨髓瘤[7]及胰腺癌[8]等多种人类恶性肿瘤中均存在异常表达,通过调控细胞增殖、凋亡、炎症反应、血管生成等多种机制促进肿瘤演进,可作为肿瘤治疗的潜在靶点[9,10]。
CRISPR/Cas9技术利用Cas9核酸酶对靶向序列进行切割造成双链DNA断裂,以非同源末端链接(NHEJ)或同源重组(HR)方式进行修复,修复以非同源末端连接为主。这种只基于断裂末端的修复方式会引起碱基缺失、插入及突变,达到基因敲除的目的。我们前期研究发现,与正常胰腺导管上皮细胞H6C7、hTERT⁃HPNE相比,人胰腺癌细胞株 MIA PaCa⁃2、Capan⁃2、PANC⁃1、SW1990的XPO1蛋白表达量升高,以MIA⁃Paca2最为显著[11]。因此,本文利用CRISPR/Cas9技术构建XPO1敲除的MIA⁃Paca2细胞株,为后续XPO1参与胰腺癌演进的具体分子机制的研究奠定基础。
1 材料与方法
1.1 细胞株及主要试剂
细胞株:人胰腺癌细胞株MIA⁃Paca2购自中科院上海细胞库,用DMEM培养基(含10%FBS、100 U/mL青霉素、100μg/mL链霉素)于37℃、5%CO2、饱和湿度条件下培养。
主要试剂:Cas9慢病毒、线性化的GV372载体质粒、TOP10感受态菌体、质粒转染试剂和Polybrene均购自上海吉凯基因公司。DMEM培养基、胎牛血清(FBS)、嘌呤霉素、胰酶(Gibco);小鼠XPO1单克隆抗体(Santa Cruz Biotechnology);β⁃tubulin抗体及对应二抗(Cell Signaling Technology,Inc.)、牛血清白蛋白(BSA)、RIPA裂解液、蛋白BCA定量试剂盒(碧云天)PDVF膜、EMD Millipore Immobilon Western Chemiluminescent HRP Substrate(ECL超敏发光液)(Thermo Fisher Scientific Inc。);细胞培养耗材(corning Incorporated)。
1.2 XPO1基因敲除的MIA⁃Paca2胰腺癌细胞的构建
1.2.1 sgRNA⁃XPO1慢病毒质粒构建 sgRNA⁃XPO1(序列 GGATTATGTGAACAGAAAAG),XPO1单链DNA Oligo(XPO1⁃sg见表1)由上海吉凯基因公司设计及合成,把合成的XPO1单链DNA Oligo溶解于退火缓冲液中,95℃水浴15min,然后自然冷却至室温,形成带粘性末端的双链,将退火产物稀释200倍后使用。由BsmBI酶线性化载体质粒,取载体质粒1 μg,10× Buffer Tango 2 μL,DTT(20 mmol/L)1μL,BsmBI 1μL,加去离子水将体系补至20μL,经过37℃酶切3小时得到线性化载体DNA,取双链DNA 0.5μL,线性化的载体质粒2μL,10×T4 Buffer 1μL,pEG4000,1μL,T4 DNA Ligase 1μL,加去离子水补至10μL,经16℃、3 h孵育获得酶切连接产物。将连接产物转化至TOP10感受态菌体内,将其均匀地涂布在含氨苄西林(Amp)的固体培养基上,次日挑取单菌落进行PCR鉴定,得到阳性克隆后测序,得到序列正确的表达sgRNA的过表达慢病毒质粒。扩增序列正确的克隆菌液,用中小量质粒提取试剂盒(天根)提取质粒,送检测序,引物序列为XPO1⁃seq。
1.2.2 sgRNA⁃XPO1慢病毒包装 将状态良好的293T细胞接种于六孔板,细胞密度达70%时更换成无血清培养基,培养2 h,取2支1.5 mL离心管,一支加入慢病毒包装辅助载体psPAX2、pCMV⁃VSV⁃G质粒各250 ng,sgRNA⁃XPO1质粒500 ng,无血清培养基50μL,另一支加入3μL转染剂及47μL无血清培养基,静置10 min,将2支离心管液体混匀,室温孵育20 min,加入293T细胞的培养液中培养24 h,换完全培养基培养48 h后收集293T细胞上清液,离心去沉淀,上清用0.22μm滤膜过滤后即为慢病毒液。
1.2.3 sgRNA⁃XPO1慢病毒感染细胞及稳转株筛选 将生长状态良好的MIA⁃Paca2细胞种于六孔板,细胞密度为30%时加入1 mL慢病毒液及5μg/mL促感染试剂(Polybrene),培养12 h后更换为完全培养基培养。将转染后细胞接种于24孔板,细胞密度为80%时分别加入含0.2、0.4、0.6、0.8、1.0、2.0及4.0μg/mL嘌呤霉素的完全培养基,取5天内杀死所有细胞的最低浓度为最适筛选浓度(2.0μg/mL),细胞培养3 d,用2μg/mL嘌呤霉素筛选3 d获得XPO1敲除稳转株,用有限稀释法将细胞接种至96孔板,取单细胞生长的孔进行扩增,再用半数筛选浓度维持培养,扩增后送DNA测序及后续细胞功能检测。
1.3 蛋白质印迹法检测细胞XPO1蛋白表达
将细胞培养24 h后,用RIPA裂解液(碧云天)提取细胞总蛋白,5×SDS上样缓冲液变性蛋白,BCA法(碧云天)测定蛋白浓度,取30μg总蛋白上样,70 V转110V,恒压条件下进行SDS⁃PAGE电泳90 min,250 mA恒流低温条件下至PVDF膜湿转120 min,5%BSA摇床封闭1 h,一抗(XPO1,CST,1∶1000;GAPDH,CST,1∶1000)4℃孵育过夜,用TBST洗10 min×3次,用二抗(CST,1∶5000)室温孵育1 h,TBST洗10 min×3次,ECL化学显色,ImageJ软件分析蛋白条带,实验重复3次。
1.4 流式细胞分析检测细胞凋亡及周期
取生长状态良好的野生型及XPO1敲除的MIA⁃Paca2细胞株,用胰酶消化并制成(2~5)×105/mL浓度的细胞悬液,0.5 mL用于细胞凋亡检测,0.5 mL用于细胞周期检测,其他步骤严格遵照试剂盒说明书。实验独立重复3次。
1.5 CCK8法检测IC50
将野生型及XPO1敲除的MIA⁃Paca2细胞株以5×103个细胞/孔浓度接种于96孔培养板,培养24 h后加入用完全培养基稀释的不同浓度的吉西他滨(GEM,8、4、2、1、0.5、0.25、0.125、0.06、0.03 mmol/L)作用48 h后,弃培养基,更换为含10%CCK8的培养基,继续培养3 h后,于450 nm波长处测吸光度值(A450 nm),求得各组A450 nm值的平均值。用SPSS软件计算药物作用的50%抑制浓度(IC50)。实验独立重复3次。
1.6 统计分析
应用SPSS13.0统计软件进行统计分析,符合正态分布的计量资料以均数±标准差表示,两组间采用独立样本t检验,多组间比较采用单因素方差分析。P<0.05为差异有统计学意义。每种实验独立重复3次。
2 结果
2.1 sgRNA⁃XPO1慢病毒的构建
由BbsI酶切的线性化GV372载体质粒(图1),与设计好的sgRNA⁃XPO1连接,将连接产物转化到TOP10感受态菌体内,挑取单菌落进行鉴定及测序,引物序列XPO1⁃seq见表1。测序结果显示,sgRNA⁃XPO1慢病毒已成功插入红色方框所示sgRNA⁃XPO1序列(图2)。
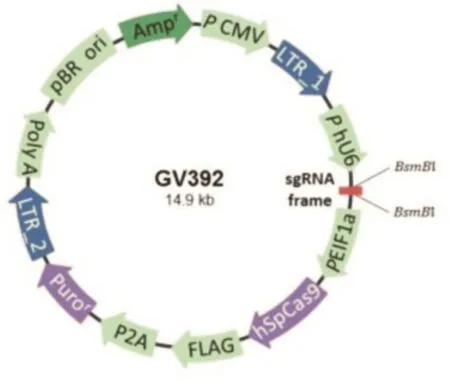
图1 GV392质粒载体图谱
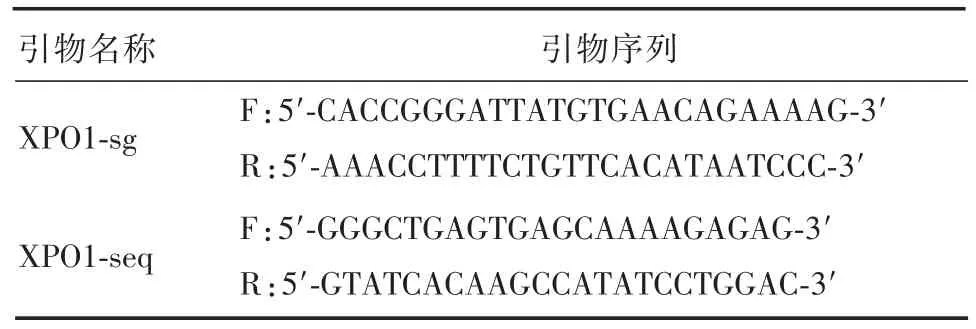
表1 引物序列
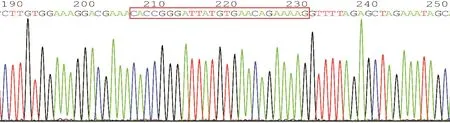
图2 sg⁃XP01质粒测序图(红色边框区域为插入的sg⁃XP01片段)
2.2 XPO1敲除MIA⁃Paca2细胞的构建
sgRNA⁃XPO1慢病毒感染MIA⁃Paca2细胞,12 h后换完全培养基培养,2 d后换含2μg/mL嘌呤霉素培养基筛选3 d。用有限稀释法获得单克隆细胞并进行扩增。蛋白质印迹法检测野生型与XPO1敲除细胞株XPO1蛋白表达情况,XPO1敲除细胞株XPO1蛋白表达(0.2003±0.0844)水平较野生型(0.4611±0.139)明显减少,差异具有统计学意义(P<0.05)(图3)。取蛋白质印迹法蛋白印迹灰度明显降低的细胞扩增培养,即单克隆细胞株KO组,提取野生型细胞及KO组细胞株基因组DNA送测序。由Cas9核酸酶产生的多个切割位点发生插入突变,KO组相比野生型发生多个碱基突变(图4)。基因及蛋白水平检测结果证实成功构建 XPO1敲除的MIA⁃Paca2细胞株。
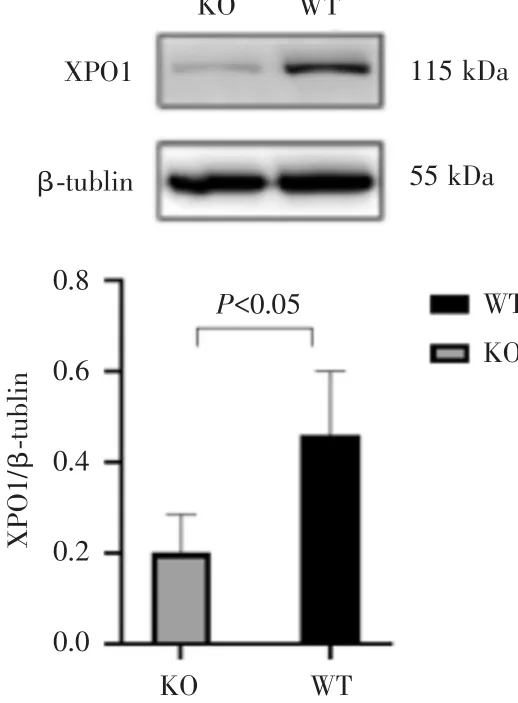
图3 XP01敲除细胞株与野生型细胞XP01蛋白表达
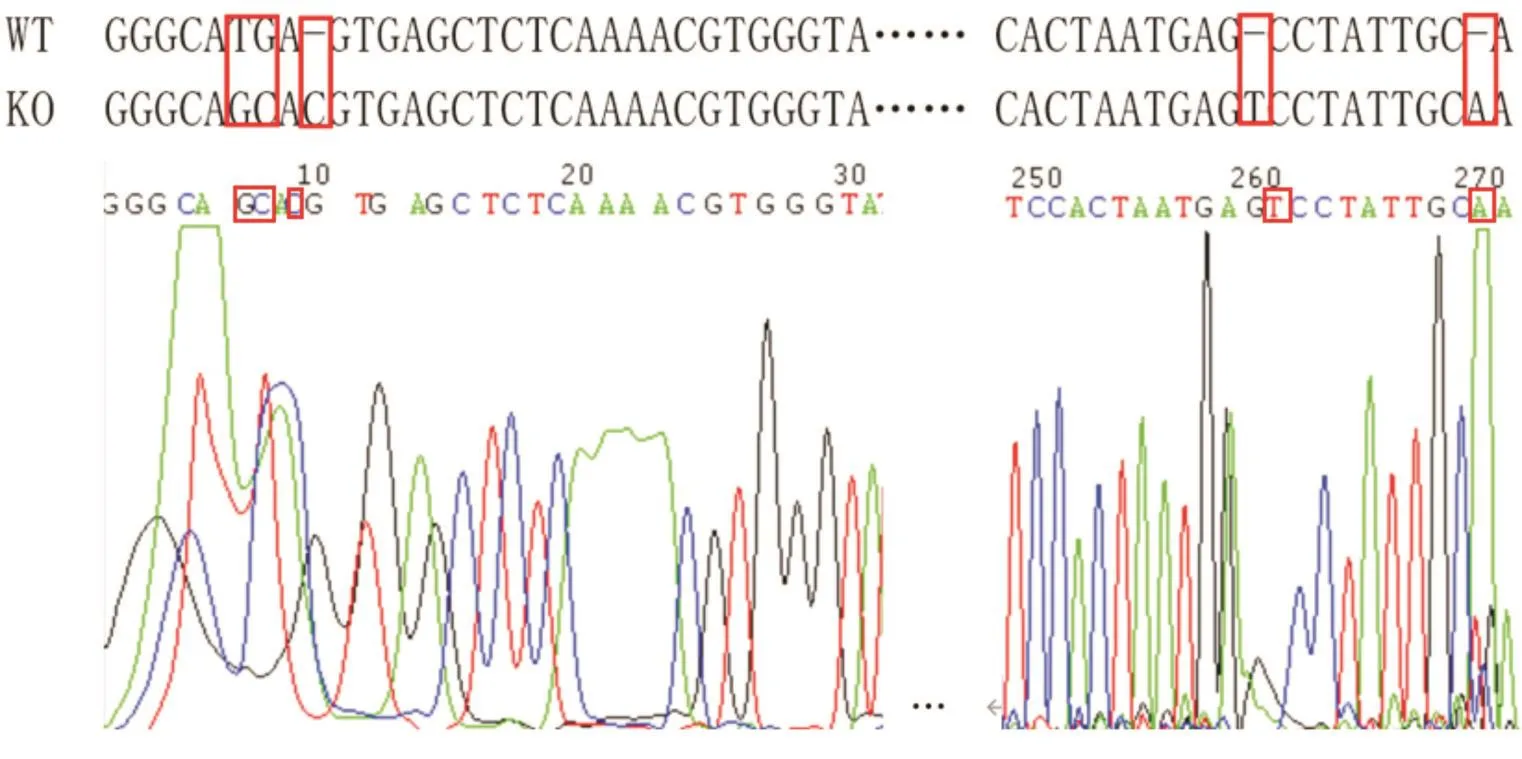
图4 XP01敲除细胞株与野生型细胞基因序列对比
2.3 XPO1敲除对细胞凋亡及周期的影响
流式细胞分析示,与野生型MIA⁃Paca2细胞相比,XPO1敲除的细胞株细胞凋亡率升高(图5A);其细胞周期G1期及S期细胞比例无明显变化,G2/M期细胞比例明显升高(图5B),提示XPO1敲除后细胞发生G2/M期阻滞,与凋亡率升高呈正相关关系。
2.4 XPO1敲除对细胞吉西他滨敏感性的影响
CCK8法检测野生型及XPO1敲除的MIA⁃Paca2细胞株对吉西他滨敏感性,结果显示,野生型及XPO1敲除的细胞株对吉西他滨IC50分别为6.45 mmol/L及2.27 mmol/L。XPO1敲除后,MIA⁃Paca2细胞对吉西他滨的敏感性提高(图6)。
3 讨论
蛋白质的错误定位将导致肿瘤、自身免疫性疾病等疾病的发生,而核质转运系统调节多种物质的亚细胞定位,XPO1作为核质转运的重要受体在多种侵袭性肿瘤中异常高表达。XPO1介导的核质转运需通过识别特异的核输出信号(nuclear export signal,NES)序列,NES是一段高度保守且富含亮氨酸的疏水氨基酸序列。XPO1与含有NES序列的货物蛋白结合并将其转运到胞质[12]。XPO1表达增高使更多的生长调节蛋白(GRPs,如c⁃myc及BCR⁃ABL)被转运到细胞质中并激活下游信号传导,导致持续的细胞增殖,而输出肿瘤抑制蛋白(TSP,如Rb,p53,p21或p27)使其功能被灭活,使肿瘤细胞逃避免疫监视[13]。XPO1靶向小分子抑制剂如雷帕霉素,核出口选择性抑制剂(SINE)如KPT⁃330、KPT⁃8602与含 NES 的蛋白竞争结合XPO1的疏水性凹槽结构(疏水活性口袋)中的活性Cys528位点,抑制出核运动[14],进而发挥抗肿瘤作用。
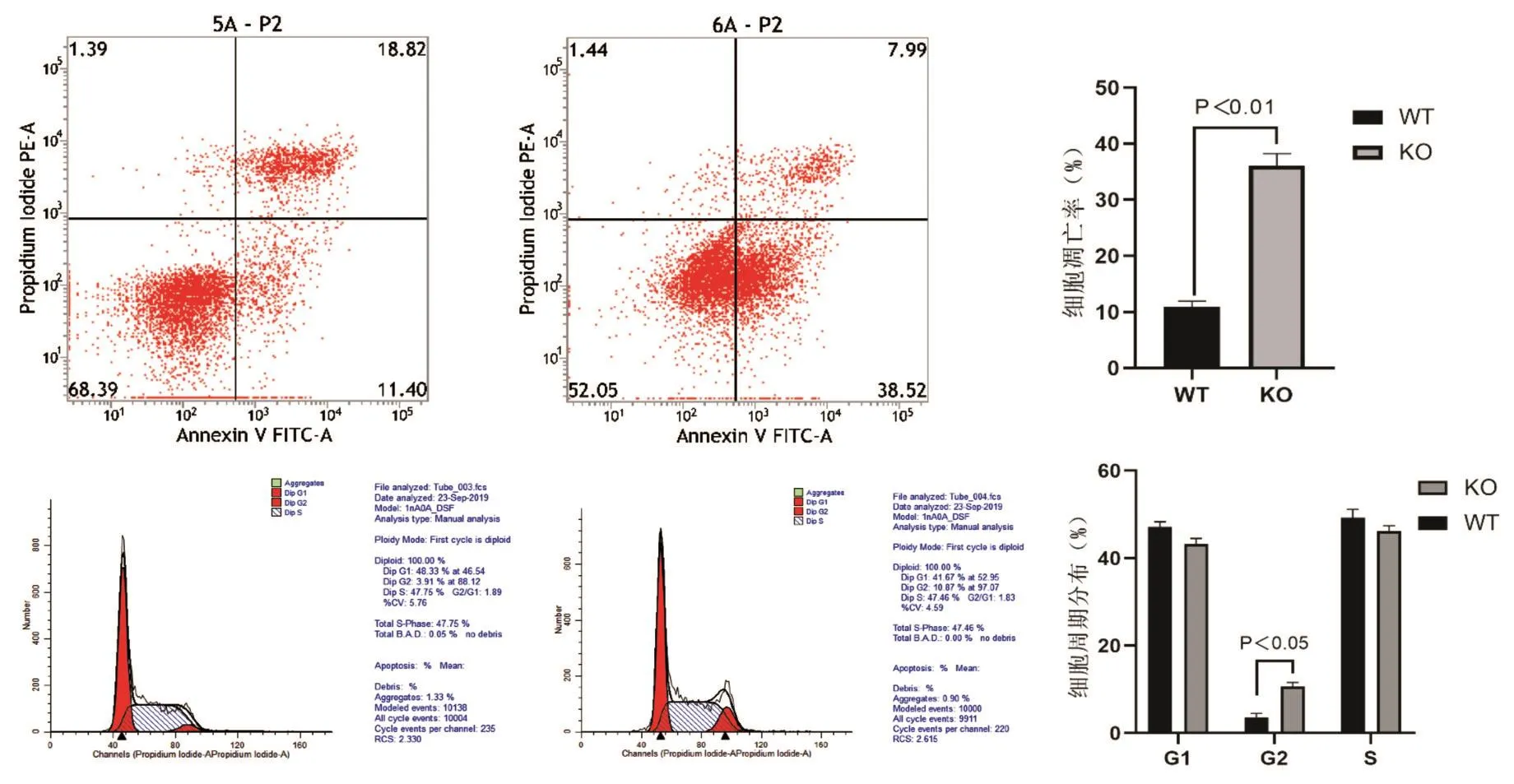
图5 XP01敲除对细胞凋亡及周期的影响
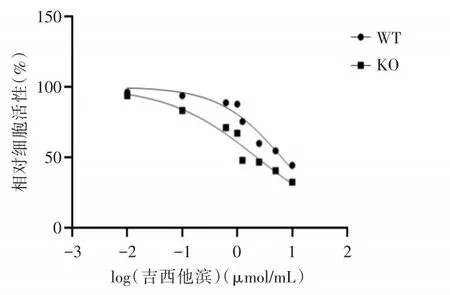
图6 XP01敲除细胞株与野生型细胞对吉西他滨IC50拟合曲线
CRISPR/Cas9技术是目前较为先进而被广泛应用的基因编辑技术,相较转录激活子样效应核酸酶(TALEN)和锌指核酸酶(ZFN)分子技术,它具有设计简单、特异性高、效率高、成本低的优点[15],在基因组编辑、基因治疗、遗传筛查等方面有广泛的应用前景。本文用蛋白质免疫印迹法检测正常胰腺导管上皮细胞及胰腺癌细胞株XPO1表达量,选取表达最高的MIA⁃Paca2细胞做XPO1基因敲除,利用CRISPR/Cas9技术成功构建XPO1敲除的MIA⁃Paca2细胞株,并探讨XPO1敲除对细胞凋亡、细胞周期及对吉西他滨敏感性的影响。结果显示,XPO1敲除后,MIA⁃Paca2细胞凋亡率升高,细胞周期发生G2/M期阻滞,对吉西他滨IC50降低,提示XPO1基因敲除增强了吉西他滨的化疗敏感性。
我们前期研究已证实XPO1抑制剂KPT⁃330可抑制胰腺癌细胞的增殖及凋亡,但XPO1影响胰腺癌发生发展的具体分子及机制尚不明确,仍有待进一步研究。我们已通过CRISPR/Cas9技术成功构建XPO1基因敲除的MIA⁃Paca2细胞株,拟进一步设计并构建质粒对Cas9核酸酶切除位点插入片段造成同义突变,进一步验证XPO1位点敲除及同义修复前后对细胞功能及药物敏感性的影响,并开展动物实验,从分子层面探讨XPO1在胰腺癌的发生发展的具体机制。

