miR-31-5p对胰岛β细胞增殖及2型糖尿病小鼠胰岛素抵抗的影响
热孜万古丽·乌斯曼 沙依拉·海米提 郭艳英
糖尿病是以高血糖为特征的代谢性疾病,在世界范围内较为常见,且近年来发生率越来越高,严重威胁着人类的健康和生活质量[1~3]。糖尿病主要发病机制有糖脂代谢异常、胰岛素抵抗、氧化应激、炎性反应等[4]。葡萄糖代谢紊乱是糖尿病症状中最突出的表现,从胰岛中产生和分泌的胰岛素对于维持葡萄糖稳态起着十分关键的作用[5]。胰岛由多个内分泌细胞组成,主要包括α、β、δ和PP细胞,胰岛内分泌细胞中胰岛β细胞占60%~80%,其能够分泌并释放胰岛素[6]。胰岛素是一种合成代谢激素,可增加细胞对血糖的吸收,从而降低血糖水平,而胰岛素抵抗和胰岛β细胞功能障碍是2型糖尿病的两个主要病理与生理学特征[7]。
微小 RNA(microRNA,miRNA)是一类长度为18~24 个核苷酸的非编码低分子单链RNA,主要通过与靶基因mRNA 3′UTR 端结合来发挥作用,可以通过翻译抑制或降解其靶mRNA来调控相关基因的表达[8,9]。大量研究表明,miRNA广泛存在于组织和器官中,并且在多种疾病的发生与发展过程中起到调控作用[10]。已发现许多转录因子和miRNA可调节胰岛功能,miRNA在调控胰岛素的分泌和抵抗、葡萄糖水平等方面均发挥重要作用[11~13]。本研究通过抑制或过表达MIN6细胞中miR-31-5p来检测其对细胞增殖以及胰岛素分泌的影响,并建立2 型糖尿病小鼠模型,通过给予尾静脉注射miR-31-5p inhibitor NC和miR-31-5p inhibitor来观察小鼠胰腺组织变化,探讨miR-31-5p在2 型糖尿病小鼠胰岛素抵抗中的作用。
材料与方法
1.主要与材料:主要试剂与材料:MIN6小鼠胰岛细胞株购自上海博谷生物科技有限公司,小鼠胰岛素ELISA检测试剂盒购自美国ALPCO公司,LipofectamineTM2000、CCK-8试剂盒、HE染色试剂盒购自上海碧云天生物公司,链脲佐菌素和TRIzol试剂购自美国Simga公司,All-in-OneTMcDNA第一链合成试剂盒、All-in-OneTMmiRNA qRT-PCR试剂盒购自美国GeneCopoeia公司,基础饲料与高脂高糖饲料购自北京科澳协力饲料有限公司,兔抗胰岛素、兔抗Cleaved Caspase-3与HRP标记的羊抗兔IgG抗体购自英国Abcam公司。80~90日龄的SPF级C57BL/6J小鼠由新疆医科大学动物实验中心提供,实验动物许可证号: SCXK(新)2018-0002。
2.细胞培养:将MIN6小鼠胰岛细胞株置于含10%胎牛血清、100μg/ml庆大霉素、100μg/ml链霉素和100U/ml青霉素的RPMI1640培养基中,放在37℃、5% CO2细胞培养箱内进行培养,待细胞覆盖率达80%~90%时,弃去培养基,用无菌的PBS清洗,加入0.25%胰蛋白酶消化细胞5min,进行传代培养。
3.细胞转染:将MIN6细胞按照每孔 2×105个接种至 6 孔细胞板上,置于37℃、5% CO2细胞培养箱中孵育过夜。实验分为Blank组(空白对照组)、miR-31-5p mimic 组(转染 miR-31-5p mimic)、miR-31-5p mimic NC 组(转染miR-31-5p mimic阴性对照)、miR-31-5p inhibitor组(转染miR-31-5p inhibitor)、miR-31-5p inhibitor NC组(转染miR-31-5p inhibitor阴性对照)。miR-31-5p mimic、miR-31-5p inhibitor及miR-31-5p mimic/ inhibitor NC片段均由广州锐博生物公司设计并合成。Blank组正常培养不进行转染。根据转染试剂LipofectamineTM2000 说明书操作,将Lipofectamine 2000分别与50nmol/L miR-31-5p mimic、100nmol/L miR-31-5p inhibitor和50nmol/L miR-31-5p mimic/inhibitor NC转染至MIN6细胞中,于37℃、5% CO2培养箱中转染4h后,更换新鲜RPMI1640培养基继续培养48h,收集各组细胞进行后续实验。
4.qRT-PCR:使用TRIzol试剂提取转染后各组MIN6细胞,采用核酸蛋白检测仪Nanodrop测定提取的RNA纯度和浓度。以All-in-OneTMcDNA第一链合成试剂盒进行反转录,用All-in-OneTMmiRNA qRT-PCR试剂盒进行扩增,以U6作为内参基因,扩增体系为:All-in-One qPCR Mix 10μl, cDNA 2μl, All-in-One miRNA qPCR Primer 2μl, Universal Adaptor PCR Primer 2μl, 50×ROX Reference Dye 0.5μl, 无酶水3.5μl。扩增条件为: 95℃预变性10min,95℃ 20s,60℃ 30s,72℃ 10s,共40个循环。使用的引物序列由上海生工生物工程有限公司合成,具体引物序列如下:miR-31-5p上游引物5′-ACACTCCAGCTGGGAGGCAAGA-3′,下游引物5′-CTCAACTGGTGTCGTGGA-3′; U6 上游引物5′-CTCGCTTCGGCAGCACATATACT-3′,下游引物5′-ACGCTTCACGAATTTGCGTGTC-3′。
5.CCK-8:将成功转染的各组MIN6细胞1×105个/孔接种至96孔板,分别在37℃、5% CO2细胞培养箱中培养 0、12、24、36、48、60、72h 后取出细胞,每孔加入10μl CCK-8溶液,孵育2h,按照 CCK-8 试剂盒说明进行操作,在酶标仪上450nm处检测各孔细胞吸光度(A)值,绘制细胞的生长曲线图。
6.酶联免疫吸附测定:将MIN6细胞以 5×104个/孔接种于24孔板内并进行转染。转染后培养48h弃去原有培养基,每孔加500μl无糖KRBH溶液,于37℃、5% CO2细胞培养箱内孵育1h。弃无糖 KRBH 溶液,换用含5mmol/L 葡萄糖的KRBH 溶液孵育1h后,4℃离心20min收集上清液,或换用20mmol/L 葡萄糖的KRBH溶液孵育1h离心收集上清液。将所收集的上清液放置于-80℃,按照胰岛素ELISA试剂盒检测胰岛素的浓度,采用酶标仪测定各孔在450nm波长处的吸光值。
7.动物造模:将60只C57BL/6J小鼠随机分为正常对照组(10只)、造模组(50只),并分别给予基础饲料和高脂高糖饲料喂养。喂养8周后,隔夜禁食12h,造模组小鼠空腹腹腔注射链脲佐菌素 30mg/kg,正常对照组小鼠空腹腹腔注射等量柠檬酸-柠檬酸钠缓冲液,每天1次,连续3次。在末次注射3天后剪尾取血,采用全自动生化分析仪测定小鼠空腹血糖值(FBG),若FBG>11.1mmol/L且连续出现饮水量和尿量增多等现象则视为建模成功。选取造模成功的小鼠40只随机分为NC组和miR-31-5p inhibitor组,每组 20只,NC组尾静脉注射miR-31-5p inhibitor NC(50mg/kg),miR-31-5p inhibitor组尾静脉注射miR-31-5p inhibitor(50mg/kg),每3天注射1次。正常组小鼠同时注射等量0.9%NaCl溶液,21天后测定各组小鼠FBG,并通过HE染色和免疫组化染色观察胰腺组织的变化。
8.HE染色:以断头法处死各组小鼠,腹部解剖采集胰腺组织进行HE染色。PBS冲洗材料,在4%多聚甲醛中固定,乙醇脱水,常规石蜡包埋,切成厚度为3μm的薄片。苏木精染色5min,流水冲洗后,伊红染色液染色3min,脱水、透明、封片,于显微镜下观察并拍照。于光学显微镜下观察小鼠胰腺组织病理学形态。
9.免疫组织化学染色:将石蜡切片脱蜡至水,采用0.01mol/L枸椽酸盐缓冲液进行抗原修复,3%过氧化氢溶液去除内源性过氧化物酶,然后分别加一抗兔抗胰岛素(1∶3000)与兔抗cleaved caspase-3(1∶200),4℃孵育过夜。次日使用 PBS 冲洗2次,每次3min,再加二抗辣根过氧化物酶标记山羊抗兔IgG(1∶5000)室温孵育15min,PBS 冲洗2次,DAB 显色。经过复染、脱水、透明、封片,在电子显微镜下观察,进行图像采集与分析。
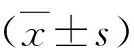
结 果
1.miR-31-5p对MIN6细胞增殖的影响:RT-PCR检测转染后各组MIN6细胞中miR-31-5p表达情况。与miR-31-5p mimic NC组比较,miR-31-5p mimic组miR-31-5p的表达量显著增加(P<0.05),而miR-31-5p inhibitor组的表达量较miR-31-5p inhibitor NC组显著降低(P<0.05,图1)。CCK-8检测结果表明,与miR-31-5p mimic NC组比较,miR-31-5p mimic组MIN6细胞在转染36h时细胞增殖能力显著下降,在本研究的时间范围内,这种趋势保持到转染后96h(P<0.05)。与miR-31-5p inhibitor NC组比较, 在转染后24h时miR-31-5p inhibitor 组MIN6细胞增殖能力显著提高,36、72和96h时也均高于miR-31-5p inhibitor NC组(P<0.05,图2)。
2.miR-31-5p对MIN6细胞胰岛素分泌的影响:分别用5mmol/L葡萄糖的KRBH溶液或20mmol/L葡萄糖的KRBH溶液刺激转染的各组MIN6细胞1h后,ELISA检测分泌胰岛素含量的实验结果显示,20mmol/L 葡萄糖的高糖刺激使胰岛素分泌增加,而与miR-31-5p inhibitor NC组比较, 20mmol/L 葡萄糖的KRBH溶液刺激下,miR-31-5p mimic组MIN6细胞胰岛素的分泌受到抑制(P<0.01),而miR-31-5p inhibitor 组胰岛素的分泌量较miR-31-5p mimic NC组增加(P<0.01)。而在基础糖浓度即5mmol/L 葡萄糖刺激下转染 miR-31-5p mimic 或 miR-31-5p inhibitor的MIN6细胞胰岛素的分泌水平没有受到影响(表1)。
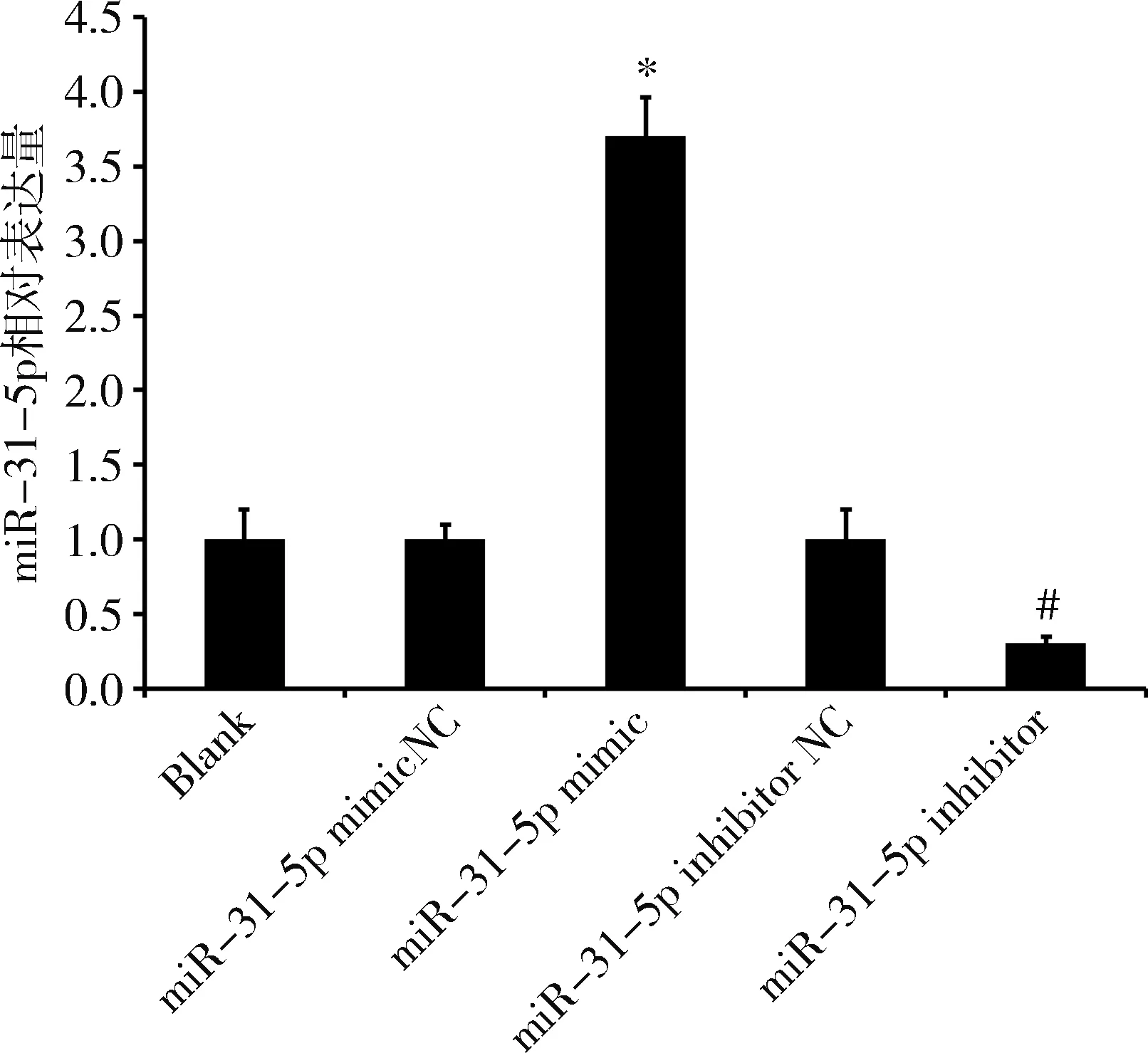
图1 RT-PCR检测各组MIN6细胞miR-31-5p表达水平与miR-31-5p mimic NC组比较,*P<0.05;与miR-31-5p inhibitor NC组比较,#P<0.05
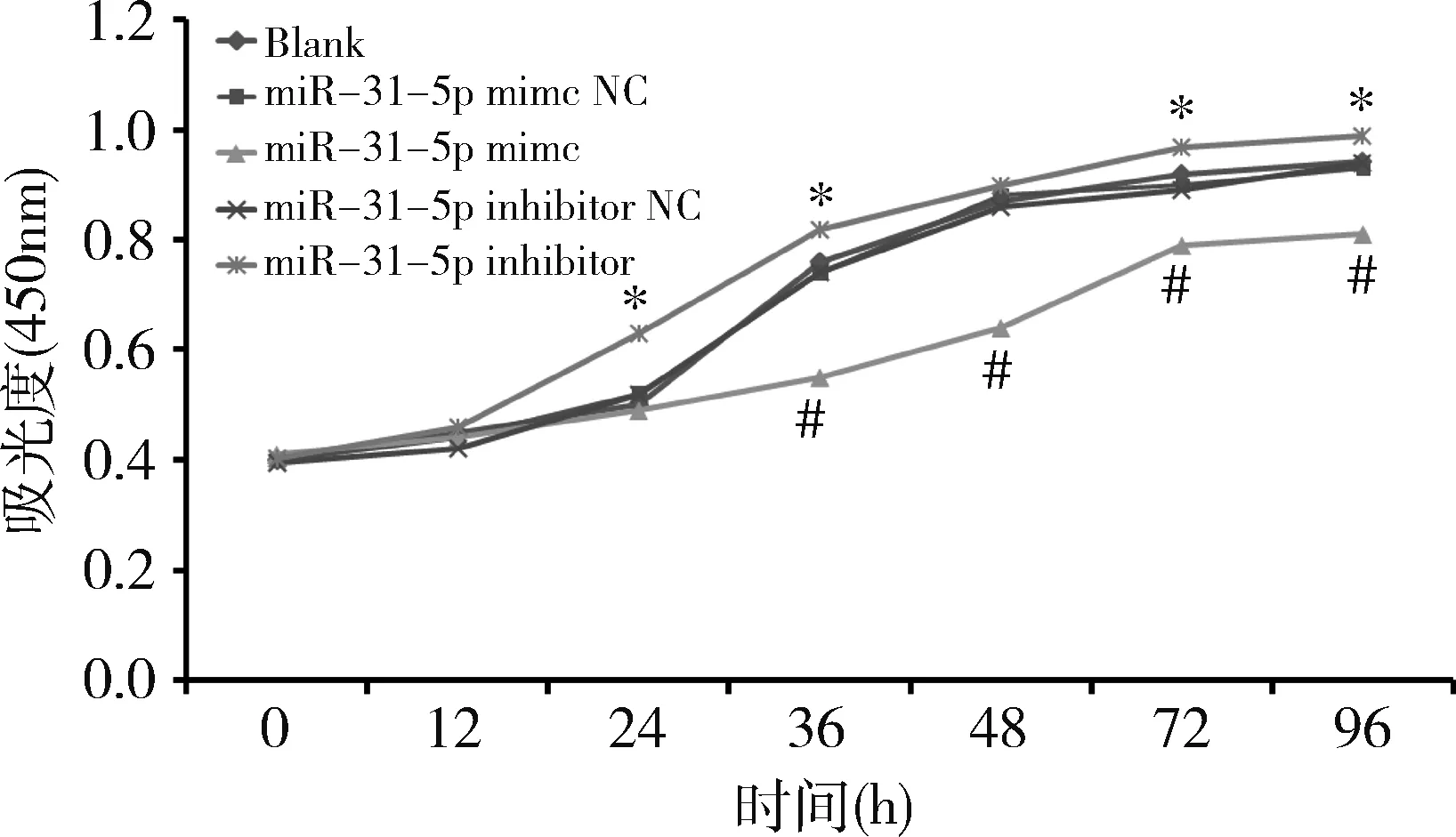
图2 CCK-8检测各组MIN6细胞增殖情况与miR-31-5p mimic NC组比较,*P<0.05;与miR-31-5p inhibitor NC组比较,#P<0.05
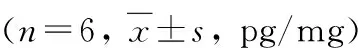
表1 ELISA检测各组MIN6细胞分泌胰岛素量
与miR-31-5p mimic NC组比较,*P<0.01;与miR-31-5p inhibitor NC组比较,#P<0.01
3.miR-31-5p对2 型糖尿病小鼠胰岛素抵抗的影响:小鼠空腹腹腔注射链脲佐菌素实验结束3天后检测FBG,与正常对照组比较,模型组小鼠的FBG明显升高(P<0.01),达到15.87±3.34mmol/L,说明造模成功。进行尾静脉注射miR-31-5p inhibitor NC与miR-31-5p inhibitor,21天后检测FBG结果显示,与miR-31-5p inhibitor NC组比较,miR-31-5p inhibitor 组FBG显著下降(P<0.01,表2)。HE 染色结果详见图3,对照组(Blank)小鼠胰腺组织中胰岛呈圆形或椭圆形,胰岛内细胞排列规则,细胞界限清晰且胞质饱满,染色均匀;miR-31-5p inhibitor NC组胰岛发生萎缩,形态不规则,胰岛细胞细胞核固缩,胞质空泡增多,染色不均匀且部分细胞内出现脂质沉积;miR-31-5p inhibitor组胰岛病理现象较miR-31-5p inhibitor NC组明显改善,胰岛形态改变较小,胰岛细胞细胞核固缩程度减小,胞质空泡较少,染色较为均匀。免疫组织化学染色检测了各组小鼠胰腺组织,片镜下阳性反应物呈棕黄色。对照组(Blank)小鼠胰腺中几乎无裂解caspase-3的表达,miR-31-5p inhibitor NC组胰腺中裂解caspase-3表达明显,而miR-31-5p inhibitor组裂解caspase-3的表达较miR-31-5p inhibitor NC组明显下降。与HE染色结果一致,胰岛素免疫组织化学分析表明对照组(Blank)小鼠胰岛为圆形,胰岛细胞(免疫反应阳性细胞)主要分布于胰岛中心部位,胞质中充满胰岛素染色颗粒,均匀地散布于整个胰岛且胞核不着色。miR-31-5p inhibitor NC组胰岛形态被破坏,染色片中胰岛素染色颗粒较少,细胞皱缩且排列分布不规则,有的胞质中胰岛素染色颗粒明显减少呈空虚状态。而miR-31-5p inhibitor组较miR-31-5p inhibitor NC组这些现象均有不同程度的改观(图4)。
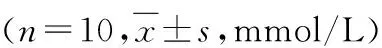
表2 抑制miR-31-5p表达对2 型糖尿病小鼠FBG的影响
与正常对照组比较,*P<0.01;与miR-31-5p inhibitor NC组比较,#P<0.01
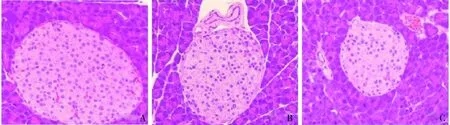
图3 各组小鼠胰腺组织病理学形态(HE,×200)A.Blank;B.miR-31-5p inhibitor NC;C.miR-31-5p inhibitor

图4 各组小鼠胰腺组织裂解caspase-3和胰岛素的阳性表达(IHC,×100)
讨 论
1型糖尿病的特征是胰岛β细胞逐渐凋亡从而导致胰岛素的缺乏[14]。另外,胰岛β细胞功能障碍在2型糖尿病的进展过程中起着关键作用,研究表明2型糖尿病的患者体内胰岛β细胞数目减少[15]。因此,促进胰岛β细胞的增殖与再生不仅是1型糖尿病的治疗策略,也成为了2型糖尿病研究与治疗的手段。
miRNA不仅在胰岛β细胞增殖、凋亡、胰岛素合成与释放等过程中发挥作用,而且可以通过调控胰岛素转录因子的表达进而维持机体糖平衡,例如miR 7、miR 26、miR 236、miR 357等已被证实参与胰腺发育、胰岛素合成与分泌等过程[16,17]。此外,也有报道指出,胰岛β细胞团与miRNA之间存在联系,miRNA在胰岛β细胞中具有细胞自主功能。例如,在怀孕或肥胖大鼠的胰岛β细胞中miR-338-3p表达降低,特异性敲除胰岛β细胞的miR-200可增加肥胖糖尿病小鼠β细胞的凋亡[18,19]。本研究通过将miR-31-5p mimic 与miR-31-5p inhibitor转染到分化期的MIN6细胞中,以鉴定miR-31-5p是否影响MIN6细胞的增殖。研究结果表明,过表达miR-31-5p抑制MIN6细胞增殖而抑制miR-31-5p则促进MIN6细胞增殖。由胰岛β细胞分泌和释放的胰岛素能够将体内血糖维持在一个正常的水平,当胰岛β 细胞功能受损,胰岛素分泌不足时会引发糖尿病[20,21]。因此,笔者探究了在20mmol/L 葡萄糖的高糖刺激下MIN6细胞的胰岛素分泌水平,通过检测发现转染miR-31-5p mimic的MIN6细胞胰岛素的分泌受到抑制,而转染miR-31-5p inhibitor细胞的胰岛素分泌量增加。由此说明,抑制MIN6细胞中miR-31-5p的表达有助于胰岛β 细胞活性增加与胰岛素分泌增加,从而起到降低血糖的作用。
2型糖尿病与肥胖密切相关。脂肪组织在葡萄糖代谢中起重要作用,能够产生大量激素和细胞因子[22]。本研究通过高脂高糖饲料喂养联合腹腔注射链脲佐菌素30mg/kg构建2 型糖尿病小鼠模型,检测到模型组小鼠的FBG达到15.87±3.34mmol/L,由此说明造模成功。接着对2型糖尿病小鼠进行尾静脉注射miR-31-5p inhibitor NC与miR-31-5p inhibitor,21天后检测发现miR-31-5p inhibitor 组FBG较miR-31-5p inhibitor NC组明显下降。同时,通过胰腺组织形态观察发现注射miR-31-5p inhibitor NC的小鼠胰腺组织发生病理损伤,裂解的caspase-3明显表达,注射miR-31-5p inhibitor的胰腺组织病理损伤明显改善,裂解的caspase-3几乎没有表达,提示抑制miR-31-5p可有效改善 2 型糖尿病大鼠胰岛素抵抗并改善胰腺病理损伤。
综上所述,本研究证明了抑制miR-31-5p 表达可以促进MIN6细胞的增殖,从而保护胰岛的功能,有效改善糖尿病小鼠的空腹血糖。miR-31-5p可能成为治疗2型糖尿病的重要的标靶,为有效治疗2型糖尿病提供了新的方法。后续研究将会深入探讨miR-31-5p的作用靶点以及具体机制,为糖尿病的预防及治疗提供可行的新思路。

