超高效液相色谱-串联质谱法同时测定尿液与血清中23种双酚类化合物
牛宇敏,王 彬,杨润晖,段鹤君,张 晶,邵 兵*
(1.北京市疾病预防控制中心 食物中毒诊断溯源技术北京市重点实验室,北京 100013;2.中国检验检疫科学研究院综合检测中心,北京 100123;3.天津科技大学 食品工程与生物技术学院,天津 300457)
双酚A(BPA)是全球产量最大的化合物之一,被广泛用于生产环氧树脂和聚碳酸酯塑料[1]。然而,长期暴露于低剂量BPA,可能会引起人类的一些代谢性疾病,如肥胖、Ⅱ型糖尿病等[2-3]。考虑到BPA的潜在风险,中国等国家相继禁止在儿童容器中添加BPA[4]。欧洲食品安全局(EFSA)在2015年对BPA进行了全面评估,将推荐的每日容许摄入量(TDI)由50 μg/kg bw/day降至4 μg/kg bw/day[4]。随着BPA的限用,一些厂家陆续推出了BPA的结构类似物用于替代BPA。双酚S(BPS)、双酚F(BPF)、双酚AF(BPAF)等已被用于工业和日常生活用品[5-7]。四氯双酚A(TCBPA)和四溴双酚A(TBBPA)等BPA的卤代衍生物被广泛用作阻燃剂[8]。此外,在饮用水氯化消毒过程中BPA和BPF会生成相应的氯化产物[9-10]。本文将BPA结构类似物及其卤代产物统称为双酚类化合物(BPs)。由于具有相似的结构,新兴BPs表现出与BPA类似或更强的毒性[11-13]。
随着BPA类似物的使用逐渐增加,目前已在环境、食品以及管网水中检测到这类物质的广泛存在[3],人体生物样本(如血清、尿液、血浆、母乳、脂肪组织、胎盘和唾液)中亦检测到1种或几种BPs[9],表明人类广泛暴露于这类物质。然而,目前的检测方法集中在BPA及其氯代衍生物和少量的BPA结构类似物[14-19]。一方面考虑到BPs的结构及理化性质存在差异,现有的检测方法不适用于目前新兴BPs的检测需求。另一方面,现有检测方法的样品用量大,方法复杂,灵敏度低[18-19],不能满足大量生物样品中BPs的监测需求。因此有必要建立一种高灵敏的检测方法,以实现生物基质中BPs的高通量检测需求。
本课题组前期研究发现,采用吡啶-3-磺酰氯对BPs进行衍生,可以极大提高方法的灵敏度和选择性[20]。因此本文选择23种目前已报道的BPs为目标物,采用液液萃取和简单通过式固相萃取等前处理方法,利用吡啶-3-磺酰氯衍生化试剂对目标物进行衍生,结合超高效液相色谱-串联质谱(UPLC-MS/MS)实现了尿液和血清中BPs的高通量和痕量检测。
1 实验部分
1.1 仪器与试剂
ACQUITY UPLC I-Class超高效液相色谱仪、Xevo TQ-XS三重四极杆质谱仪、ACQUITY UPLC BEH C18(2.1 mm× 100 mm,1.7 μm)色谱柱(美国Waters公司);Milli-Q超纯水器(美国Millipore公司);Vortex-Genin 2涡旋振荡器(美国Scientific Industries公司);N-EVAP-116氮吹仪(美国Organomation公司)。
Oasis PRiME HLB固相萃取柱(60 mg/3 mL,美国Waters公司);Agilent Bond Elut QuEChERS EMR-Lipid分散固相萃取填料(美国Agilent Technologies公司)。吡啶-3-磺酰氯(纯度> 98%,日本Tokyo Chemical Industry公司)。超纯水、甲醇和乙腈(LC-MS级,美国Sigma Aldrich公司);正己烷、丙酮、乙酸乙酯和甲基叔丁基醚(HPLC级,美国Dikma公司);甲酸、乙酸(纯度99%,美国Across公司);碳酸氢钠(ACS级)、氢氧化钠(98.5%)和醋酸钠(98%)均购于百灵威科技有限公司;β-葡糖醛酸糖苷酶/芳基硫酸酯酶混合物(从Helix pomatia提取)购于德国Roche Diagnostics公司。
标准品:BPA(>98.5%)、BPB(>98%)、BPF(>99%)、BPS(>98%)、BPAF(>98%)、TCBPA(>98%)和TBBPA(>98%)购于日本Tokyo Chemical Industry公司;BPC(≥99%)、BPE(≥98%)、BPM(≥99%)、BPP(≥99%)、BPZ(≥99%)、BPAP(≥99%)、BPBP(≥98%)、BPFL(≥99%)和DHDPE(≥99%)均购于美国Sigma Aldrich公司;MCBPA(98%)、DCBPA(98%)和TriCBPA(98%)均购于加拿大Toronto Research Chemicals公司;MCBPF、DCBPF、TriCBPF和TCBPF由本实验室合成,纯度均在98%以上[9]。同位素内标:BPA-13C12、BPB-13C12、BPF-13C12(99%,100 μg/mL,溶于乙腈),BPS-13C12(98%,100 μg/mL,溶于甲醇),BPAF-d4(98%)固体,TCBPA-13C12(99%,50 μg/mL,溶于甲醇)和TBBPA-13C12(99%,50 μg/mL,溶于甲醇)均购于美国剑桥同位素实验室。
1.2 标准溶液配制
标准溶液:分别准确称取10 mg标准品,用甲醇溶解并分别定容至10 mL,配制成质量浓度为1 000 mg/L的标准储备液,-20 ℃保存备用。将标准储备液稀释成混合标准溶液,配制成系列标准工作液,4 ℃保存。
内标工作混合液:分别准确吸取一定量的同位素内标储备液,用甲醇稀释成质量浓度为1 mg/L的内标混合溶液,-20 ℃保存备用。将内标混合溶液逐级稀释,配制成质量浓度为2 μg/L的内标工作混合液。
1.3 仪器条件
仪器条件参照前期优化结果[20]。色谱条件:色谱柱:ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm);流速:0.3 mL/min;进样体积:10.0 μL;柱温:40 ℃;进样器温度:10 ℃;流动相:A为乙腈,B为 0.1%甲酸水溶液。梯度洗脱程序为:0~0.5 min,40%A;0.5~2 min,40%~90%A;2~5 min,90%~95%A;5~6 min,95%~99%A;6~9 min,保持99%A;9~9.1 min,99%~40%A;9.1~11 min,40%A。
质谱条件:离子源:电喷雾电离源,正离子模式(ESI+);定量检测方式:多反应监测模式(MRM);毛细管电压:2.5 kV,锥孔电压:30 V;离子源温度:150 ℃;脱溶剂温度:450 ℃;脱溶剂气流速:900 L/h;碰撞气流速:0.12 mL/min。目标物的质谱参数见表1。

表1 23种双酚类化合物及内标化合物的质谱参数Table 1 MS parameters of 23 BPs and the internal standards
*quantitative ion
1.4 样品采集
为避免污染,尿液样品收集于预先洗涤的棕色玻璃样品瓶,血清样品收集于5 mL含肝素的采血管中,静置离心后取上层血清。样品在分析前置于-80 ℃储存。该研究经北京市疾病预防控制中心伦理委员会批准。所有受试者均被告知研究目的和意义,并签署同意书。
1.5 样品前处理
尿液样品:取不少于10 mL尿液样品,离心,准确吸取上清液200 μL,加入50 μL内标工作混合溶液后,再加入200 μL乙酸-乙酸钠缓冲液(pH 5.3)和10 μLβ-葡糖醛酸糖苷酶/芳基硫酸酯酶混合,37 ℃水浴酶解12 h。取出冷却至室温后,混合液用800 μL乙酸乙酯萃取2次,合并上清液,在温和的氮气下吹至近干,待衍生。
血清样品:解冻后涡旋混匀,准确吸取200 μL血清样品,加入50 μL内标工作混合溶液后,再加入200 μL乙酸-乙酸钠缓冲液(pH 5.3)和10 μLβ-葡糖醛酸糖苷酶/芳基硫酸酯酶混合,37 ℃下酶解12 h后,取出冷却至室温后,加入1.2 mL乙腈超声提取20 min,14 000 r/min离心10 min,上清液通过PRiME HLB柱(60 mg/3 mL)后,用1 mL乙腈洗脱固相萃取小柱,合并2次过柱液,在温和的氮气下吹至近干,待衍生。
衍生条件:上述混合液干燥后用200 μL碳酸氢钠缓冲液(100 mmol/L,pH 10.5)溶解残渣,再加入200 μL吡啶-3-磺酰氯(5 mg/mL,溶于丙酮),涡旋1 min,60 ℃下衍生5 min。冷却至室温后,将反应混合物用400 μL正己烷萃取2次,合并正己烷层,氮吹至近干,以100 μL乙腈-水(50∶50,体积比)复溶,待LC-MS/MS分析。

图1 不同提取溶剂对尿液中23种BPs的回收率(n=3)Fig.1 Recoveries of 23 BPs in urine samples with different extraction solvents(n=3)A:methyl tert-butyl ether;B:ethyl acetate;C.n-hexane

图2 不同净化方式下血清中23种BPs的回收率(n=3)Fig.2 Recoveries of 23 BPs in serum using different purification methods(n=3)A:Bond EMR-Lipid dSPE purification;B:PRiME HLB SPE purification;C:PRiME HLB cartridge eluted by 1 mL acetonitrile
2 结果与讨论
2.1 样品前处理条件的优化
23种BPs包括BPA、14种BPA类似物及8种卤代产物,它们结构类似,具有2个苯酚官能团,因此均可与吡啶-3-磺酰氯发生磺酰化反应。由于取代基的不同,这些BPs的极性范围分布宽(logKow1.65~6.08)[20]。因此对于尿液样品,比较了甲基叔丁基醚、乙酸乙酯和正己烷3种不同极性提取溶剂的效果(见图1)。结果显示,采用乙酸乙酯为提取溶剂时,除BPS的回收率为65.3%外,其他BPs的回收率为93.4%~110%。当采用极性更强的甲基叔丁基醚时,BPS的回收率达96.8%,但其他化合物,尤其是疏水性较强的化合物回收率明显下降。当采用正己烷为提取溶剂时,疏水性较强的化合物(如BPC、BPM、BPP、DCBPA、TriCBPA、TCBPA、TBBPA)回收率较高,但亲水性较强的化合物(如BPS、DHDPE、BPF和BPA)的回收率仅为0.09%~13.7%,远达不到检测要求,因此选择乙酸乙酯作为提取溶剂。考虑到基质对目标物离子化程度的影响,以目标物在样品基质中的响应与在纯溶剂中响应的百分比为基质效应,进一步对基质效应进行了考察。经后续衍生化反应后,所有化合物的基质效应为56.5%~128.2%,可以满足分析要求。
对于血清样品,脂肪和蛋白质是最主要的干扰物质。乙腈作为最常用的提取溶剂,可有效去除蛋白质。实验发现,血清样品经乙腈去除蛋白后,目标物仍有很强的基质效应(3.30%~55.8%),需进一步净化去除多余脂肪。比较了两种去除脂肪的商品化材料PRiME HLB固相萃取柱和Bond EMR-Lipid分散固相萃取填料的净化效果。具体操作分别为:乙腈提取液直接通过PRiME HLB固相萃取柱,流出液经氮气吹干后,按照本文衍生方法进行衍生;乙腈提取液中加入200 mg Bond EMR-Lipid填料(预先加入5 mL水活化),涡旋混匀,离心后上清液用200 mg Bond EMR-Lipid反萃包进行反萃取,上清液经氮气吹干后,按照本文衍生方法进行衍生。由图2可知,采用Bond EMR-Lipid分散固相萃取时,方法的回收率为78.5%~121%。采用PRiME HLB固相萃取柱净化时,回收率为51.0%~112%,其中疏水性较强的化合物(如BPM、BPP、BPBP、BPFL、TCBPA和TBBPA)回收率较低,仅有51.0%~88.9%,推测是由于这些化合物在固相萃取柱的保留较强所致。尝试采用PRiME HLB固相萃取柱净化后再用1 mL乙腈进一步洗脱,23种化合物的回收率均提高到90%以上。采用Bond EMR-Lipid分散固相萃取柱和经改善的PRiME HLB固相萃取柱净化时,两种方法的回收率无明显差异。基质效应评价结果显示,采用经改善的PRiME HLB固相萃取柱净化后,除DHDPE外,其余BPs的基质效应均在84.7%~110.8%之间,明显优于Bond EMR-Lipid分散固相萃取柱(63.9%~106.0%)。此外,PRiME HLB固相萃取柱更易操作,因此最终选择PRiME HLB固相萃取柱对血清样品进行净化,并使用1 mL乙腈进一步洗脱。图3为尿液加标样品中23种BPs的MRM谱图。












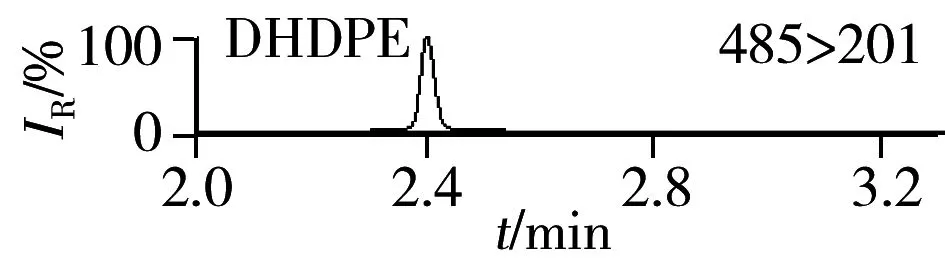








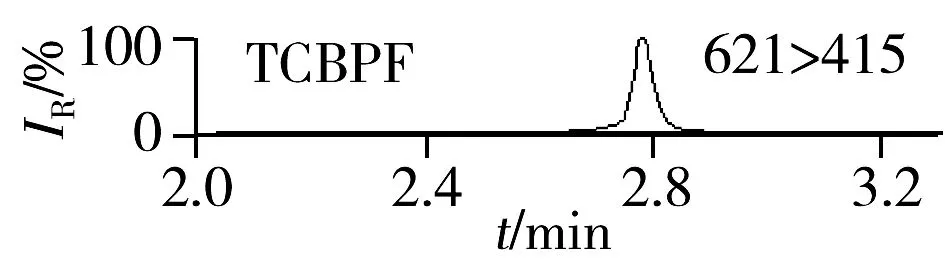
图3 尿液加标样品(0.5 μg/L)中23种BPs的MRM谱图Fig.3 MRM chromatograms of 23 BPs in urine sample spiked with 0.5 μg/L
2.2 方法确证
2.2.1 灵敏度以检出限(LOD)和定量下限(LOQ)表示方法灵敏度,在实际样品中添加标准品,以定量离子信噪比(S/N)为3和10的质量浓度分别确定方法的LOD和LOQ。结果显示,方法的LOD为0.002~0.030 μg/L,LOQ为0.005~0.100 μg/L(表2)。
2.2.2 线性范围对于有同位素内标的化合物(BPA、BPB、BPF、BPS、BPAF、TCBPA和TBBPA),采用对应的同位素内标进行定量;对于无同位素内标的化合物,采用化学结构、回收率和基质效应均相近的化合物的同位素内标进行定量,如BPC以BPB-13C12作为内标,BPE、DHDPE、MCBPF、DCBPF、TriCBPF和TCBPF以BPF-13C12作为内标,MCBPA和DCBPA以BPA-13C12作为内标,TriCBPA以TCBPA-13C12作为内标;对于化学结构差异相对较大的化合物(如BPM/BPP、BPZ、BPAP、BPBP和BPFL),由于其回收率和基质效应与BPA相似,以BPA-13C12作为内标。除了血清中DHDPE采用基质匹配曲线外标法进行定量,尿液和血清中其余化合物均采用内标法进行定量。结果表明,23种待测物在0.005~100 μg/L范围内线性良好,相关系数(r)均大于0.99。
2.2.3 回收率及相对标准偏差选择空白尿液和血清样品,分别在LOQ、2LOQ和10LOQ 3个水平进行加标回收实验,每个水平6个平行,相对标准偏差(RSD)作为日内精密度。选择2LOQ加标水平进行5 d日间精密度测定,回收率和RSD如表2所示。对于尿液样品,方法的回收率为82.9%~122%,日内RSD为0.60%~12%,日间RSD为0.90%~11%;对于血清样品,方法的回收率为76.6%~118%,日内RSD为0.60%~14%,日间RSD为1.4%~14%。

表2 23种BPs的检出限、定量下限、回收率及相对标准偏差Table 2 LODs,LOQs,recoveries and RSDs of 23 BPs
*the method cannot distinguish BPM and BPP(本方法无法区分BPM和BPP)
2.3 实际样品测定
采用本方法对北京市20名中小学生尿液以及20名孕妇血清样品中的23种BPs进行检测。在尿液样品中检出BPA、BPB、BPE、BPF、BPS和MCBPA,其中BPA、BPF和BPS的检出率均为100%,质量浓度分别为0.450~7.199 μg/L、 0.046~1.483 μg/L和0.176~1.836 μg/L,平均值分别为2.115、0.268、0.708 μg/L,BPA是最主要的BPs。在血清样品中,BPA的检出率最高(为70%),质量浓度为0.050~0.399 μg/L;此外还检出BPF、BPAF和TBBPA,检出率均为10%,质量浓度分别为0.010~0.015 μg/L、0.030~0.060 μg/L和0.193~0.198 μg/L。血清样品中未检出BPS,可能是由于BPS的极性较强,更易经尿液排出体外。
3 结 论
本研究分别建立了尿液和血清中23种BPs的高通量检测方法。尿液样品经乙酸乙酯提取,血清样品经乙腈提取、PRiME HLB固相萃取柱净化后,均经吡啶-3-磺酰氯衍生后用UPLC-MS/MS测定。本方法样品用量少、灵敏度高,可满足尿液和血清中痕量BPs的检测要求。

