PVC塑料浸出液对3种海洋微藻光合作用及生长的影响
王帅,王玥,梁英,#,郑立,3,*,孙承君,鞠鹏
1. 中国海洋大学,海水养殖教育部重点实验室,青岛 266003 2. 自然资源部第一海洋研究所,海洋生态环境科学与技术重点实验室,青岛 266061 3. 青岛海洋科学与技术国家实验室,海洋国家实验室海洋生态与环境科学功能实验室,青岛 266071
塑料因其优良的理化特性,在生产和生活中被广泛应用[1-2]。每年全球塑料消费量已超过3亿t,其中约有5%~10%的塑料会进入海洋[3-5]。目前,从赤道到极地的海水[3,6]、沉积物[7-8]以及生物链各层级生物[9]中均检测到了塑料的存在,可见塑料已成为全球性的环境问题。有关微塑料的生态毒理学效应研究主要聚焦于鲸鱼[10]、硬骨鱼类[11-13]、棘皮动物[2,5]、软体动物[14-15]、环节动物[16-17]和浮游动物[18-19]等海洋动物,限制其运动和摄食等物理损伤是目前微塑料产生危害的主要原因。然而,塑料对海洋生物产生物理损伤的同时,还会对海洋生物产生化学毒性效应[20]。塑料中的有毒添加剂,如增塑剂、阻燃剂和抗菌剂等,会被释放到海洋中,所带来的影响可能比微塑料从周围环境中吸附的持久性有机污染物的毒害作用更大[21-23]。
微藻作为海洋中最主要的初级生产力,是维持海洋生态系统平衡不可或缺的一部分,与海洋中的塑料,特别是微塑料,具有巨大的相互作用潜力[24]。且微藻生长周期短、易培养、对有毒物质敏感并且无摄食过程,是生态毒理学研究中常用的测试生物[25]。已有研究报道了微塑料对微藻的毒性效应,部分研究认为,微塑料的毒性较小,不会对海洋微藻构成危害[25-27],然而也有学者认为,它能造成微藻细胞光合系统的损伤[24,28-29]。目前,关于微塑料对海洋微藻毒性效应的报道较少,且对其毒性效应强弱等问题还存在一定的争议,研究多侧重于探讨物理作用为主的毒性,然而对其所含有的化学添加剂的毒性效应仍需要进一步的探索。
聚氯乙烯(polyvinyl chloride, PVC)作为世界第二大通用塑料,已经成为人们高度关注的海洋塑料污染物。在PVC生产过程中会添加不同种类的增塑剂,从而改善塑料的塑性和功能,特别是邻苯二甲酸酯类增塑剂,作为典型的环境内分泌干扰物会对水生生态系统造成严重危害。截至目前,国内外研究主要侧重于聚苯乙烯(polystyrene, PS)、PVC和聚乙烯(polyethylene, PE)等塑料微粒的物理作用对微藻的影响[25-26],PVC本身的化学毒性对微藻带来的影响暂未见相关研究。本文选取3种不同门类的海洋微藻球包括等鞭金藻(Isochrysisgalbana)、中肋骨条藻(Skeletonemacostatum)和小球藻(Chlorellasp.)作为实验对象,开展PVC浸出液对这3种微藻叶绿素荧光特性和细胞密度毒性效应的研究,并计算出叶绿素荧光参数和细胞密度的EC50,探究不同门类的微藻对PVC浸出液的敏感性,以期为塑料对海洋微藻的化学毒性研究提供参考依据。
1 材料与方法(Materials and methods)
1.1 PVC塑料浸出液的制备
实验所用软PVC(增塑剂>30%)和硬PVC(增塑剂<10%)均购于上海阳励机电科技有限公司,将2种PVC剪成2~5 mm碎片后浸入灭菌海水,海水中塑料质量分别为50、100和200 g·L-1,在恒温(37 ℃)下浸泡14 d,浸泡过程中不断搅动,过滤后获得PVC浸出液(浓度用海水中塑料的质量表示)。
1.2 PVC塑料浸出液中16种邻苯二甲酸酯类的测定
采用GC7890A-MS5975C型GC-MS联用仪(美国Agilent公司)参照顾浩琦等[30]GC-MS方法检测软PVC和硬PVC浸出液(200 g·L-1)中的邻苯二甲酸酯类增塑剂。表1列出了16种邻苯二甲酸酯类增塑剂,包括含有除邻苯二甲酸二苯酯外的15种成分的混标(美国AccuStandard公司),以及邻苯二甲酸二苯酯标准品(德国Dr. Ehrenstorfer公司)。
1.3 藻种及培养方法
实验所用藻种为球等鞭金藻(Isochrysisgalbana)MACC/H59、中肋骨条藻(Skeletonemacostatum)MACC/B129和小球藻(Chlorellasp.)MACC/C95,均取自中国海洋大学微藻种质库。
实验在250 mL的三角烧瓶中进行,所用培养基为f/2培养基[31]。利用不同浓度的软PVC和硬PVC浸出液替代海水,分别对以上3种微藻进行胁迫实验,每个浓度设3个平行,以不添加PVC的空白样作为对照组。将处于指数生长期的球等鞭金藻、中肋骨条藻和小球藻分别以3.00×105、1.50×105和1.30×105个·mL-1的接种密度接入上述不同浓度和材质的PVC浸出液中进行胁迫处理。藻种培养条件为温度(20±1) ℃,连续光照(光照强度3 000 lx),盐度31‰,每天摇动培养瓶3~5次,培养时间为4 d。胁迫24、48、72和96 h后取样,测定叶绿素荧光各项参数和细胞密度。
1.4 叶绿素荧光参数和细胞密度的测定
叶绿素荧光各项参数,包括PSⅡ最大量子产量(Fv/Fm)、PSⅡ实际量子产量(Yield)、光化学淬灭(qP)和PSⅡ最大相对电子传递速率(rETRmax)测定参照Liang等[32]的方法,球等鞭金藻和小球藻细胞密度测定采用血球计数板法,中肋骨条藻细胞密度测定采用吸光度法。
表1 16种邻苯二甲酸酯类(PAEs)增塑剂标准品名称、缩写及纯度
Table 1 Chemical names, abbreviations and purities of standard materials of the sixteen phthalate esters (PAEs)

序号Number名称Compound缩写Abbreviation纯度/%Purity/%1邻苯二甲酸二甲酯Dimethyl phthalateDMP≥98.002邻苯二甲酸二乙酯Diethyl phthalateDEP≥99.903邻苯二甲酸二异丁酯Diisobutyl phthalateDIBP100.004邻苯二甲酸二丁酯Dibutyl phthalateDBP≥98.405邻苯二甲酸二(2-甲氧基)乙酯Bis (2-methoxy) ethyl phthalateBMEP≥97.706邻苯二甲酸二-(4-甲基-2-戊基)酯Bis (4-methyl-2-amyl) phthalateBMPP100.007邻苯二甲酸二(2-乙氧基)乙酯Bis (2-ethoxy) ethyl phthalateBEEP100.008邻苯二甲酸二戊酯Dipentyl phthalateDPP≥98.509邻苯二甲酸二己酯Dihexyl phthalateDHXP≥99.0010邻苯二甲酸丁基苄基酯Butyl benzyl phthalateBBP≥98.4011邻苯二甲酸二(2-丁氧基)乙酯Di-(2-butoxy) ethyl phthalateDBEP≥99.0012邻苯二甲酸二环己酯Dicyclohexyl phthalateDCHP100.0013邻苯二甲酸二(2-乙基)己酯Di (2-ethyl) hexyl phthalateDEHP≥99.6014邻苯二甲酸二苯酯Diphenyl phthalate/≥98.0015邻苯二甲酸二辛酯Dioctyl phthalateDNOP≥99.1016邻苯二甲酸二壬酯Dinonyl phthalateDNP≥97.00
1.5 EC50的测定
采用闫学平等[33]的方法计算叶绿素荧光参数Fv/Fm的EC50,采用赵玉艳和蔡磊明[34]的生长速率法计算细胞密度的EC50。
1.6 数据处理
采用Origin(v. 8.5)进行绘图,利用SPSS(v. 19.0)软件,运用双因素方差分析和多重比较方法(P<0.05表示差异显著)对检测结果进行统计分析。
2 结果(Results)
2.1 不同种类PVC浸出液对球等鞭金藻光合作用参数和细胞密度的影响
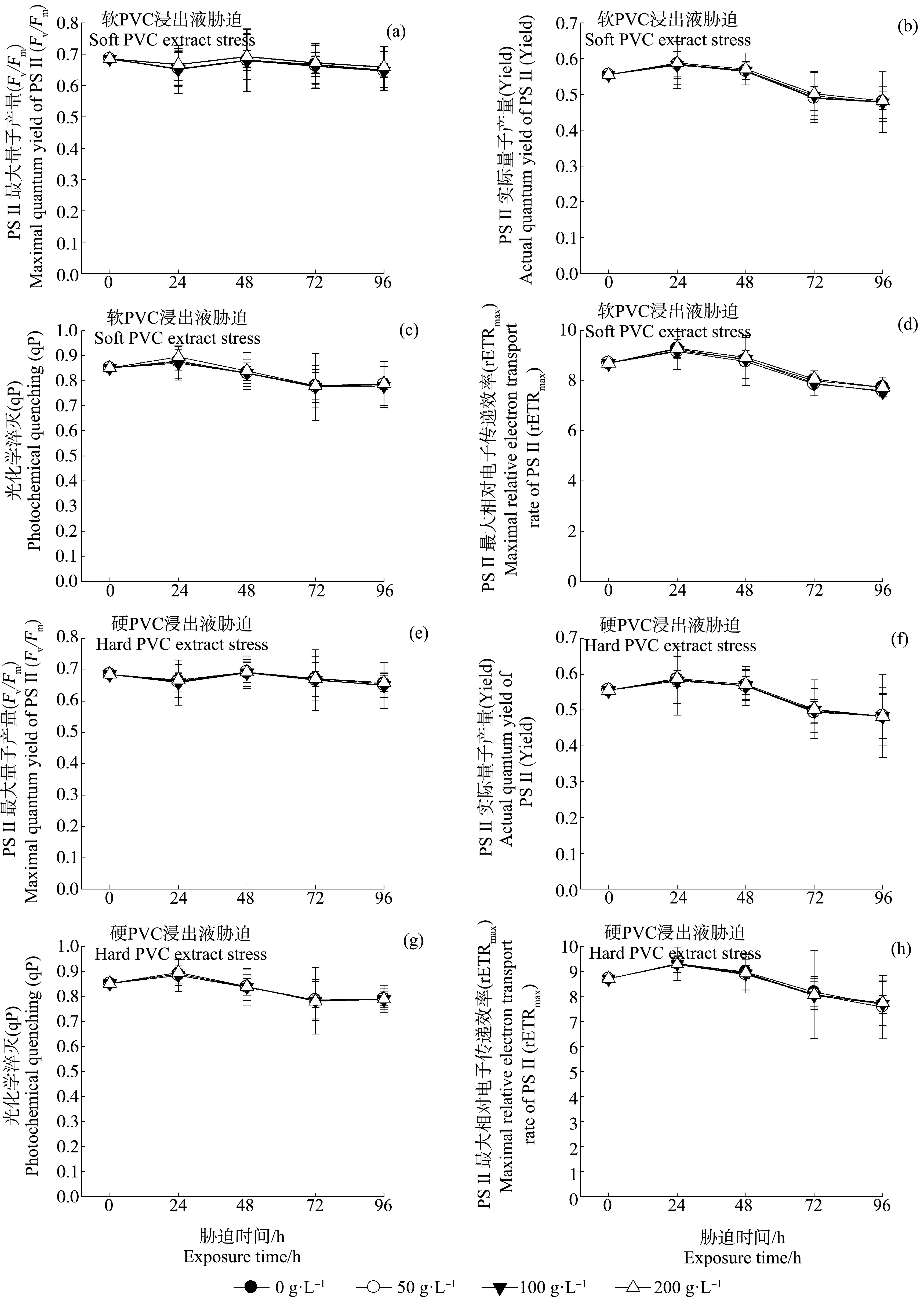
图1((a)~(d))和图2(a)给出了球等鞭金藻光合作用相关参数和细胞密度在不同浓度软PVC浸出液及胁迫时间作用下的变化趋势。双因素方差分析结果表明,软PVC浸出液浓度、胁迫时间及二者交互作用(浓度×时间)对球等鞭金藻的4项光合作用参数和细胞密度均有显著影响(P<0.05),其中软PVC浸出液浓度对Fv/Fm、Yield和rETRmax影响最显著,胁迫时间对细胞密度影响最显著(表2)。多重比较结果显示,随着软PVC浸出液浓度的上升,球等鞭金藻的4项光合作用参数和细胞密度均呈下降趋势(表2)。高浓度软PVC浸出液(100~200 g·L-1)处理组的Fv/Fm、Yield、qP、rETRmax和细胞密度显著低于对照及50 g·L-1处理组,4项光合作用参数和细胞密度均在200 g·L-1处理组达到最小值。100 g·L-1和200 g·L-1处理组的球等鞭金藻光合作用参数(除Yield外)均在0~48 h迅速下降,之后缓慢上升,但仍明显低于对照及50 g·L-1处理组相关参数。96 h时,200 g·L-1处理组的细胞密度最低,其次是100 g·L-1处理组,分别为对照组的3.20%和3.90%。
图1((e)~(h))和图2(b)给出了球等鞭金藻光合作用相关参数和细胞密度在不同浓度硬PVC浸出液及胁迫时间作用下的变化趋势。双因素方差分析结果表明,硬PVC浸出液浓度和胁迫时间对球等鞭金藻的4项光合作用参数和细胞密度均有显著影响(P<0.05),二者交互作用(浓度×时间)对4项光合作用参数有显著影响(P<0.05),其中,硬PVC浸出液浓度对Yield和rETRmax的影响最显著,胁迫时间对细胞密度影响最显著(表2)。多重比较结果显示,硬PVC浸出液胁迫下球等鞭金藻的Fv/Fm显著高于对照组,但3个处理组间无显著差异;Yield、qP和rETRmax均在高浓度处理组(100~200 g·L-1)中达到最大值,且显著高于对照组及50 g·L-1处理组;而高浓度处理组(100~200 g·L-1)的细胞密度显著低于对照及50 g·L-1处理组(表2)。72 h时,细胞密度在100 g·L-1处理组中达到最小值,为对照组的67.90%。
2.2 不同种类PVC浸出液对中肋骨条藻光合作用参数和细胞密度的影响
图3((a)~(d))和图2(c)给出了中肋骨条藻光合作用相关参数和细胞密度在不同浓度软PVC浸出液及胁迫时间作用下的变化趋势。双因素方差分析结果表明,软PVC浸出液浓度、胁迫时间及二者交互作用(浓度×时间)对中肋骨条藻的Fv/Fm、Yield、qP、rETRmax和细胞密度均有显著影响(P<0.05),其中,软PVC浸出液浓度对上述4项光合作用参数和细胞密度的影响最显著,胁迫时间对Fv/Fm、qP、rETRmax和细胞密度的影响最显著(表3)。多重比较结果显示,Fv/Fm、Yield、qP、rETRmax和细胞密度随软PVC浸出液浓度上升而下降,上述参数均在200 g·L-1处理组达到最小值,且显著低于各处理组(表3)。随着胁迫时间延长,Fv/Fm、Yield、qP和rETRmax均呈先下降后上升的趋势。96 h时,200 g·L-1处理组的细胞密度达到最小值,占对照组的11.90%。
图3((e)~(h))和图2(d)给出了中肋骨条藻光合作用相关参数和细胞密度在不同浓度硬PVC浸出液及胁迫时间作用下的变化趋势。双因素方差分析结果表明,硬PVC浸出液浓度、胁迫时间及二者交互作用(浓度×时间)对中肋骨条藻的Fv/Fm、Yield、qP和rETRmax和细胞密度均有显著影响(P<0.05),其中,硬PVC浸出液浓度对rETRmax的影响最显著,胁迫时间对细胞密度的影响最显著(表3)。多重比较结果显示,上述4项光合作用参数和细胞密度均在高浓度处理组(100~200 g·L-1)达到最小值,且显著低于对照组(表3)。Fv/Fm、qP和rETRmax随胁迫时间延长呈缓慢下降趋势,Yield随胁迫时间延长先上升后下降。实验后期(72 h),200 g·L-1处理组的细胞密度达到最小值,为对照组的82.50%。
2.3 不同种类PVC浸出液对小球藻光合作用参数和细胞密度的影响
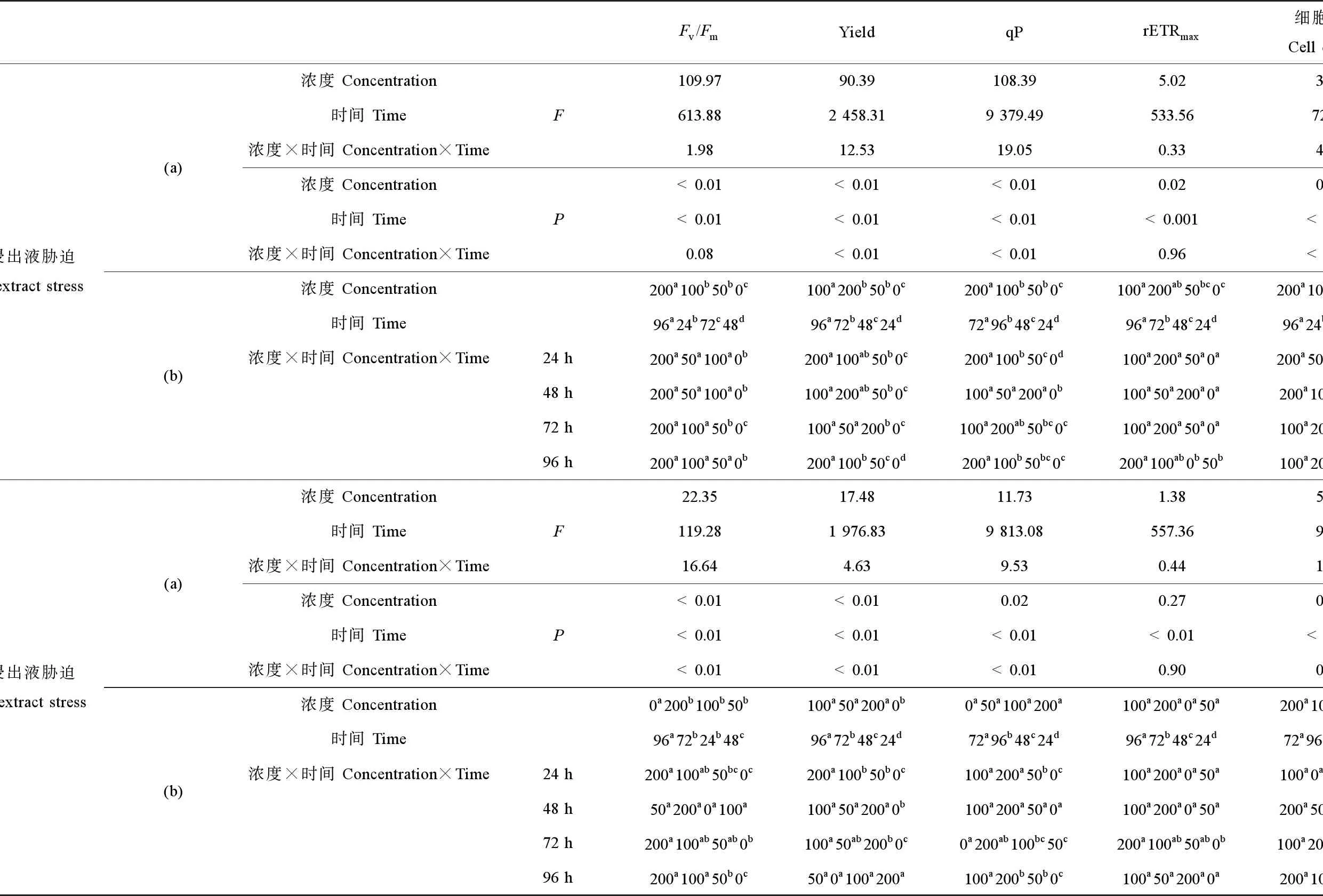
图4((a)~(d))和图2(e)给出了小球藻光合作用相关参数和细胞密度在不同浓度软PVC浸出液及胁迫时间作用下的变化趋势。双因素方差分析结果表明,软PVC浸出液浓度对小球藻的Fv/Fm、Yield和qP有影响(P<0.05),胁迫时间对小球藻的4项光合作用参数和细胞密度均有影响(P<0.05),二者交互作用(浓度×时间)仅对该藻株的Yield和qP有影响(P<0.05),其中胁迫时间对Yield和qP的影响最显著(表4)。多重比较结果显示,高浓度处理组(100~200 g·L-1)的Fv/Fm、Yield、qP和rETRmax值低于对照组;200 g·L-1处理组的细胞密度低于对照组,其他处理组与对照组无显著差异(表4)。随着胁迫时间延长,上述4项光合作用参数总体呈现先上升后下降的趋势。在96 h时,100 g·L-1处理组的细胞密度达到最小值,是对照组的92.50%。
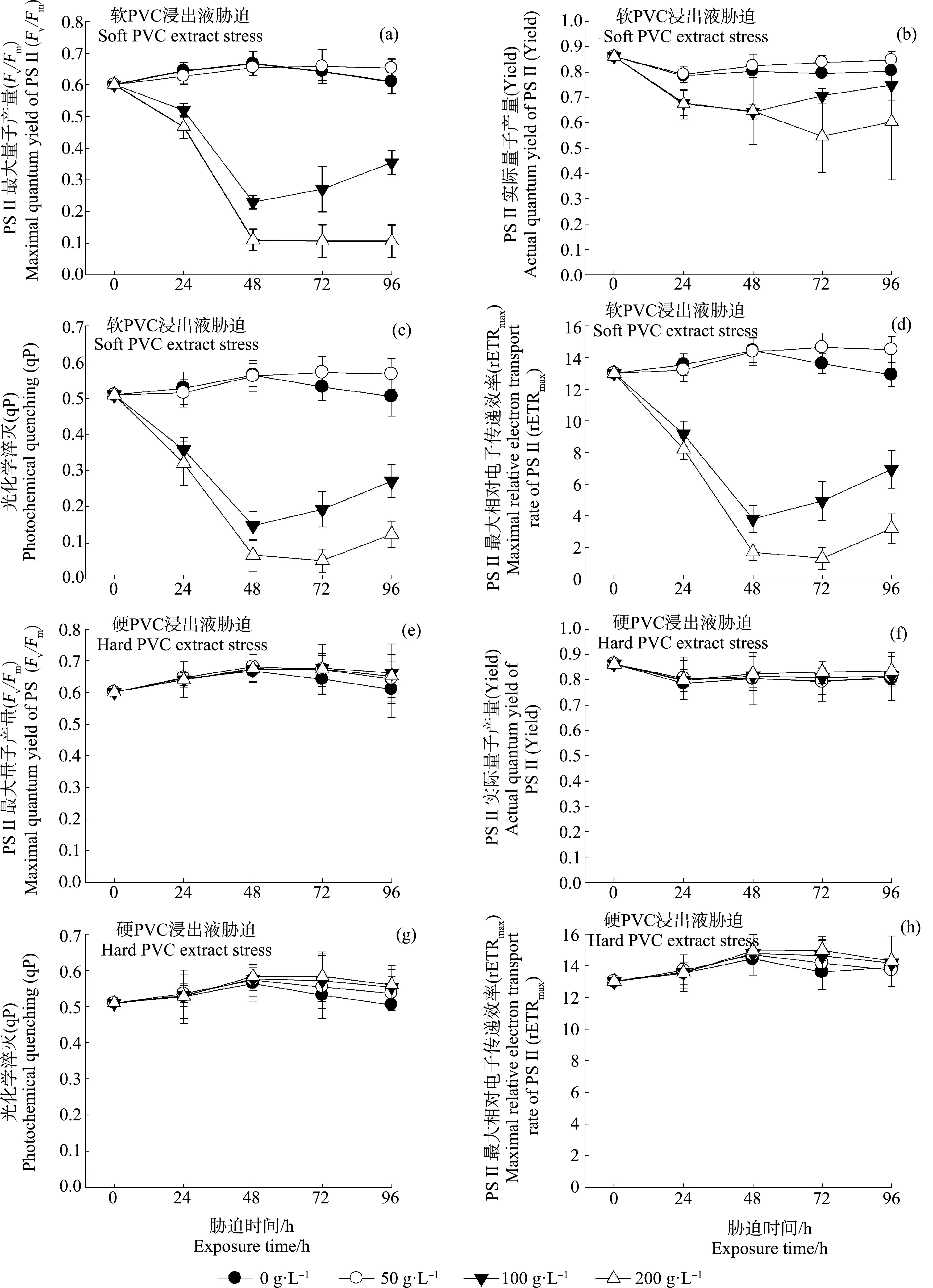
图1 软聚氯乙烯(PVC)和硬PVC浸出液胁迫对球等鞭金藻光合作用参数(Fv/Fm、Yield、qP和rETRmax)的影响注:Fv/Fm、Yield、qP和rETRmax分别表示PSⅡ最大量子产量、PSⅡ实际量子产量、光化学淬灭和PSⅡ最大相对电子传递速率。Fig. 1 Effects of soft and hard polyvinyl chloride (PVC) extract stress on the photosynthetic parameters (Fv/Fm, Yield, qP and rETRmax) of I. galbanaNote: Fv/Fm, Yield, qP and rETRmax stand for the maximum efficiency quantum yield of PSⅡ, the actual photochemical efficiency of PSⅡ in the light, photochemical quenching and the maximum relative electron transport rate, respectively.

图2 软PVC浸出液((a)、(c)、(e))和硬PVC浸出液((b)、(d)、(f))胁迫对3种海洋微藻细胞密度的影响注:*表示与对照组(100%)差异显著。Fig. 2 Effects of soft PVC extract ((a), (c), (e)) and hard PVC extract ((b), (d), (f)) stress on cell density of three marine microalgae strainsNote: *represents significant difference (P<0.05) with control (100%).
图4((e)~(h))和图2(f)给出了小球藻光合作用相关参数和细胞密度在不同浓度硬PVC浸出液及胁迫时间作用下的变化趋势。双因素方差分析结果表明,硬PVC浸出液浓度对小球藻Fv/Fm和Yield有影响(P<0.05),胁迫时间对小球藻的4项光合作用参数和细胞密度均有影响(P<0.05),二者交互作用(浓度×时间)对该藻株的Fv/Fm、Yield和qP有影响(P<0.05),其中胁迫时间对Yield和qP的影响最显著(表4)。多重比较结果显示,硬PVC浸出液各处理组的Fv/Fm略高于对照组,但组间差异不显著;各处理组的Yield略低于对照组,组间差异亦不显著;qP、rETRmax和细胞密度随浓度变化不明显(表4)。各光合作用参数随胁迫时间延长呈先轻微上升后有下降趋势。72 h时,细胞密度在100 g·L-1处理组最低,为对照组的93.30%。

图3 软PVC和硬PVC浸出液胁迫对中肋骨条藻光合作用参数(Fv/Fm、Yield、qP和rETRmax)的影响Fig. 3 Effects of soft and hard PVC extract stress on the photosynthetic parameters (Fv/Fm, Yield, qP and rETRmax) of S. costatum
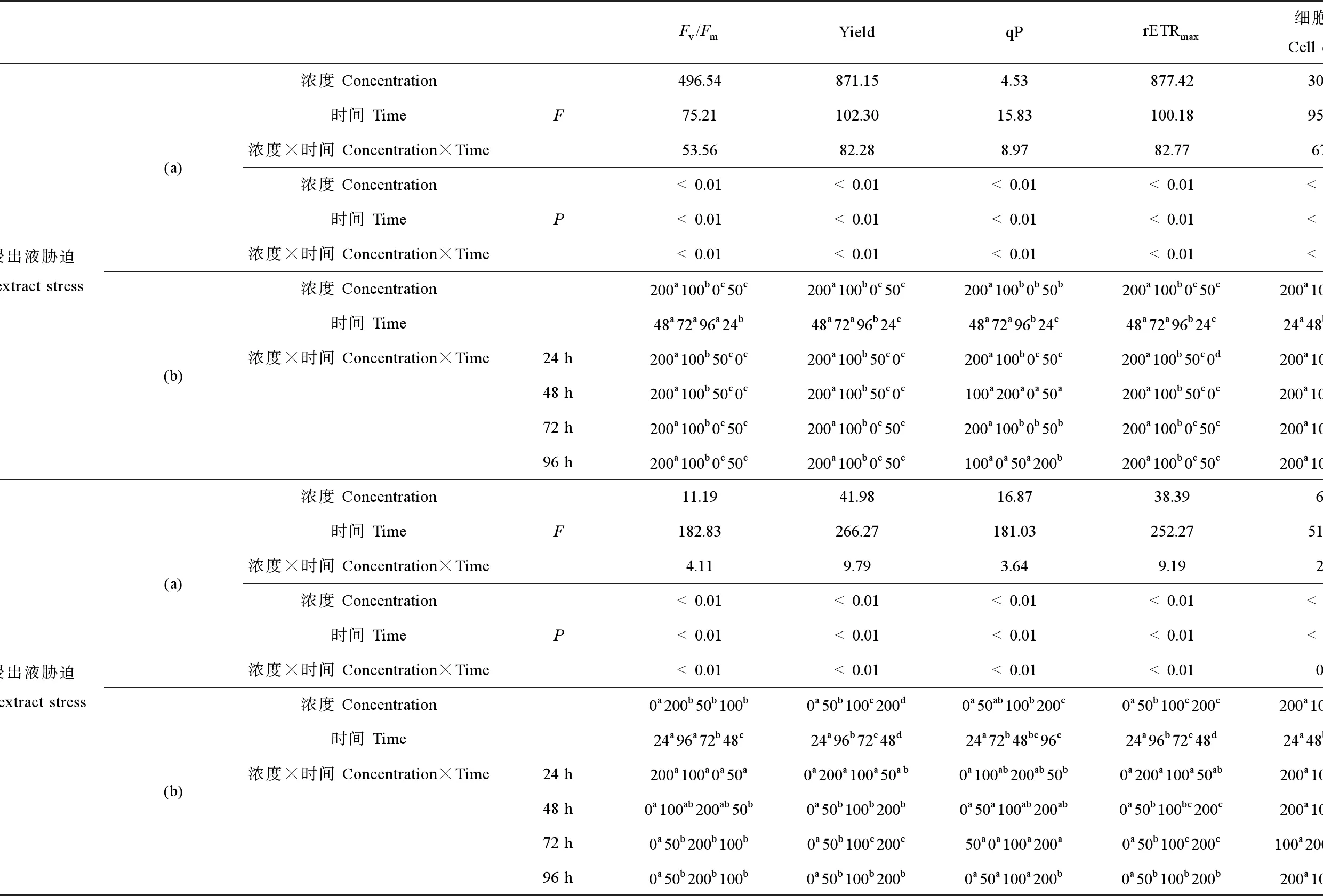
表2 软PVC和硬PVC浸出液浓度和胁迫时间对球等鞭金藻光合作用参数和细胞密度的双因子方差分析(a)和多重比较(b)结果Table 2 Summary of multiple factors analysis of variance (MANOVA) (a) and S-N-K multiple comparison test (b) results on the photosynthetic parameters and cell density of I. galbana exposed to different concentrations of soft and hard PVC extract for different time
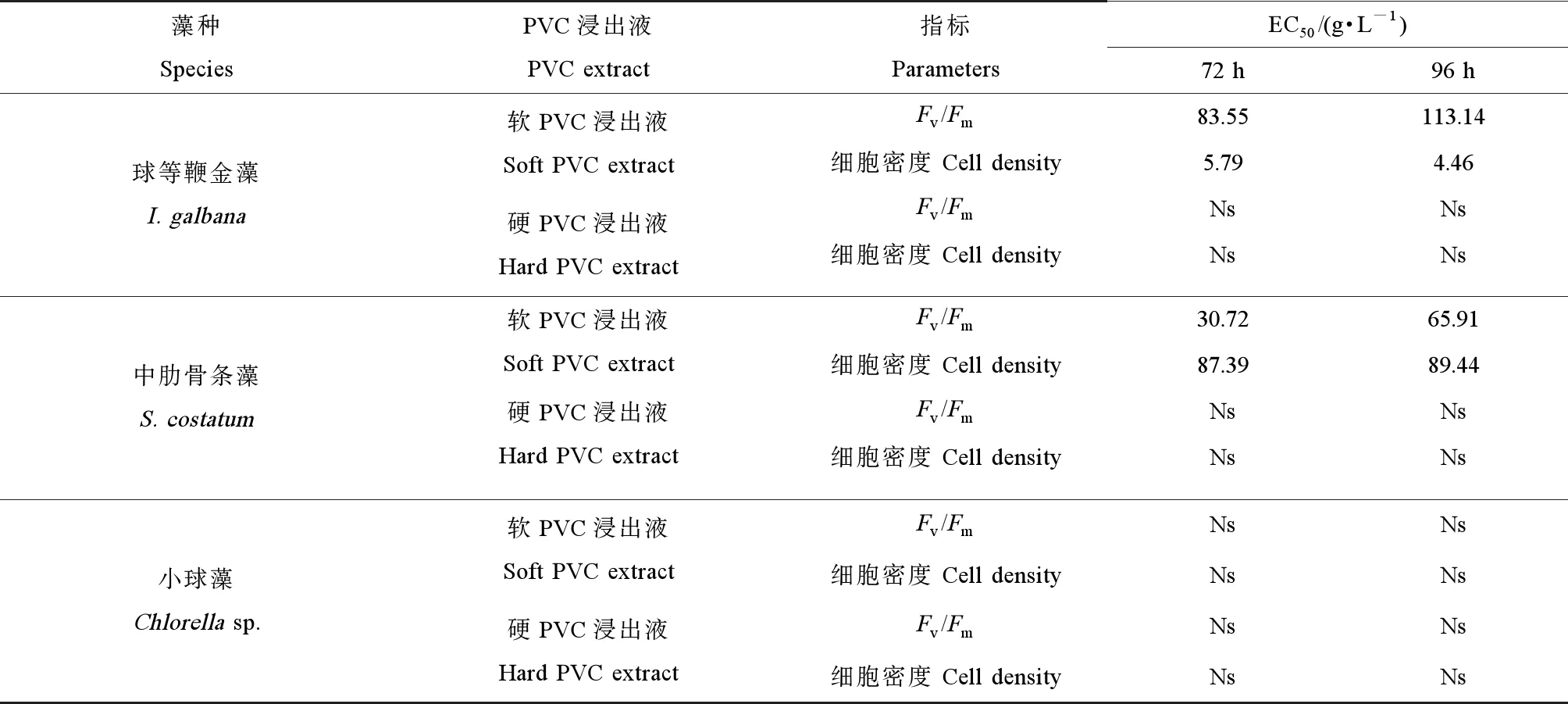
注:多重比较结果按升序排列,即a Note: Multiple comparison test results are arranged in increasing order from left to right a 表3 软PVC和硬PVC浸出液浓度和胁迫时间对中肋骨条藻光合作用参数和细胞密度的双因子方差分析(a)和多重比较(b)结果Table 3 Summary of MANOVA (a) and S-N-K multiple comparison test (b) results on the photosynthetic parameters and cell density of S. costatum exposed to different concentrations of soft and hard PVC extract for different time 注:多重比较结果按升序排列,即a Note: Multiple comparison test results are arranged in increasing order from left to right a 表4 软PVC和硬PVC浸出液浓度和胁迫时间对小球藻光合作用参数和细胞密度的双因子方差分析(a)和多重比较(b)结果Table 4 Summary of MANOVA (a) and S-N-K multiple comparison test (b) results on the photosynthetic parameters and cell density of Chlorella sp. exposed to different concentrations of soft and hard PVC extract for different time 注:多重比较结果按升序排列,即a Note: Multiple comparison test results are arranged in increasing order from left to right a 表5给出了不同种类和浓度的PVC浸出液胁迫下,3种海洋微藻Fv/Fm和细胞密度在72~96 h的EC50变化情况,其大小与PVC浸出液种类和微藻种类有关。软PVC浸出液抑制3种海洋微藻所得的EC50为:球等鞭金藻4.46~113.14 g·L-1,中肋骨条藻30.72~89.44 g·L-1,小球藻未达到半致死浓度。硬PVC浸出液胁迫下,3种海洋微藻均未达到半致死浓度。因此,3种海洋微藻对软PVC浸出液的敏感性顺序为球等鞭金藻(金藻门)>中肋骨条藻(硅藻门)>小球藻(绿藻门)。 图4 软PVC和硬PVC浸出液胁迫对小球藻光合作用参数(Fv/Fm、Yield、qP和rETRmax)的影响Fig. 4 Effects of soft and hard PVC extract stress on the photosynthetic parameters (Fv/Fm, Yield, qP and rETRmax) of Chlorella sp. 图5给出了软PVC和硬PVC浸出液中所含塑化剂的类型和含量。软PVC中邻苯二甲酸二辛酯(dioctyl phthalate, DNOP)浓度为41.05 μg·L-1,邻苯二甲酸二丁酯(dibutyl phthalate, DBP)浓度为175.70 μg·L-1;硬PVC中DNOP浓度为97.74 μg·L-1,邻苯二甲酸二壬酯(dinonyl phthalate, DNP)浓度为56.03 μg·L-1。 图5 软PVC和硬PVC浸出液中所含塑化剂的类型和含量注:软PVC中DNOP浓度为41.05 μg·L-1,DBP浓度为175.70 μg·L-1;硬PVC中DNOP浓度为97.74 μg·L-1,DNP浓度为56.03 μg·L-1。Fig. 5 Types and contents of plasticizers in soft PVC and hard PVC extractNote: The concentrations of DNOP and DBP are 41.05 and 175.70 μg·L-1 in the soft PVC extract; the concentrations of DNOP and DNP are 97.74 and 56.03 μg·L-1 in the hard PVC extract. 表5 PVC浸出液对3种海洋微藻Fv/Fm和细胞密度的半数效应浓度(EC50)变化Table 5 Half-effective concentration (EC50) for Fv/Fm and cell density of 3 marine microalgae strains exposed to PVC extract 注:Ns表示数据未得出。 Note: Ns indicates that the data is not detected. 叶绿素荧光是评估胁迫环境下微藻光合作用特征的有效方法,其时变信息与光合反应进程密切偶联,可以快速准确地反映出外界环境变化对微藻光合作用过程的影响,近年来叶绿素荧光技术正在逐渐取代传统的分光光度法,在植物逆境生理研究中得到快速的发展和应用。借助叶绿素荧光动力学变化,可深入了解污染物对微藻光合系统(特别是PSⅡ)的影响及微藻对逆境的响应机理[35-37]。本实验结果表明,软PVC浸出液胁迫后,球等鞭金藻和中肋骨条藻的光合作用参数Fv/Fm、Yield、qP和rETRmax均随PVC浸出液浓度增大显著降低,在高浓度处理组(100~200 g·L-1)达到最小值,小球藻则无显著变化。Fv/Fm下降表明,软PVC浸出液使球等鞭金藻和中肋骨条藻的PSⅡ反应中心活性降低,阻碍了光合电子传递过程。Yield下降说明软PVC浸出液阻碍上述2种微藻的藻细胞同化力的形成。qP下降表示上述2种微藻在软PVC浸出液胁迫下电子传递受阻,进行光合作用的电子减少,以热或其他形式耗散的光能增加。rETRmax下降则说明软PVC浸出液使上述2种藻的电子传递效率降低。硬PVC浸出液对3种微藻光合作用参数的影响因藻种不同有所差异。硬PVC浸出液胁迫下,球等鞭金藻各处理组的光合作用参数Fv/Fm、Yield、qP和rETRmax均高于对照组;中肋骨条藻的4项光合作用参数显著降低;小球藻的上述光合作用参数则与对照组无显著差异。其中,低浓度(50 g·L-1)硬PVC浸出液能够促进球等鞭金藻的光合能力的这一结果,与胡芹芹等[29]和刘伟杰等[38]的所得结论一致,原因可能是微藻对环境胁迫具有一定的耐受能力,低浓度的毒性物质可诱导藻细胞超氧化物歧化酶(SOD)活性迅速增加,从而增强对活性氧的清除能力以保持自由基平衡,最终降低了塑料浸出液的毒性。综合上述结果可以看出,软PVC浸出液胁迫对球等鞭金藻、中肋骨条藻和小球藻的影响大于硬PVC浸出液,这可能是因为软PVC中增塑剂含量大于硬PVC。有研究表明,当PVC的增塑剂含量<10%,其制品为硬质(即硬PVC);若>30%,其制品为软质(即软PVC)[39]。增塑剂是PVC主要毒性来源,如邻苯二甲酸酯类,其相对分子质量少,通过氢键或范德华力而非化学键连接到PVC高分子链上,很容易向外部迁移,污染微藻生存环境[40-41]。 目前,有关增塑剂对水生生物毒性的研究多集中于对鱼虾的生长抑制作用及致死率等方面[12,42-43],而对微藻的毒性研究还相对较少[44-45]。有研究结果表明,单一增塑剂能够抑制藻细胞增殖,且随浓度升高,抑制作用增强[37,46-47],可见增塑剂作为一种具有生态毒性效应的环境激素对微藻的生长具有明显的干扰作用。而有关多种增塑剂联合毒性对海洋微藻的影响较少报道,李英[48]研究了邻苯二甲酸二乙酯(diethyl phthalate, DEP)和邻苯二甲酸二丁酯(dibutyl phthalate, DBP)联合暴露对角毛藻(Chaetocerossp.)、盐生杜氏藻(Dunaliellasalina)和新月柱鞘藻(Cylindrothecaclosterium)的影响,王晶晶等[49]探讨了DEP和壬基酚(nonylphenol, NP)对杜氏盐藻(D.salina)的联合毒性效应,结果表明,增塑剂在等浓度联合作用下对微藻的生长具有显著抑制效应。本实验所用PVC浸出液是含有多种PAEs的混合液,软PVC浸出液中主要含有DBP和DNOP这2种塑化剂成分,硬PVC浸出液中主要含有DNP和DNOP这2种塑化剂成分。本研究结果表明,软PVC浸出液对球等鞭金藻和中肋骨条藻的生长均具有显著胁迫作用;硬PVC浸出液对中肋骨条藻的生长具有显著胁迫作用。特别是不同浓度软PVC浸出液作用下,上述微藻的细胞密度均受到不同程度的抑制,且抑制程度与软PVC浸出液的浓度呈正相关,在高浓度处理组(100~200 g·L-1)达到最小值。这与胡芹芹等[29]、黄博珠等[44]、况琪军等[45]和别聪聪等[46]的研究结果一致。上述研究结果表明,PVC浸出液的毒性效应表现在可影响微藻的光合作用,从而抑制细胞生长,同时引起藻细胞的膜质过氧化程度增强,进而导致细胞膜及类囊体膜的结构损伤和功能丧失,从而抑制藻细胞生长和代谢[28-29]。微藻在受到化学物质胁迫时,在胁迫早期阶段可能会出现对微藻的生长及其生化指标具有促进作用的现象[50]。杨慧丽和段舜山[47]在研究DBP对三角褐指藻的生态毒性效应时发现,在胁迫12 h时,在浓度为5 mg·L-1的DBP处理条件下,三角褐指藻的PSⅡ的潜在活性(Fv/Fo)、Fv/Fm、Yield和光合电子传递效率(ETR)等光合作用参数逐渐上升,这与本实验中硬PVC浸出液对球等鞭金藻的研究结果一致,该机理到目前为止尚未阐明,还需要实验来进一步证实。 有关PVC浸出液对海洋微藻叶绿素荧光特性和生长的影响目前还未见报道,但关于其他外源性因子,如重金属[34,51-53]、抗生素[54-55]和持久性有机污染物[56-57]对海洋微藻光合作用和生长的报道已有不少。一般来说,微藻对外源性因子的敏感性顺序为金藻门>硅藻门>绿藻门。本实验结果与上述研究结果一致,3种海洋微藻对软PVC浸出液的敏感性顺序为球等鞭金藻>中肋骨条藻>小球藻,由此推测海水中塑料持续增多可能会影响海洋生态系统中微藻的种群群落结构。此外,本研究发现球等鞭金藻和中肋骨条藻的Fv/Fm和细胞密度对硬PVC浸出液的敏感性不强。小球藻的Fv/Fm和细胞密度对软、硬PVC浸出液的敏感性不强,均未达到半致死浓度,说明硬PVC浸出液对3种微藻的毒性效应相对较低,PVC浸出液对微藻的胁迫作用具有种间差异性。PVC浸出液对3种微藻的EC50值与PVC浸出液种类、微藻种类有关。 本研究结果表明,球等鞭金藻和中肋骨条藻的4项光合作用参数和细胞密度对软PVC浸出液胁迫更为敏感,而对硬PVC浸出液敏感性较弱,且其光合作用参数和细胞密度均受到软PVC浸出液不同程度的抑制,抑制程度与软PVC浸出液的浓度呈正相关,在高浓度处理组(100~200 g·L-1)时达到最低值。小球藻的抗逆性较强,其光合作用参数和细胞密度对软、硬PVC浸出液胁迫均不敏感。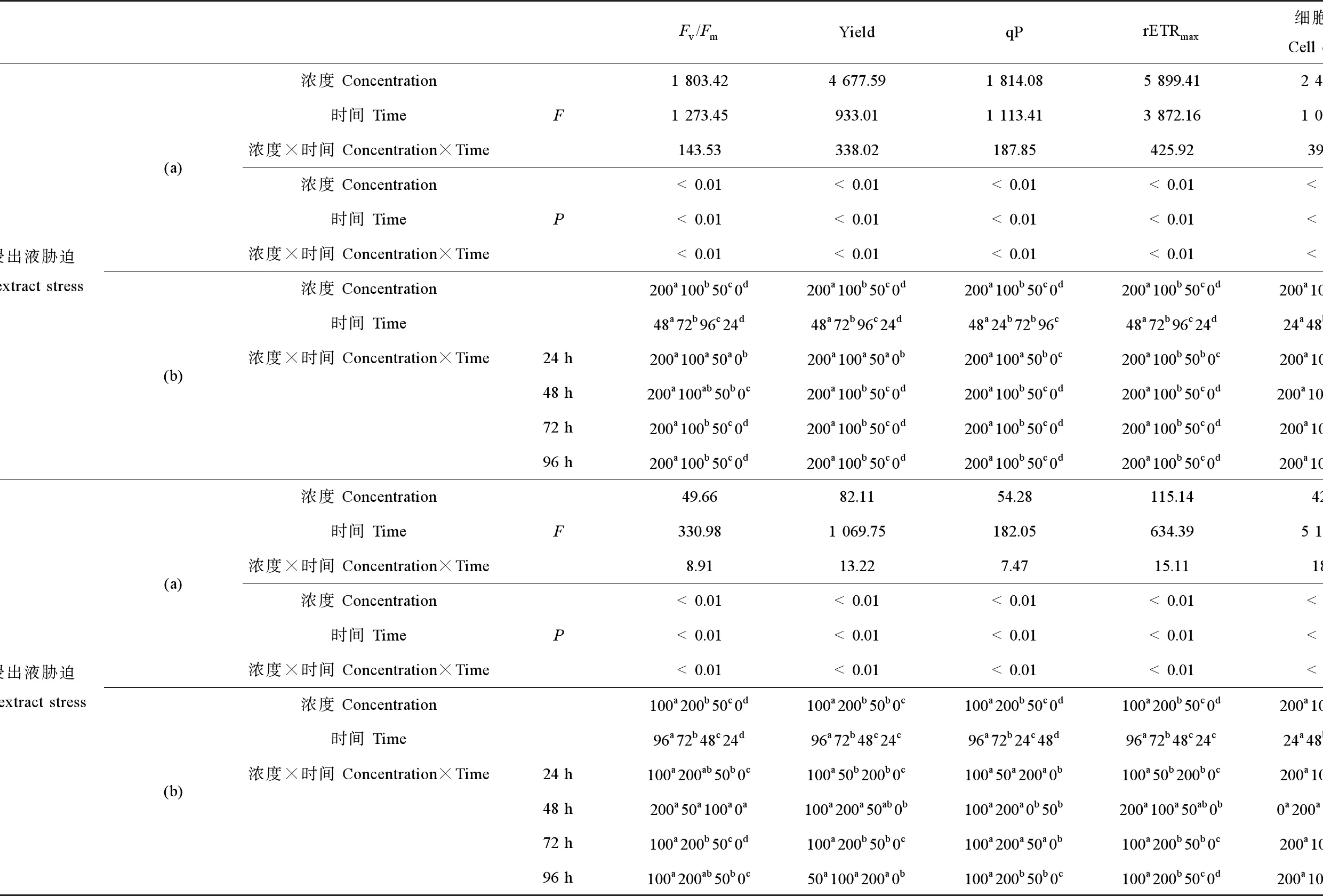
2.4 EC50
2.5 软PVC和硬PVC浸出液的GC-MS检测结果

3 讨论(Discussion)

