低压静电场协同低温保鲜技术对蓝点马鲛贮藏过程中品质变化的影响
梁瑞萍,谢 超,王益男
(1.浙江海洋大学食品与药学学院,浙江舟山 316022;2.浙江驰力科技股份有限公司,浙江舟山 316021)
蓝点马鲛Scomberomorus niphonius 又名鲅鱼,鰆鱼,沿海地区多称竹鲛、串乌,一般体长为25~50 cm、体质量300~1 000 g。其广泛分布于北太平洋西部海域,我国蓝点马鲛种群分布于东海、黄海和渤海,主要渔场有舟山、连云港及山东南部沿海[1]。由于蓝点马鲛食性多以鱼虾等水生动物为食,故其体态肥满,肉质紧实细嫩,是一种具有较高经济价值的优质海产鱼类。蓝点马鲛滋味鲜美、营养丰富,蛋白质含量极高,且富含多种维生素、矿物质等营养元素[2]。另外,因其习性,蓝点马鲛体内胆固醇含量低,鱼肉中富含大量氨基酸以及钙、铁、钠等微量元素以及能够提高人脑智力发育的DHA 元素;另外还具有多种食疗功效,常食对治疗营养不良、贫血、产后虚弱、早衰和神经衰弱等症有一定辅助疗效[3]。因其生存环境常年处于高盐高压低温的水域,蓝点马鲛在捕捞过程中不易存活,捕捞上岸即死亡,随之鱼体鲜度品质开始发生劣化,故其保鲜要求高,难度较大。而现有的保鲜手段较为单一,码头常以碎冰覆盖,工厂、家庭多采用-18 ℃冷冻保鲜,如此虽能长时间保持蓝点马鲛品质,但其能耗较大,且不能完全阻止鱼体品质的下降和腐败菌的滋生,使得产品口感变差,营养物质含量降低。
微冻保鲜在尽可能延长产品保鲜期限的前提下,以其能耗低、解冻便捷、解冻损失率低的优势成为了水产生鲜领域贮藏、流通的主要方式之一。物料在已知冰点之下1~2 ℃进行保鲜,其所含多种水分冻结在物料上形成保护层,通过低温保护层的延缓作用,减少物料因外界温度波动导致的生物[4]、物理[5]及化学[6]变化。有研究表明水产品在短期内微冻贮藏和-18 ℃冷冻保藏效果基本一致[7]。但微冻保鲜由于其接近物料冰点,极易受环境温度波动影响,导致其水分结晶的增大、重结晶等现象,对产品的质量水平起到负面影响。低压静电场技术(LVEF)通过电场发生装置产生直流静电场,电场中的生物体细胞原生质膜的跨膜电位受到影响,同时也能影响食品中微生物和酶的生物活性[8-9],从而在一定程度上抑制食品品质的下降,延长货架期。但当前对静电场保鲜的研究多停留在高压静电场阶段,如HE Xiangli,et al[10]分别用6、8、10 kV的电场处理猪肉,分别测其解冻时间缩短了12、18、24 min,微生物总数减少了0.5~1 lg(CFU·g-1)。MOUSAKHANI-GANJEH,et al[11]发现施加高压静电场能有效加快冷冻金枪鱼块的解冻速率,抑制二甲胺、三甲胺生成,同时将解冻速率增大到对照组样品的1.78 倍,但后续测得高压电场会使蛋白质溶解度异常,对样品硬度、粘性、粘结性和咀嚼性也有一定影响。但高压静电场电压强度高,操作复杂,对于设备和贮藏环境要求高,另外安全性也得不到保证,其大规模应用前景堪忧。而低压静电场技术基于SE&BA 鲜霸电场发生装置,通过构建低压静电场发生体系,在低温环境下创造低压静电场环境,以低压静电场联合低温微冻贮藏保鲜食材,既能延缓产品品质劣变,又解决了实际操作中的安全性问题。有研究发现,采用阻隔气调结合低压静电场保鲜,能够有效降低猪肉冻藏品质下降,延长产品货架期同时缩短解冻时间[12]。另外,在-18 ℃下低压静电场保鲜下牛肉组织冰晶分布均匀粒径较小,液体流失率与蒸煮损失率均有所下降[13]。本文以舟山海捕新鲜蓝点马鲛为主要原材料,研究其-4 ℃低温环境下各理化指标的变化,评价低压静电场技术对蓝点马鲛微冻贮藏过程中品质的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物
新鲜蓝点马鲛,舟山正品科技公司提供。
1.1.2 实验试剂
乙醇、盐酸、氢氧化钠、硼酸、腺苷酸、氧化镁、次黄嘌呤、硫代巴比妥酸、次黄嘌呤核苷、高氯酸、磷酸、肌苷酸、乙二胺四乙酸二钠、腺苷二磷酸均为分析纯,河南东科化工产品销售有限公司;三氯乙酸(优级纯),武汉华翔科洁生物技术有限公司;磷酸缓冲液,北京百奥莱博科技有限公司;4%多聚甲醛(RT),枣庄润欣化工科技有限公司;2.5%戊二醛(优级纯),武汉华翔科洁生物技术有限公司;切片石蜡,武汉华翔科洁生物技术有限公司。
1.1.3 实验仪器
TESTO176T4 温度记录仪,青岛路博兴业环保科技有限公司;FJ200 均质机,上海重逢科学仪器有限公司;FA-G 分析天平,常州万泰天平仪器有限公司;高精度数显匀浆机,太原市晋冀通实验仪器设备有限公司;LC-10Tvp 液相色谱仪,津工仪器科技(苏州)有限公司;TU-1900 紫外可见分光光度计,济南来宝医疗器械有限公司;S-1-150S 高速冷冻离心机,赛多利斯公司;家用冰箱,海尔集团;真空包装机,诸城市齐昌机械科技有限公司;PB-10 酸度计,英国Synbiosis 公司;自动菌落分析仪,上海励图公司;扫描电子显微镜,美国贝克曼公司;低压静电放电板,浙江驰力科技公司;PB-10 酸度计,日本日立公司;水浴恒温振荡器,上海莱卡贸易公司;快速切片扫描仪,IKA 公司;SE&BA 3 000 kV 50 Hz 鲜霸电场装置,浙江驰力科技股份有限公司。
1.2 实验方法
1.2.1 样品处理及分组
将新鲜蓝点马鲛去头、去内脏,切块,洗净后真空袋装处理,放置-4 ℃普通小冷库和拥有低压静电场发生装置的小冷库保鲜,分别在第0、2、5、9、15、20、27 d 采样,测取相关指标。
空白组:-4 ℃微冻处理的蓝点马鲛;实验组:3 000 V、50 Hz 低压静电场,-4 ℃微冻处理的蓝点马鲛。
1.2.2 冷却曲线的测定
参考SABLANI,et al[14]方法稍作修改。将新鲜蓝点马鲛处理干净后,用小刀在蓝点马鲛鱼块上切出3 cm×3 cm×3 cm 小口放置-18 ℃冰箱冷冻处理,随后用温度记录仪测定蓝点马鲛块小口处的温度,每2 min 记录一次,直至样品中心温度达到-18 ℃,绘制蓝点马鲛冷却曲线。
1.2.3 pH 的测定
取5 g 蓝点马鲛肉搅碎,随后将样品置于15 mL 离心管内,添加10 mL 超纯水,用均质机处理1 min,测定蓝点马鲛pH。
1.2.4 TVB-N 的测定
根据GB 5009.228[15]凯氏定氮仪法测定。
1.2.5 TBA 的测定
参考GB 5009.181[16]的方法稍作修改。称取5 g 蓝点马鲛样品,研磨搅碎后置于100 mL 具塞锥形瓶中,量取50 mL 三氯乙酸混合液,摇匀后将锥形瓶置于恒温振荡器中振摇30 min,样品冷却后进行双重过滤处理,用移液枪取第2 次滤液上清液5 mL,往滤液中添加5 mL 0.02 mol·L-1的TBA 水溶液,混合均匀后置于温度为90 ℃的恒温水浴锅中加热40 min,加热完成后将样品冷却1 h,用分光光度计测取其在532 nm处的吸光值。

式中X 为TBA 值(mg·100-1·g-1),c 为试样丙二醛浓度(μg·mL-1),V 为样品溶液定容体积(mL),m 为蓝点马鲛质量(g),100 与1 000 为换算系数。
1.2.6 TVC 的测定
参考GB 4789.2[17]的方法进行测定。
1.2.7 K 值的测定
参考SC/T 3048[18]中高效液相色谱法稍作修改。20 ℃下取马鲛鱼样品,于4 ℃下进行均质处理,将2 g蓝点马鲛样品与10%高氯酸溶液20 mL 混和均匀,振荡后进行10 min 的离心处理,再用10 mL 高氯酸溶液提取样品,离心处理10 min,随后调节样品pH 至6.0~6.4,定容蓝点马鲛样品至50 min,离心处理10 min,将样品过微孔滤膜进行过滤,取滤液待测。色谱条件:C18 色谱柱;柱温:35 ℃;波长:254 nm;流速:1.0 mL·min-1;进样量:20 μL。

式中:MATP为腺苷三磷酸含量,MADP为腺苷二磷酸含量,MAMP为腺苷酸含量,MIMP为肌苷酸含量,MHxR为次黄嘌呤核苷含量,MHx为次黄嘌呤含量,单位均为μmol·g-1。
1.2.8 H&E 染色试验
20 ℃下取出蓝点马鲛,用样刀取1 cm×1 cm×4 mm 肌肉组织薄片,随后立即置于4%多聚甲醛溶液中于室温下固定1 d,固定处理完成后,用PBS 冲洗3 次,冲洗时间为5 min,由高到低梯度进行乙醇脱水,采用二甲苯透明样品,样品透明完后做浸腊包埋,最后将样品进行切片染色分析扫描。
1.2.9 SEM 扫描电镜组织微观结构分析
20 ℃下取出蓝点马鲛,将其处理完成后,切成4 mm×4 mm×15 mm 的立方体,立刻置于2.5%戊二醛溶液中固定,固定温度为4 ℃,固定时间为4 h,固定完成后,用pH 7.2 的磷酸盐缓冲液每隔10 min 冲洗1次,共冲洗3 次,用30%~100%浓度乙醇对冲洗完的样品进行脱水处理,随后放入干燥器中干燥12 h,喷金粘样扫描。
1.3 数据处理
采用GraphPad Prism 8 进行数据处理、作图,进行3 次平行实验。
2 结果与分析
2.1 冷冻曲线分析
水产类冰点测定的方法现使用较普遍的主要是DSC法和冷却曲线法[19]。相较于DSC 冰点测定法,冷却曲线法更易操作分析,且测定结果更为精准。如图1 为蓝点马鲛的冷却曲线。从图1 中可以看出蓝点马鲛的初始温度为10 ℃,随着冷冻时间的推移,在24 min 时样品的中心温度迅速下降,达到0 ℃,40 min 时中心温度降至最低处于过冷点并释放热量,48 min 时鱼体中心温度开始上升,上升至120 min的过程中,鱼体中心温度处于相对稳定的状态。所谓的冰点[19]即中心温度达到最低后出现升温的临界点,通过自动温度记录仪得出-2 ℃即为蓝点马鲛的冰点。因为实验微冻条件的需要并结合实际情况,将蓝点马鲛的保鲜温度设定为-4 ℃。

图1 蓝点马鲛冷却曲线Fig.1 S.niphonius cooling curve
2.2 两种条件下蓝点马鲛pH 变化
28 d 内不同储藏条件下实验组和空白组的pH 变化情况如图2 所示,实验组和空白组的pH 均为先下降后上升。蓝点马鲛的初始pH 为7.08,3、6 d 测量时均有不同程度的变化。此阶段pH 下降变化产生的原因是蓝点马鲛出水即死,鱼体内糖原和ATP 分解产生酸。pH 下降还会导致蓝点马鲛鱼体的温度升高,加快了微生物繁殖的速度,促进组织水解酶的作用[20]。实验在进行到6 d 以后,实验组和空白组的pH 开始上升,实验组空的pH 曲线在15 d 时回升速度减缓,28 d 时的pH 为7.33,空白组在21 d 时pH 超过初始值达到了7.21,在28 d 时的pH 为7.48,略高于实验组。鱼体在贮藏后期pH 上升是由于在贮藏过程中鱼体蛋白质被微生物和水解酶分解成氨基酸和一些碱性物质。综上所述,鱼体的pH 呈现出一个先下降后上升的趋势。低压静电场处理后的蓝点马鲛pH 在±0.33 之内波动,这种差异产生的原因可能是鱼体内微生物和水解酶的活性降低,而微生物和水解酶活性的降低的原因可能是低压静电场改变了蓝点马鲛细胞膜的跨膜电位差,从而减少了碱性物质的产出,缩小了鱼体pH 的波动范围,保证鱼体处于一个较好的新鲜度。pH 越高则鱼体的腐败程度越高,水产品在贮藏过程中需要注意pH 的变化,这与李来好等[21]的观点一致。

图2 两种条件下蓝点马鲛pH 变化Fig.2 Changes in pH of the S.niphonius under two conditions
2.3 两种条件下蓝点马鲛TVB-N 值变化
测定两种条件下蓝点马鲛TVB-N 值的变化与GB 10136[22]中TVB-N 值鲜度评价指标进行比较,用以判定蓝点马鲛的鲜度。如图3 所示,在整个贮藏周期内对照组和空白组的TVB-N值均呈现上涨趋势,空白组的上升速度更快。在前6 d 两种条件下的TVB-N 值增长较为迅速,分别增长了6.46 mg·100-1·g-1、12.71 mg·100-1·g-1,空白组增加相对较快。产生这种差异的原因可能是蓝点马鲛鱼体中心温度过高,微生物活动和鱼体中心温度的上下波动使蓝点马鲛蛋白质脱氨基作用加快导致TVB-N 迅速上升。6~21 d 时2 种条件下的TVB-N 值均呈缓慢上升。21 d 时空白组TVB-N 值为28.73 mg·100-1·g-1,已接近不可食用,28 d 时实验组TVB-N 值为23.24 mg·100-1·g-1,低于国家标准水产类的限定阈值,远低于空白组28 d 时的TVB-N值。表明低压静电场-微冻环境能抑制蓝点马鲛组织蛋白酶和微生物活性[23]减缓了蓝点马鲛蛋白的分解,延长储藏时间,提高保鲜效果。

图3 两种条件下蓝点马鲛TVB-N 变化Fig.3 Changes of TVB-N in S.niphonius under two conditions
2.4 两种条件下蓝点马鲛TBA 变化
蓝点马鲛属深海鱼类,其体内除了丰富的蛋白质等营养物质外,还含有较多的不饱和脂肪酸,在鱼体贮藏、加工及运输等过程中容易发生氧化,从而降低产品的商业化价值[24]。通过分析样品贮藏期内TBA 的变化,可以确定其不饱和脂肪酸的氧化程度,从而有效评价产品的鲜度品质。图4 表明空白组和实验组的TBA 曲线均呈现快速上涨的趋势。蓝点马鲛初始TBA 值为0.38 mg·100-1·g-1,6 d 时空白组和实验组TBA 值相差0.11 mg·100-1·g-1,曲线增长趋势比较缓慢,且TBA 值随着时间推移不断增长,28 d 时空白组的TBA 值为1.81 mg·100-1·g-1,而实验组的TBA 值仅有1.30 mg·100-1·g-1。这与BARSOTTI[25]、ARROYO[26]得出的结论一致。在实验后期蓝点马鲛鱼体中心温度降低,冰晶也随着变大,从而加剧了鱼体细胞的破坏,而低压静电场产生的电荷能形成隔绝层,减少了氧气和蓝点马鲛中不饱和脂肪酸的接触范围,抑制了脂肪的氧化酸败。表明低压静电场-微冻环境能延缓蓝点马鲛脂肪氧化,提高贮藏效果。
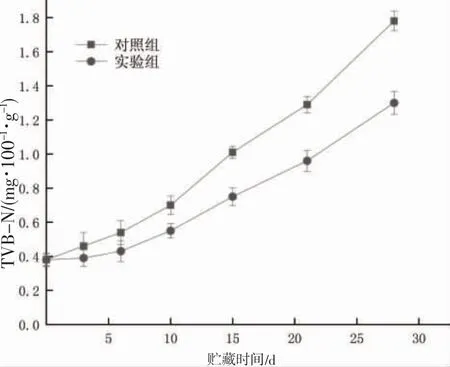
图4 两种条件下蓝点马鲛TBA 变化Fig.4 Changes in TBA of S.niphonius under two conditions
2.5 两种条件下蓝点马鲛TVC 变化
微生物在水产品的变质腐败过程中起至关重要的作用,水产品菌落总数指标代表水产品鲜度受微生物影响程度[27]。蓝点马鲛在两种不同处理条件下菌落总数的变化情况如图5 所示。实验组、空白组TVC 曲线随贮藏时间延长均呈上升趋势,其中空白组上升更为迅速,蓝点马鲛样品初始TVC 为0.63 lg(CFU·g-1),6 d 时空白组和实验组TVC 分别为1.56 lg(CFU·g-1)、0.87 lg(CFU·g-1),尚无明显增长,而随着贮藏期达到6 d后,2 组样品的TVC 增长速度都开始出现上升,对照组TVC 在贮藏期28 d 时达到6.43 lg(CFU·g-1),超过限值6 lg(CFU·g-1)标志着产品质量下降到不可接受水平[28];而在相同时间下,添加电场处理的实验组TVC 水平依旧处于正常水平。在贮藏过程中,贮藏初期鱼肉非嗜冷菌会因温度变化数量锐减,但剩余菌种在贮藏中后期适应了低温,菌群繁殖加快,从而提高了菌落总数整体水平。实验组微生物总数在变化趋势与对照组相近,但曲线增速缓慢,过渡期也更长[29]。结果表明低压静电场的添加能在蓝点马鲛微冻贮藏过程中降低整低菌落总数的水平,这可能是因为其能够电离空气产生离子雾和O3[30],O3可对微生物生长进行抑制,减缓其生长速率甚至杀灭部分微生物。
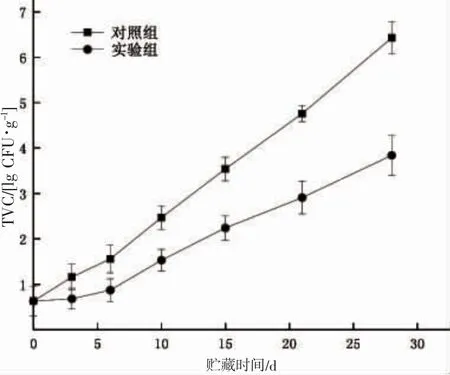
图5 两种条件下蓝点马鲛TVC 变化Fig.5 Changes in TVC of the S.niphonius under two conditions
2.6 两种条件下蓝点马鲛K 值变化
在水产品鲜度评价体系中,K 值作为其中最全面有效的评价指标,受到了行业的普遍认同与广泛应用。在K 值评价标准下,水产品的鲜度标准被划分为4 个等级,分别是:K 值≤20%:产品处于最佳鲜度,达到生食标准;20%<K 值≤60%:产品鲜度良好,处于可接受范围内;60%<K 值≤80%:产品鲜度一般,出现一定程度的腐败;K 值>80%:产品鲜度恶劣,重度腐败不可食用[31]。马鲛鱼在两种不同处理方式作用下,随贮藏期限的延长,其鱼肉K 值变化如图6。
由图6 可知,新鲜的蓝点马鲛K 值为13.28%,由于蓝点马鲛捕捞后即死亡,故而ATP 被酶解速度快,鲜度水平极好。蓝点马鲛样品的K 值在2 种不同处理方式下均呈上升趋势,其中未添加电场的对照组上升始终处于较快水平。在贮藏时间为10 d时,空白组K 值为68.17%,鲜度水平下降,出现轻微腐败现象,贮藏10~21 d,其K 值增长速度减缓,鲜度劣化水平有所平缓,而在贮藏结束时,空白组样品的K 值达到了89.86%,呈重度腐败不可食用状态。而相比之下,添加了电场处理的实验组K 值增速较低,其K 值在贮藏时间达到21 d 时仍处于可接受范围内,当贮藏期达到28 d 时,实验组样品的K 值为62.19%,出现了一定程度的腐败迹象。蓝点马鲛在2 种处理方式下贮藏0~28 d 的过程中,实验组K 值水平始终低于空白组,这一结果说明添加低压静电场在微冻贮藏条件下可以减缓蓝点马鲛腐败变质速率,起到良好的保鲜作用,导致这一结果的原因可能是通过影响内源酶活性改变了ATP 的降解速率,从而抑制产品K 值的上升。
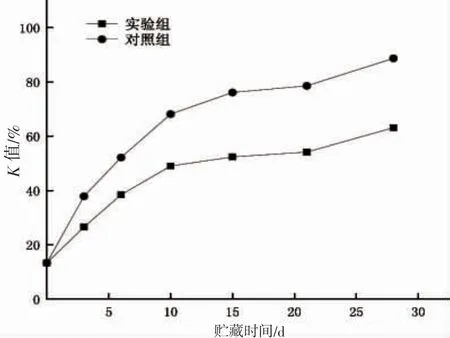
图6 两种条件下蓝点马鲛K 值变化Fig.6 Change of K value of S.niphonius in radar net under two conditions
2.7 两种条件下蓝点马鲛H&E 染色分析
H&E 染色分析是水产品常见的组织结构分析手段,我们分别对实验组和未处理空白组在0、3、10、21、28 d时的组织样品进行H&E 染色,得到不同贮藏时间内马鲛鱼在两种处理条件下横向剖面图见图7。通过图7(a)可以看出,新鲜状态下样品的肌纤维线条排列整齐规律,其连接状态紧密无缝隙。在贮藏3 d后,未加电场处理的空白组样品由小直径到大直径纤维的肌肉纤维间隙逐渐增大,且能观察到部分肌间生成了细小冰晶;相比之下实验组可以发现微小肌肉裂痕,未观察到明显冰晶。在贮藏期达到10~21 d 时,可以看到实验组纤维束密度下降,直径下降,部分肌纤维受到挤压后产生变形,细胞已经开始出现水分流失,但肌原纤维依然排列整齐未观察到有明显的断裂;与此同时,空白组(e)、(g)可以观察到肌肉纤维内部出现断裂,结构破坏较明显,其冰晶粒径出现大幅度膨胀。和图(h)相比,图(i)肌肉组织可以看到大量的撕裂现象,观察到胞间存在大量大冰晶和空洞,致使纤维束变形以及细胞结构发生变位,肌肉组织的完整结构荡然无存。在水产品低温贮藏过程中,产生冰晶粒径越小水产品组织形态及质量水平就越能得到保持[32]。通过我们的实验可以看出,低压静电场的添加可以有效减小冰晶粒径,这一作用的机理可能是低压静电场通过改变物料结冰点,很大程度上降低大冰晶凝聚速率,通过增加冰晶数目、减小冰晶粒径使得冰晶微粒能够分布均匀[3]。蓝点马鲛鱼在低温微冻贮藏时,形成的小冰粒会在一定程度保护细胞组织的完整性,从而延长产品的保藏期限,达到解冻后品质最佳的目的。
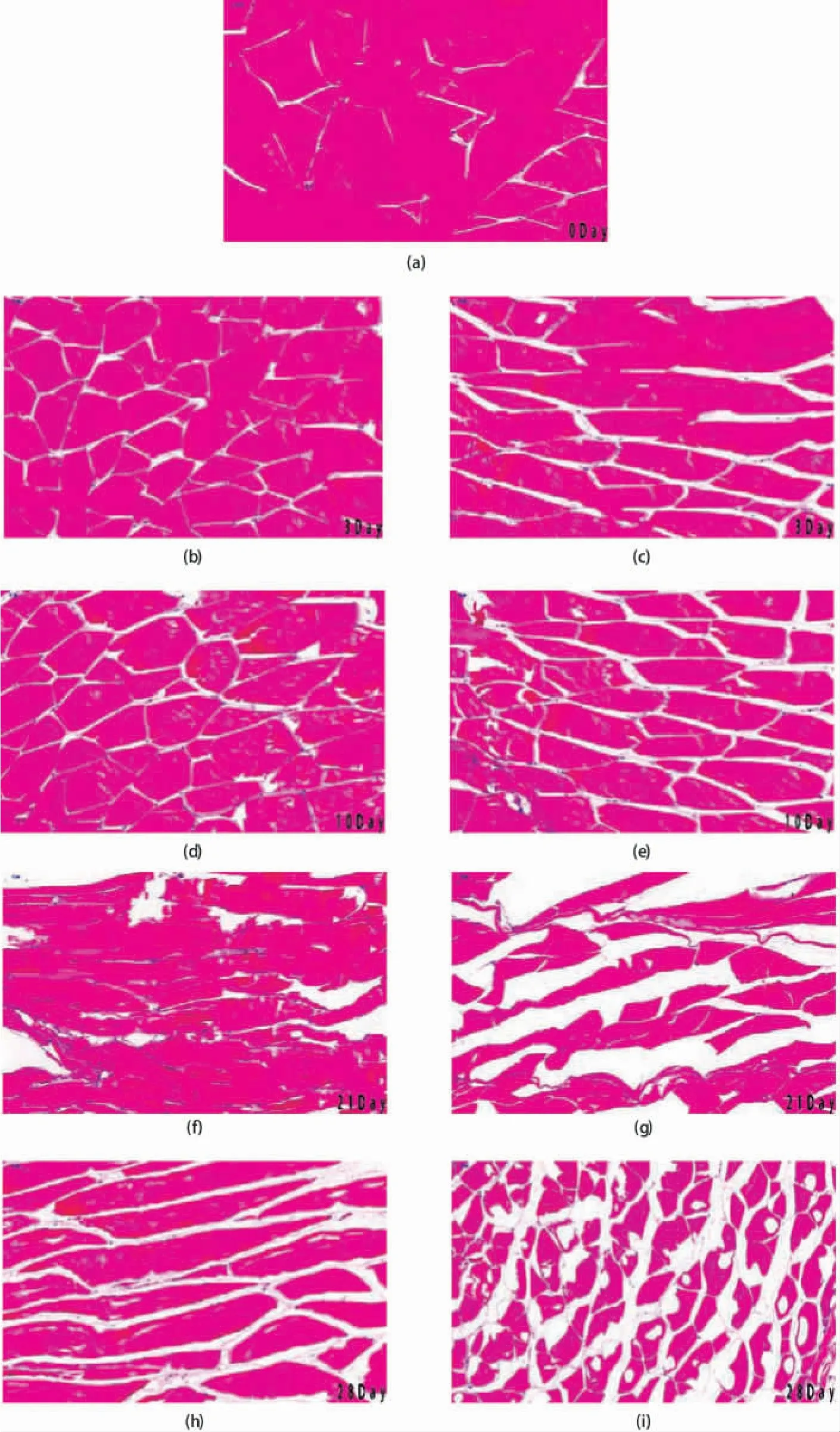
图7 两种条件下蓝点马鲛背部肌肉横向切面图Fig.7 S.niphonius back lateral section under two conditions
2.8 两种条件下蓝点马鲛SEM 扫描电镜组织微观结构分析
蓝点马鲛作为舟山常见经济鱼类,其肉质较为紧实细腻,在低温贮藏过程中随着贮藏时间的延长,其肌肉组织的微观结构也发生了一定程度的变化,有效观察这一变化并加以分析能够帮助我们对LVEF 技术作用下产品的品质变化规律进行准确的分析。实验采用具有较高放大倍数的SEM 扫描电镜对产品组织微观结构观测分析。在10 μm 范围观察新鲜蓝点马鲛,其肌原纤维束细密无间隙,细胞结构完整大小均匀。在贮藏期达到3 d 的(b)图和(e)图中没有能观察到明显区别,空白组相比之下出现少量冰晶形态物质,这些冰晶形态物质由肌原纤维与网状组织组成,这也与前文H&E 染色分析结果相似。在贮藏期达到15 d时图(c)和图(f)可以观察到较为明显的差异,50 μm 范围观察实验组整体变化较小,其肌原纤维排列整齐,原生质膜清晰,絮状物质与细丝出现了粘连现象;未处理的空白组观察到了粗丝断口且能看到断口有很多拔出状纤维,冰晶尺寸和纤维空隙逐渐增大。在贮藏期达到28 d 时,于100 μm 范围能够观察到空白组的整体肌肉内部组织的微观结构受到了剧烈破坏,肌原纤维纤维束分解并发生严重扭曲变形,细胞骨架可以观测到明显的形状紊乱及错位;横向对比实验组(d)样品,看到其虽然出现了肌肉组织合并粘连现象,但内部结构并未受到破损,两组样品观察到的结果呈现出了显著的差异。由此我们可以得出,通过对蓝点马鲛添加低压静电场处理,由低温造成鱼肌肉组织微观结构劣化以及其他不良影响被大幅抑制,这一结果与菌落总数等其他理化指标结论一致,能够有效验证了前文H&E 染色实验结果。
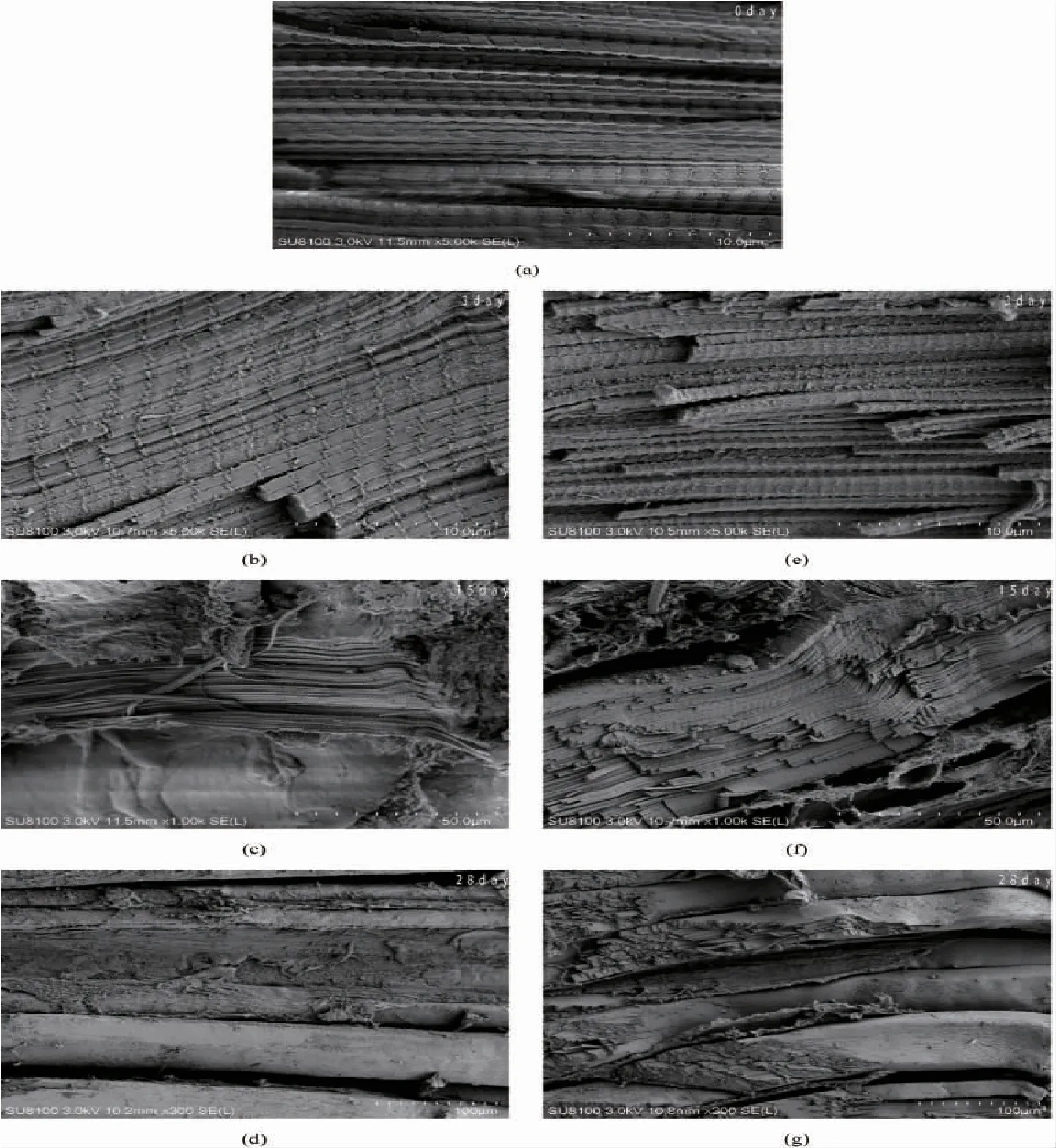
图8 两种条件下蓝点马鲛SEM 电镜图Fig.8 SEM electron micrograph of S.niphonius under two conditions
3 结论
以蓝点马鲛为研究对象,探讨了静电场保鲜技术对其微冻保存过程中品质的影响。得出结论:新鲜蓝点马鲛在低压静电场-微冻贮藏条件下保鲜效果更佳。保存28 d 后,空白组TVB-N 值达到了33.45 mg·100-1·g-1已不可食用,硫代巴比妥酸值(TBA 值)为1.81 mg·100-1·g-1,鱼体脂肪严重氧化且肌肉呈现分离断裂的状态,整体品质破坏程度大;实验组的保鲜效果则明显优于空白对照组,各项指标也均优于空白组,实验在28 d 时实验组的K 值为62.19%远低于空白组,pH 在±0.33 之内波动,波动范围较小,鱼体肌原纤维结构完整,肌肉纤维无明显裂痕,新鲜度高。这说明低压静电场-微冻保鲜能有效抑制生物酶和微生物的活性、鱼体脂肪氧化酸败,延长水产品贮藏保鲜时间,为水产品保鲜开辟了新道路。

