血清癌胚抗原对表皮生长因子受体基因突变非小细胞肺癌分子靶向治疗疗效的预测价值
王翠翠,耿利民
1.陕西省渭南市中心医院(渭南714000);2.陕西省安康市中心医院(安康725000)
非小细胞癌(Non-small cell lung cancer,NSCLC)是肺癌最常见的病理类型,约占整个肺癌患者的80%,且确诊后约有70%的患者已处于晚期阶段而失去手术时机。随着分子生物学检测技术的普及和发展,有研究表明,临床中约有40%~50%的NSCLC患者存在表皮生长因子受体(Epithelial growth factor receptor,EGFR)基因突变[1],对于此类患者,传统化疗已很难满足临床的治疗需求,近些年,以表皮生长因子受体-酪氨酸激酶抑制剂(EGFR-TKIs)为代表的分子靶向治疗为NSCLC患者带来新的希望,且被临床推荐为EGFR基因突变的晚期患者一线治疗方案[2]。当前,如何早期评价及预测此类分子靶向治疗的疗效及预后一直是肿瘤科关注的重点问题,既往常借助于影像学手段进行评估,然而在治疗过程中EGFR-TKIs存在一定耐药性[3],早期利用影像学检查并不能灵敏的做出准确的预判。癌胚抗原(Carcinoembryonic antigen,CEA)是临床常见的肿瘤标志物之一,可准确反映肿瘤细胞增殖程度与肿瘤负荷,且与肺癌的转移扩散、复发消退密切相关[4]。本研究旨在探讨血清CEA对EGFR基因突变的晚期NSCLC患者分子靶向治疗疗效的预测价值。
资料与方法
1 一般资料 选择2017年1月至2019年1月我院收治的EGFR基因突变的晚期NSCLC患者82例为研究对象,纳入的82例患者,男20例,女19例;年龄41~71岁,平均(56.34±7.19)岁。病例纳入标准:①诊断参照《中国非小细胞肺癌患者表皮生长因子受体基因突变检测专家共识(2016版)》[5]相关标准,且均经过细胞学或病理组织学证实为EGFR基因突变;②临床分期属于Ⅲb、Ⅳ期,且预期生存时间≥3个月;③患者均有≥1个可临床测量的肿瘤病灶。排除标准:对EGFR-TKIs药物过敏或不耐受者,主要临床资料缺失者。
2 治疗方法 纳入的患者均给予口服EGFR-TKIs治疗,其中吉非替尼,250 mg/次,1次/d;埃克替尼,125 mg/次,1次/d;厄洛替尼,150 mg/次,1次/d。1个月为1个疗程,所有患者均治疗2个疗程。
3 观察指标 ①血清CEA的测定。抽取空腹静脉血标本5 ml,离心10 min(2500 r/min)后取上清液,放置于-80 ℃冰箱内保存待测,CEA以电化学发光免疫法进行测定(试剂盒购自美国雅培公司),血清CEA正常参考值为0~5 ng/ml。②疗效评定。参照世界卫生组织(WHO)发布的实体瘤疗效评价标准(RECIST1.1)实施疗效评定[6]。分为4个等级[进展(PD)、稳定(SD)、部分缓解(PR)和完全缓解(CR)]。CR+PR为有效;CR+PR+SD为控制。无进展生存时间(PFS)定义为患者从开始治疗直至发生肿瘤进展或死亡的时间。
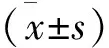
结 果
1 不同近期预后的晚期NSCLC患者治疗前后血清CEA比较 纳入的82例患者经过EGFR-TKIs治疗有效率为30.49%(25/82),控制率为64.63%(53/82)。与治疗前比较,CR+PR患者经治疗后的血清CEA水平明显降低(P<0.05),PD患者经治疗后血清CEA水平明显增加(P<0.05), SD患者则未见明显变化(P>0.05)。见表1。
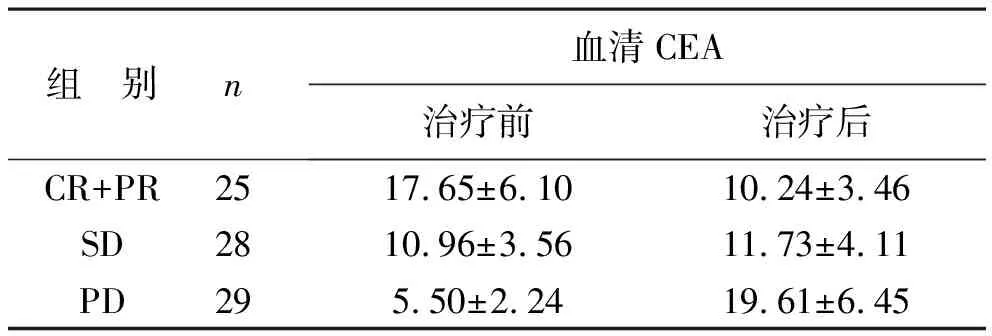
表1 不同近期预后晚期NSCLC患者治疗前后血清CEA比较(ng/ml)
2 晚期NSCLC患者不同临床特征与近期疗效的相关性比较 不同性别、年龄、吸烟史、病理类型、临床分期、ECOG体能状态评分、治疗药物、治疗线数的患者近期疗效比较差异无统计学意义(P>0.05)。治疗前基线CEA≥5 ng/ml的NSCLC患者临床疗效显著高于CEA<5 ng/ml者,差异无统计学意义(P<0.05)。见表2。
3 不同水平CEA的晚期NSCLC患者PFS生存曲线比较 采用Kaplan-Meier法绘制的PFS生存曲线显示,CEA≥5 ng/ml组与CEA<5 ng/ml组PFS分别为12.14个月(95%CI:6.53~21.20个月)和8.45个月(95%CI:5.20~15.71个月),两组经Log-rank检验比较差异有统计学意义(P<0.05),见图1。
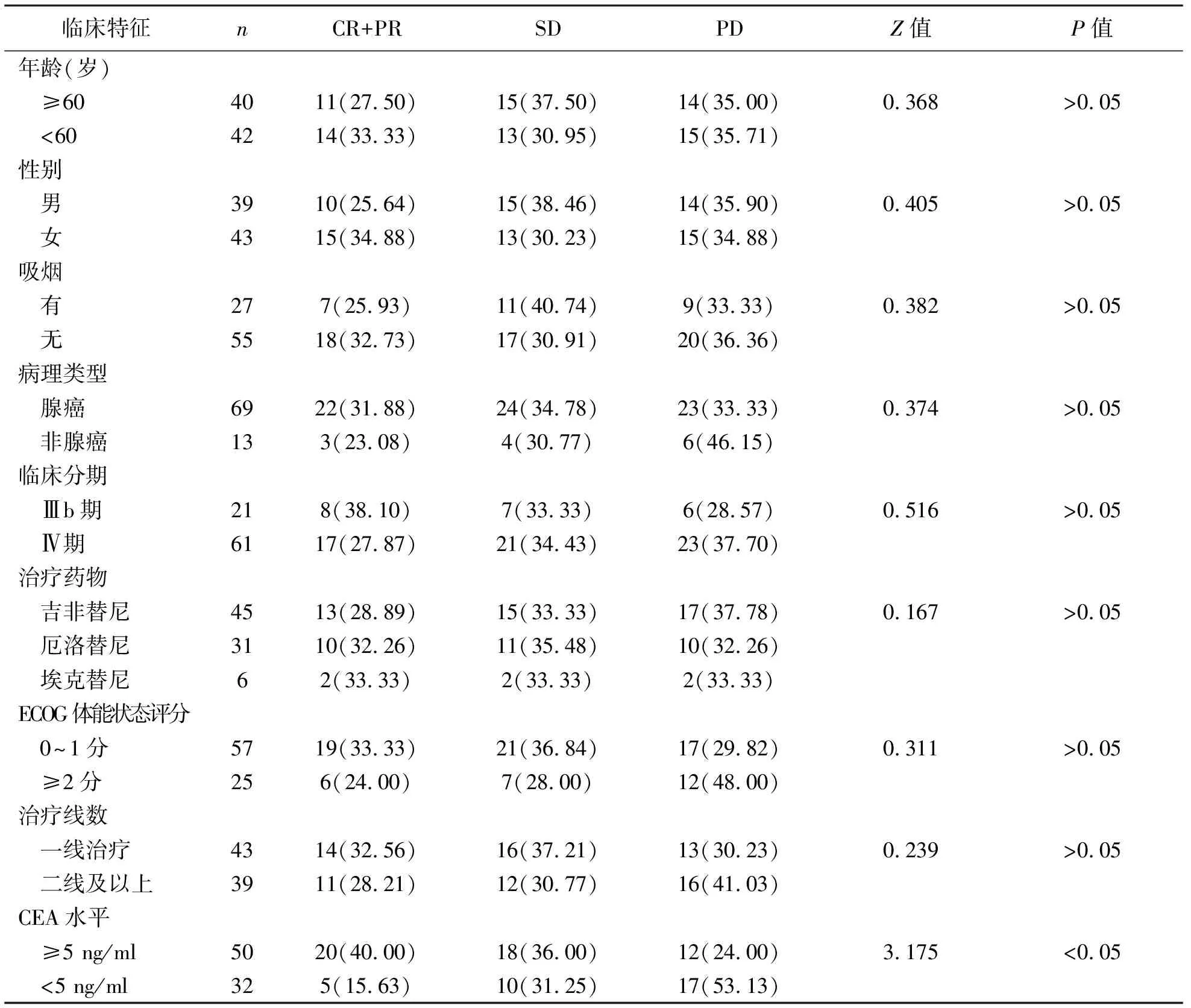
表2 晚期NSCLC患者不同临床特征与近期疗效的相关性比较[例(%)]
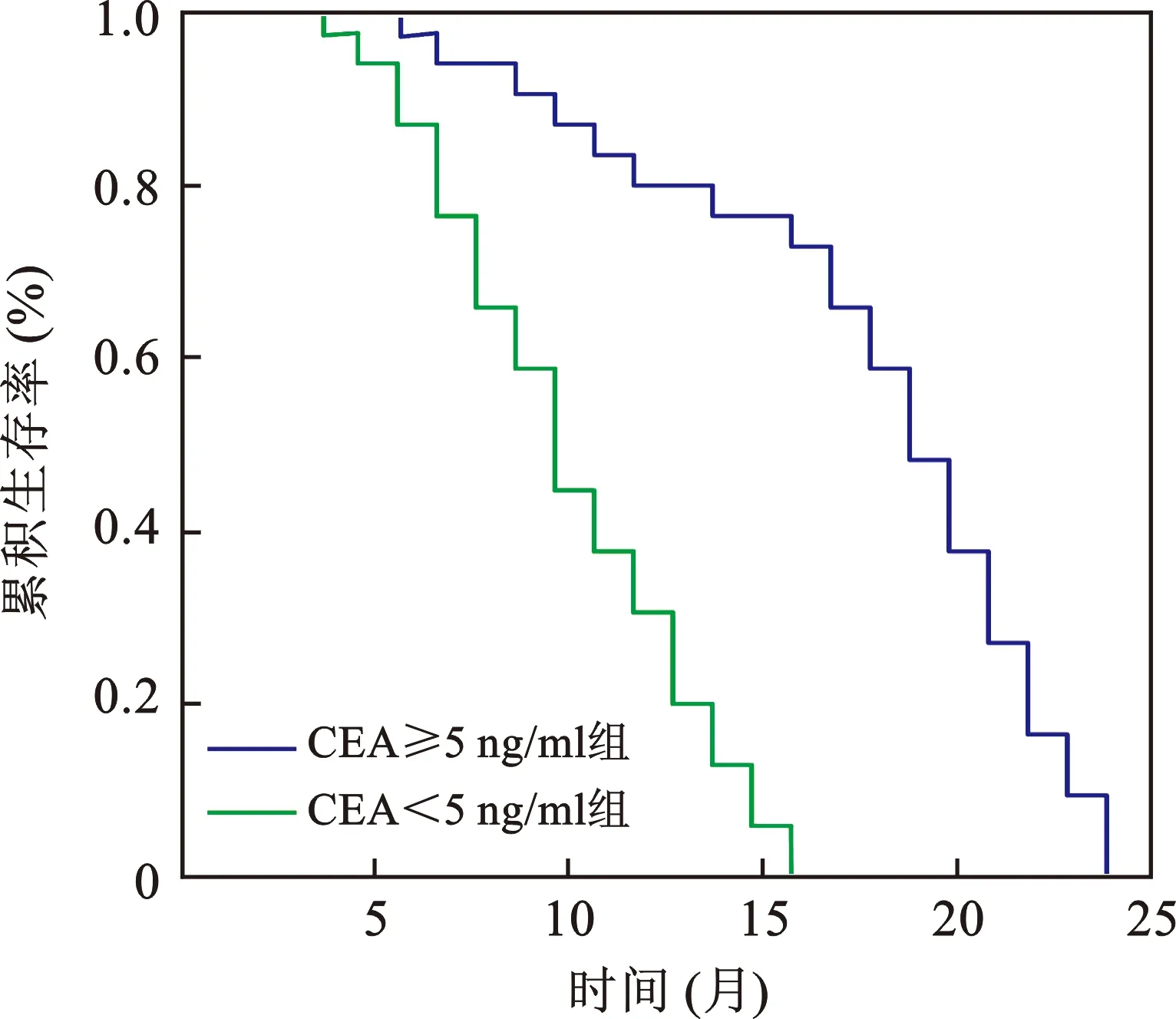
图1 不同水平CEA的晚期NSCLC患者PFS生存曲线比较
讨 论
EGFR基因突变在NSCLC中较为常见,有研究表明,在肺腺癌中其突变率约为50.2%,肺鳞癌患者突变率稍低,但也到达了14%~25%[7-8]。目前,以突变的EGFR基因为治疗靶点的分子靶向治疗成为了晚期、复发或转移NSCLC患者的重要手段。EGFR-TKIs是临床常用的靶向药物,此类药物疗效较为确定,且毒副反应较轻,可显著延长患者PSF[8-9]。现代药理学研究表明,EGFR-TKIs可竞争性的与EGFR-酪氨酸激酶相结合,从而发挥阻断EGFR激活及其诱导的肿瘤细胞信号传导通路,抑制细胞周期进程和肿瘤细胞浸润扩散,促进肿瘤细胞凋亡的功能[10]。NSCLC患者经EGFR-TKIs治疗的疗效和预后评估手段仍存在一定局限性,本研究通过监测治疗前后、不同临床特征患者的血清CEA水平,为此类患者靶向治疗疗效和预后的评估提供了参考依据。
CEA是一种具有特殊生理功能的可溶性糖蛋白,在健康人群中几乎不被测出,而在乳腺癌、消化道恶性肿瘤、肺癌中可出现不同程度的表达增高[11]。有研究表明,CEA参与了细胞黏附过程,在肿瘤细胞扩散转移扮演了关键的角色,此外,CEA还能间接评价NSCLC患者肿瘤细胞增殖与生长状况[12]。有文献报道已证实,EGFR-TKIs治疗可通过降低肺癌患者的肿瘤细胞代谢能力与肿瘤负荷,从而下调外周血CEA表达水平[13]。当经过靶向治疗后外周血CEA表达水平未能有效降低,甚至仍保持在高水平表达状态,则提示晚期NSCLC患者治疗疗效较差,肿瘤细胞仍处于活跃增殖状态。本研究结果显示,在治疗有效的患者中(CR+PR)血清CEA水平较治疗前明显降低,提示了CEA可作为评价NSCLC患者靶向治疗疗效的有效肿瘤标记物。
CEA检测具有可重复性强,成本低廉、操作简单等诸多优点,同时监测血清CEA表达水平可以评估晚期NSCLC患者复发和转移、治疗情况。本研究结果显示,与CEA<5 ng/ml患者比较,治疗前CEA≥5 ng/ml的肺癌患者治疗疗效明显较高,且差异有统计学意义。提示了治疗前高水平CEA的肺癌患者对于分子靶向治疗更为敏感,可能是EGFR-TKIs治疗有效的早期预测信号。有研究表明,高水平CEA还与EGFR基因突变密切相关,突变的EGFR基因可激活下游信号通路,不仅抑制了肿瘤细胞凋亡,还导致了抗细胞凋亡的CEA表达水平代偿性增高,EGFR突变率越高,则CEA水平越高[14-15]。因此,间接推断治疗前高水平CEA与晚期NSCLC患者EGFR-TKIs治疗疗效具有相关性。本研究采用Kaplan-Meier法绘制的PFS曲线显示,治疗前CEA≥5 ng/ml组的中位PFS显著优于CEA<5 ng/ml组,差异有统计学意义。这也提示了治疗前基线CEA水平可以作为评价此类患者靶向治疗后预后情况的预测指标。
与既往的研究比较,本研究不仅探讨了EGFR-TKIs治疗疗效,还分析了血清CEA对晚期NSCLC患者分子靶向治疗后的疗效和预后的评估价值和意义。治疗前高水平CEA患者常预示着可能取得更好的靶向治疗疗效,治疗后CEA水平降低越显著,则可能对靶向治疗更为敏感,疗效更为确定,且可能得到更长的PFS。本研究仍存在一定局限性,如纳入样本量有限,且属于单中心病例,因此还需要在今后临床工作中扩大样本量做多中心的临床研究以证实本结论。

